镉胁迫下钙素对嗜鱼外瓶霉生长以及矿质元素和镉含量的影响*
于良君,何友盛,姚 智
(1.云南农业大学 学报编辑部,云南 昆明 650201;2.云南农业大学 资源与环境学院,云南 昆明 650201;3.云南大学 资源植物研究院/农学院,云南 昆明 650504)
嗜鱼外瓶霉(Exophiala pisciphila)是一种对重金属离子具有极强耐性和富集能力的深色有隔内生真菌(dark septate endophytes,DSE),其产孢方式以环痕产孢为主,具有典型的横隔膜和微菌核结构[1]。在鱼类(Piscis)、狗(Canis lupus familiaris)、马(Equus caballus)和甜菜胞囊线虫(Heterodera schachtii)虫卵的动物宿主体表以及桉树(Eucalyptus robustaSmith)、豌豆(Pisum sativumL.)和小麦(Triticum aestivumL.)等植物根际土壤中可以分离获得嗜鱼外瓶霉[2]。张玉洁等[3]从云南会泽铅锌矿区自然生长的植物密序野古草[Arundinella bengalensis(Spreng.) Druce)]健康根内分离得到1 株嗜鱼外瓶霉,并发现该菌对铅、锌、镉和铜等重金属离子具有极强的耐性和富集能力。接种试验发现:嗜鱼外瓶霉可以强化玉米根系对毒性重金属离子的固持作用,提高宿主植物对镉的耐受性[4];还可将不溶性无机磷转化为可溶性磷酸根(PO43-),促进宿主植株对磷的吸收[5]。可见,嗜鱼外瓶霉在增强植物重金属耐受性和治理土壤重金属污染等方面有巨大的研究价值。
钙离子是一种具有生理活性的二价阳离子,对真菌生长代谢具有重要影响。外源施用钙可以提高真菌对重金属离子的耐性,如:外源添加钙离子可显著缓解铅、镉、砷和汞对香菇生长的毒害作用,在重金属胁迫下增加香菇菌丝体的生物量[6]。钙还可缓解或消除铝胁迫造成的外生菌根真菌Sl08 的抗氧化酶活性上升,提高其抗铝毒的能力[7]。已有研究发现:外源施用适量的硫[8]和褪黑素[9]有利于嗜鱼外瓶霉生长,可增强其对镉的耐受能力,但未见钙对镉胁迫下嗜鱼外瓶霉影响的相关报道。本研究分析了镉胁迫下不同钙浓度处理对嗜鱼外瓶霉生长、矿质营养和镉含量的影响,以通过控制不同钙浓度水平探究嗜鱼外瓶霉对镉的耐受性,为探讨嗜鱼外瓶霉应对重金属胁迫的机制以及利用钙与嗜鱼外瓶霉的协同作用提高植株重金属耐受性研究奠定基础。
1 材料与方法
1.1 试验材料
供试嗜鱼外瓶霉分离自云南会泽铅锌矿区自然生长的密序野古草根部,现保存于中国农业微生物菌种保藏中心,菌株编号为ACCC32496。
试剂和药品:蒸馏水(埃尔格纯水机);CdCl2·2.5H2O 和CaCl2·6H2O (分析纯,天津市风船化学试剂科技有限公司);Na2SO4(分析纯,广东光华化学厂有限公司) 。试验器材:紫外可见分光光度计(UV-5800 型,上海元析仪器有限公司);恒温摇床(TS-211B,上海天呈实验仪器制造有限公司);火焰原子吸收分光光度计(iCE 3000 SERIES,Thermo) 。
1.2 试验设计
称取1.015 g CdCl2·2.5H2O 溶解于5 L Modified Melin-Norkrans Broth (MMN)液体培养基[10],配制为100 mg/L Cd2+质量浓度;在此基础上分别加入0.03、0.15、0.30、1.50 和3.00 g CaCl2,配制为5 个Ca2+浓度(0.045、0.225、0.450、2.250和4.500 mmol/L)处理。将每瓶900 mL 的培养基平均分装至6 个250 mL 的三角瓶中作为平行,共30 个平行处理,各放入1 枚直径为4~6 cm 的嗜鱼外瓶霉,于28 ℃、120 min/r 恒温摇床连续培养7 d。
1.3 指标测定
将培养7 d 的培养液过滤,分离出菌丝,于75 ℃下烘干48 h,称得菌丝干质量;采用血球计数法测定培养液孢子数[11];用pH 计测定培养液pH 值。参考《土壤农化分析》[12]的方法,菌丝镉(Cd)、钙(Ca)、镁(Mg)和硫(S)采用浓 HNO3—HClO4消解制样,并用火焰原子吸收分光光度法测定含量;菌丝中氮(N)和磷(P)采用浓 H2SO4—H2O2消解法制样,分别采用奈氏法和钼锑抗比色法测定含量。
1.4 数据处理与统计分析
采用Excel 整理数据;采用SPSS Statistics 26 进行单因素方差分析(ANOVA);采用最小显著差数法(LSD)和新复极差法(Duncan’s)进行多重比较;采用Origin 2021 绘图。
2 结果与分析
2.1 镉胁迫下不同浓度钙对嗜鱼外瓶霉菌丝干质量、孢子数和培养液pH 值的影响
由表1 可知:Cd 胁迫下,随着培养液中Ca2+浓度的增加,嗜鱼外瓶霉菌丝干质量、孢子数和pH 值均呈先升高再降低的变化趋势,其中,0.225 mmol/L Ca2+处理下菌丝干质量、孢子数和培养液pH 值均达到峰值。
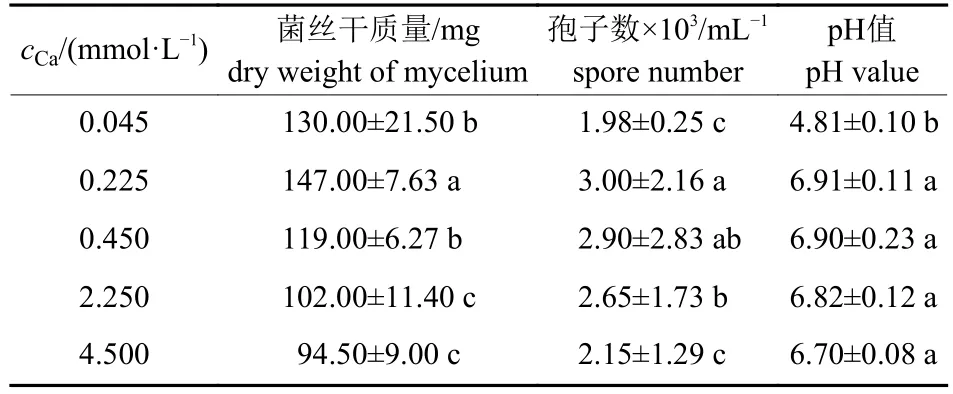
表1 不同浓度钙对嗜鱼外瓶霉菌丝干质量、孢子数和培养液pH 值的影响Tab.1 Effects of different calcium concentrations on the dry weight of mycelium,spore number and pH value of culture medium of Exophiala pisciphila
2.2 镉胁迫下不同浓度钙对嗜鱼外瓶霉菌丝镉含量的影响
由图1 可知:培养液中的Ca2+浓度可显著影响嗜鱼外瓶霉菌丝的Cd 含量。随着培养液中Ca2+浓度的增加,菌丝Cd 含量呈先上升后下降的变化趋势,0.450 mmol/L Ca2+处理下菌丝中Cd含量最高。

图1 不同浓度钙培养液对菌丝镉含量的影响Fig.1 Effects of different calcium concentrations on the cadmium content in mycelium
2.3 镉胁迫下不同浓度钙对嗜鱼外瓶霉菌丝矿质元素含量的影响
由图2 可知:Cd 胁迫下,培养液中Ca2+浓度可显著影响嗜鱼外瓶霉菌丝Mg、N、P、Ca 和S 的含量,其中,随着培养液Ca2+浓度的增加,菌丝中Mg 和P 含量呈下降趋势,Ca 和S 含量呈上升趋势,N 含量呈先下降后上升的变化趋势。100 mg/L Cd 胁迫下,与0.450 mmol/L Ca2+处理相比,0.045 mmol/L Ca2+处理下嗜鱼外瓶霉菌丝的Mg、N 和P 含量分别显著增加6.2%、77.8%和24.0%,Ca 含量显著下降53.0%;而4.500 mmol/L Ca2+处理下菌丝Ca、N 和S 含量分别显著上升76.8%、38.4%和12.0%,Mg 含量则显著下降19.9%。值得注意的是,不同浓度Ca2+处理时,菌丝中Ca 含量随着Ca2+浓度的增加而增加。
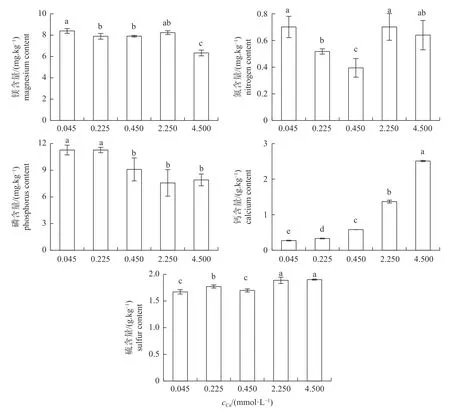
图2 不同浓度钙对嗜鱼外瓶霉菌丝中矿质元素的影响Fig.2 Effects of different calcium concentrations on the mineral elements in mycelia of Exophiala pisciphila
2.4 相关性分析
由表2 可知:菌丝干质量与Ca 含量呈极显著负相关(P<0.01),与P 含量呈极显著正相关(P<0.01),与Mg 和S 含量呈显著负相关(P<0.05);菌丝Cd 含量与Ca 和S 含量呈极显著负相关(P<0.01),与Mg 含量呈极显著正相关(P<0.01),与N 含量呈显著负相关(P<0.05),与P 含量呈显著正相关(P<0.05);培养液Ca 含量与菌丝Mg 和P 含量呈极显著负相关(P<0.01),与菌丝Ca 和S 含量呈极显著正相关(P<0.01)。上述结果表明:菌丝干质量受Ca、Mg、S 和P 的影响;Cd 胁迫下,菌丝Cd 含量与Mg 和P 的吸收具有协同作用,与Ca 和S 的吸收具有拮抗作用;培养液外源添加钙可改善菌丝对营养液中Ca 和S 元素的吸收,会抑制Mg 和P 的吸收。

表2 菌丝干质量、菌丝Cd 含量、培养液Ca 含量与菌丝矿质营养含量的相关性分析Tab.2 Correlation analysis among dry weight of mycelium,cadmium content of mycelium,calcium content of culture solution and mineral nutrition content of mycelium
3 讨论
3.1 钙对镉胁迫下嗜鱼外瓶霉菌生长发育及菌丝镉含量的影响
Cd 具有很强的生物毒性,可抑制真菌菌丝生长,但来源与遗传背景不同的真菌对Cd 的耐受性有较大差异[2]。嗜鱼外瓶霉是具有极端耐性的真菌,在多种重金属胁迫下仍具有生长发育的能力[13]。本研究表明:嗜鱼外瓶霉在Cd 胁迫下仍能生长,且添加适量Ca 可以显著促进菌丝的生长发育,并降低Cd 胁迫的抑制效应,这主要是因为Ca 是植物和微生物生长发育的重要调节因子之一,对于维持细胞壁和细胞膜的稳定性以及阴阳离子的平衡具有重要作用;同时,Ca2+作为第二信使感受、传递和响应环境信号的变化,可直接调控部分抗氧化酶的活性[7,14]。本研究还发现:0.045 和4.500 mmol/L Ca2+处理下嗜鱼外瓶霉的菌丝干物质量、孢子数和镉含量偏低,这可能是因为低浓度Ca 不能满足菌丝正常生长所需的Ca2+;Ca 能与Cd 竞争在细胞内结合的位点,从而减少Cd 的吸附和积累,这一结果提示Ca 对调节Cd 在生物体内的转运和分配具有潜在作用[15-17]。已有研究表明:外源添加Ca2+可显著降低香菇中的Cd 含量[18-20];本研究也显示:0.225和0.450 mmol/L Ca2+处理总体有利于嗜鱼外瓶霉菌丝生长,这为Cd 污染土壤的修复提供了一种潜在策略。需要注意的是,本研究是在实验室条件下进行的,实际环境中受其他因素的影响可能会与本研究结果有所不同,因此,还需要进一步研究验证本研究结果,并探索Ca 在Cd 污染土壤修复中的应用潜力。
3.2 钙对镉胁迫下嗜鱼外瓶霉矿物质积累的影响
有研究表明:土壤中的部分微生物在代谢过程中产生各种酶类,如核酸酶、磷酸酶和硫酸酶等,这些微生物可将磷酸盐溶解为植物可以吸收利用的可溶性磷[5]。本研究中Cd 胁迫导致嗜鱼外瓶霉菌丝P 含量减少,分析其原因可能是嗜鱼外瓶霉分泌的酶类物质生物解磷所致。Cd 胁迫下,谷胱甘肽(glutathione,GSH)代谢在机体做出响应以缓解Cd 胁迫对微生物造成的毒害作用,是生物体内减缓Cd 毒害作用的重要物质;S 是GSH 的重要组成成分[17-18],本研究Cd 胁迫下菌丝S 含量增加,其原因可能是嗜鱼外瓶霉菌丝通过增加S 的吸收促进GSH 合成,以此缓解Cd 对菌丝体的毒害作用,同时提升机体的重金属耐受性。Cd 与Ca 存在交互作用,菌丝中Ca 含量的增加可能是Cd 增加聚磷酸盐含量,而聚磷酸盐被认为是离子运输的载体,Ca2+与聚磷酸盐的结合强于Cd2+,从而使菌丝Ca 含量增加[19-21]。因此,真菌应对重金属胁迫的机制可能是通过改变菌丝的矿质营养元素含量以减轻细胞内游离态金属离子对细胞的毒害作用[3]。
3.3 矿质元素与嗜鱼外瓶霉菌丝干质量、镉含量和钙累积的相关性
矿质元素在菌丝生长过程中起着重要的作用,真菌的生长需要大量矿质营养元素(如N、P、K)和微量矿质营养元素(如Mg、S、Cu、Ca等)[21-24]。重金属胁迫下可能导致生物矿质营养元素缺乏,产生毒害症状[2]。本研究表明:不同的矿质元素对菌丝干物质累积和Cd、Ca 元素累积的影响有较大差异。P 含量与菌丝干质量呈极显著正相关,这是由于P 的添加能够直接促进菌丝对P 的吸收和菌丝的淀粉酶活性,与徐柯[24]的研究结果相似。Ca 和S 可显著抑制菌丝对Cd 的积累,这是因为Cd2+和Ca2+具有非常相似的物理化学性质,且已有研究表明:Cd2+可以在菌丝体外置换钙调蛋白、肌膜和肌钙蛋白C 中Ca2+的结合位点,并有可能影响其他Ca2+结合蛋白[15-17]。而S 的增加能使机体合成更多的含硫化合物(如GSH),以抵御重金属Cd 的毒害[25]。不适宜的Ca 浓度会胁迫菌丝生长,从而导致MMN 培养液中的Ca 和S 过剩。需要注意的是,矿质元素与嗜鱼外瓶霉的相互作用是一个复杂的系统,受多种因素的综合影响[26],因此,在进行相关性分析时需要尽可能控制其他影响因素的干扰,以获得准确、可靠的结果。
4 结论
嗜鱼外瓶霉菌丝培养过程中,添加适量Ca可以促进菌丝生长,且以0.225 mmol/L Ca2+最有利于菌丝和孢子生长,也有利于菌丝累积N、P、Mg 和S。为了减轻菌丝对Cd 的吸附,可适量添加P 和Mg;不适宜的矿质元素浓度则会毒害菌丝生长。

