百合LoXTH23 基因克隆、生物信息学分析及在鳞茎休眠解除过程中的表达动态*
张济民,王 浩,贾文杰,孙 亮,张小平,王有国
(1.云南农业大学 园林园艺学院,云南 昆明 650201;2.云南省农业科学院 花卉研究所,云南 昆明 650205;3.金华职业技术学院 农学院,浙江 金华 321016)
XTHs基因在植物生长发育的各个阶段均有表达,其作用受到广泛关注。AtXTH31基因在拟南芥(Arabidopsis thaliana)中参与调控根的生长和伸长生长[9];AtXTH基因家族的其他基因如AtXTH15、16、17、19则是通过影响细胞壁伸长生长来调控拟南芥叶柄的长度[10];CaXTH1基因在鹰嘴豆(Cicer arietinumLinn.)上胚轴中特异性表达,且其表达量与聚乙二醇(polyethylene glycol,PEG)影响上胚轴发育呈正相关,因此CaXTH1基因可能对种子萌发过程中上胚轴的伸长具有重要作用[11];GmXTH38基因通过调控脯氨酸与超氧化物歧化酶含量在大豆(Glycine max)抗干旱胁迫中起到重要作用[12];OsXTH基因家族在水稻(Oryza sativa)抗干旱胁迫中起到关键作用[13];而在拟南芥中超表达XTH家族基因可以明显检测出XEH 酶活性增强以及细胞壁结构发生变化,且超表达植株叶形显著区别于野生型植株[14-15]。此外,PAN 等[16]通过转录组测序发现:XTHs基因在天麻种子休眠解除中呈差异性表达,可能在这一过程中起到重要作用;MA 等[17]研究发现:在龙眼种子发育的早期,XTHs 类基因扮演着关键角色。可见,XTHs基因在植物的生长发育以及植物响应逆境胁迫方面具有重要作用,但对于XTHs 类基因在休眠中如何起作用,尤其是在百合种球休眠中的作用尚不清楚。
百合(Liiumspp.)是百合科(Liliaceae)百合属(Lilium)多年生草本球根植物,其花色丰富、气味芳香而深受消费者喜爱,是世界上主要的鲜切花之一。由于百合鳞茎的休眠特性,即休眠解除过度或解除不彻底,将会影响百合成花质量,导致其鲜切花品质和产量双重下降,造成巨大的经济损失,因此,百合在生产上一直受限于种球休眠解除不整齐等因素,无法周年供应[18],限制了其产业发展。因此,探究百合种球的休眠机制具有重要意义。课题组前期的转录组分析发现LoXTH23基因与百合鳞茎的休眠解除密切相关,本试验使用RT-PCR 克隆西伯利亚百合LoXTH23基因,利用生物信息学软件对该基因进行序列分析,以期为研究LoXTH23基因对百合鳞茎解除休眠的作用机制提供一定的理论参考。
1 材料与方法
1.1 供试材料、试剂和设备
供试材料:西伯利亚百合小鳞茎,繁殖于云南农业大学试验基地。选取生长状态良好、大小一致、鲜质量小于0.4 g 的百合小鳞茎平均分成2 组,每组30 个(含3 次重复),其中一组用蒸馏水浸泡2 h 处理(CK),另一组用100 μmol/L 乙烯溶液浸泡2 h 处理(预试验显示该浓度乙烯处理的百合小鳞茎先于对照组萌发)。处理完毕后用吸水纸吸干,将小鳞茎接种到琼脂作为基质的玻璃瓶中,每瓶接种5 个小鳞茎;然后将其置入28 ℃恒温箱中黑暗培养30 d,取出材料后保存于—80 ℃冰箱备用。
主要试剂:植物总RNA 快速提取试剂盒购自北京华越洋生物科技有限公司;反转录试剂盒、胶回收试剂盒、质粒DNA 提取试剂盒和DL 2000 DNA Marker 购自南京诺唯赞生物科技股份有限公司;TaqPCR Mix 预混液和克隆载体PESIT 购自翌圣生物科技(上海)股份有限公司;大肠杆菌感受态DH5α 由昆明硕擎生物技术有限公司提供;核酸染料Green 和限制性内切酶购自生工生物工程(上海)股份有限公司;其他试验药品均为国标分析纯或生物纯,购自源叶生物(上海)股份有限公司。
主要设备仪器:HC-3018R 高速冷冻离心机;Nanodrop2000 超微量分光光度计;Bio-Rad PCR仪;GSP-9160MBE 恒温培养箱;DYY-7C 电泳仪;TU-1810 暗箱式紫外透射仪;THZ-C 恒温振荡器。
1.2 试验方法
1.2.1百合小鳞茎总RNA 提取及cDNA 第1 链的合成
使用总RNA 快速提取试剂盒提取百合小鳞茎总RNA;使用cDNA 第1 链合成试剂盒进行反转录,使用Nanodrop2000 超微量分光光度计检测样品浓度,检测合格的cDNA 于—20 ℃储存备用。
为了解决学生这些疑问,任课老师收集大量资料之后,制定了以“晏子为何使楚”为主题的微课。在微课中,老师模仿大师单田芳说评书的风格,将晏子使楚的必要性用故事化的形状告诉学生。
1.2.2LoXTH23基因克隆
依据课题组前期转录组筛选的LoXTH23基因序列,使用Primer Premier 5 软件以及NCBI 引物设计工具设计RT-PCR 引物和qRT-PCR 引物,以Actin基因作为内参基因(表1)[19]。引物由昆明硕擎生物技术有限公司合成。
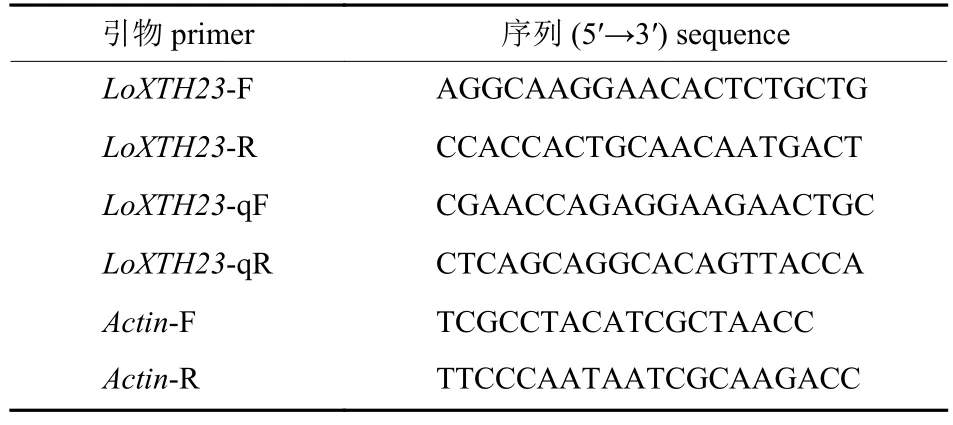
表1 引物序列Tab.1 Primer sequences
以cDNA 第1 链为模板进行扩增,PCR 反应体系为50 μL,包括cDNA 模版1 μL,正、反向引物各1 μL,TaqPCR Mix 预混液25 μL,去离子水22 μL。PCR 反应条件为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸10 min,共30 个循环,72 ℃延伸5 min。将PCR 纯化产物连接至pESI-T 载体上,将10 μL 连接产物转化大肠杆菌感受态DH5α,37 ℃培养12 h,经由蓝白斑筛选、菌液PCR 及双酶切验证筛选阳性克隆,将阳性质粒送至昆明硕擎生物技术有限公司进行测序验证。
1.2.3实时荧光定量PCR
以对照组和处理组百合小鳞茎各个时期以及不同组织的cDNA 为模板进行qRT-PCR。反应程序为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,40 次循环;溶解曲线制作:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。采用2—ΔΔCt相对定量分析法计算LoXTH23基因的相对表达量。
1.2.4生物信息学分析
采用生物信息学软件对LoXTH23基因结构和理化性质等进行分析。基因开放阅读框采用ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/)预测;在BLAST (http://blast.ncbi.nlm.nih.gov/blast/)进行序列比对和同源序列搜索;蛋白质的物理和化学性质采用ProtParam (http://web.expasy.org/protparam/)预测;蛋白质的亲水性和疏水性采用ProtScale (http://www.expasy.org/cgi-bin/protscale.pl)预测;蛋白跨膜区域采用TMHMM Server v.2.0 (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测;蛋白质信号肽采用SignalP 3.0 Server (https://services.healthtech.dtu.dk/service.php?SignalP-3.0)预测;蛋白质的亚细胞定位采用WoLF PSORT (https://wolfpsort.hgc.jp/)预测;蛋白质的保守结构域采用NCBI (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析;蛋白质的二级结构采用Expasy (htps://www.expasy.org/) 预测;蛋白质的三维结构采用SWISS-MODEL (https://www.swissmodel.expasy.org/)预测;采用Net Phos (https://services.healthtech.dtu.dk/services/NetPhos-3.1/)预测磷酸化位点;采用MEGA 软件构建系统发育树。
2 结果与分析
2.1 LoXTH23 基因克隆及测序结果
成功克隆并获得LoXTH23基因全长序列的目的条带,经电泳检测,扩增片段1 104 bp,与目标条带一致(图1);测序序列通过NCBI ORF Finder 预测显示:开放阅读框全长858 bp,编码285个氨基酸(图2)。
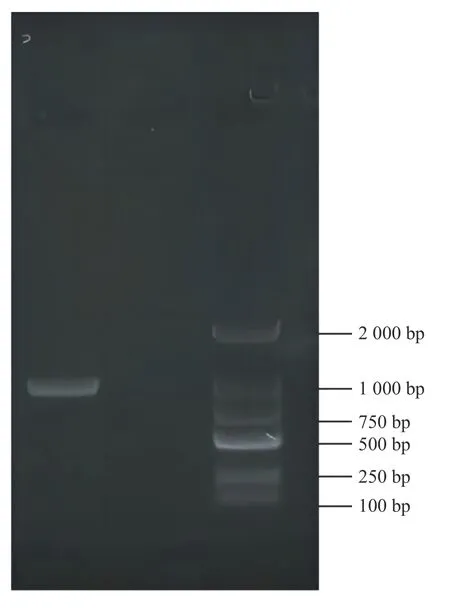
图1 LoXTH23 的PCR 产物Fig.1 PCR product of LoXTH23
2.2 LoXTH23 基因所编码蛋白的理化性质
LoXTH23基因编码的氨基酸残基序列中存在1 个典型的保守GH16 结构域,证实 LoXTH23蛋白属于XTH 家族成员蛋白(图3)。

图3 LoXTH23 基因编码蛋白质的保守域Fig.3 Conserved domain of LoXTH23 gene encoded protein
LoXTH23 蛋白质分子质量约为3.19 ku,理论等电点为6.19,分子式为C1436H2155N377O430S10,总原子数为4 408。由20 种氨基酸组成,其中亮氨酸和丝氨酸含量最丰富;甲硫氨酸和谷氨酸含量最低。带正电荷的残基(Arg+Lys)总数为21,带负电荷的残基(Asp+Glu)总数为23,该蛋白的不稳定指数为40.29;脂肪系数为70.53,总平均亲水性为—0.378。
2.3 LoXTH23 蛋白的疏水性
LoXTH23基因编码的氨基酸中存在较多区段处于0 刻度线以下(图4),表明该序列中亲水性氨基酸残基的数量多于疏水性氨基酸残基,为不稳定的亲水蛋白。
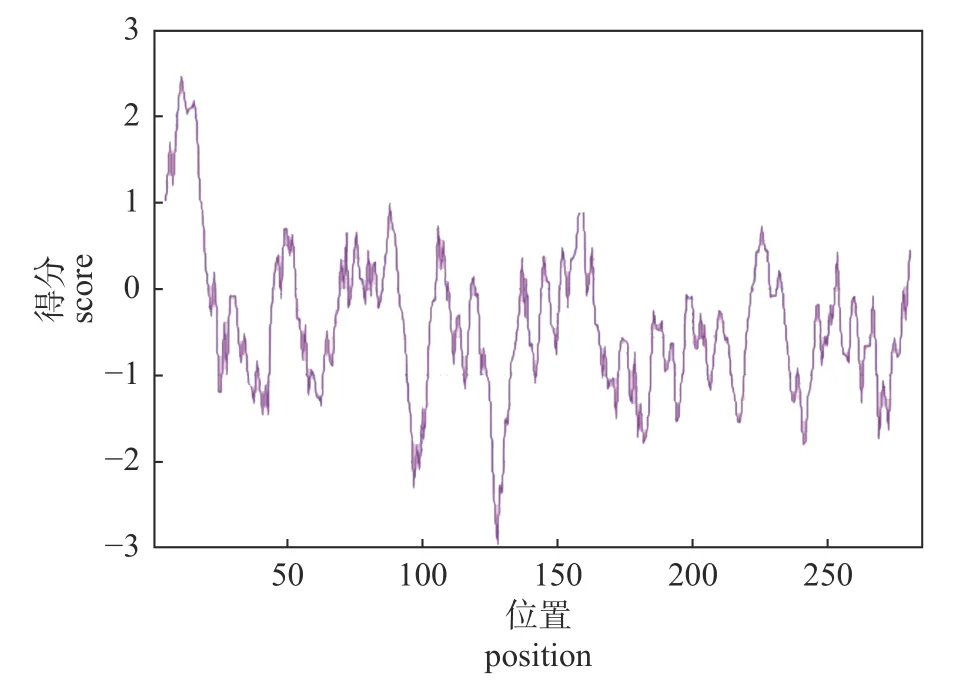
图4 LoXTH23 蛋白的疏水性预测Fig.4 Hydrophobic prediction of LoXTH23 protein
2.4 LoXTH23 蛋白的跨膜区及亚细胞定位
LoXTH23 蛋白序列的跨膜螺旋数量为0,预测跨膜螺旋的氨基酸残基数量为0.150 640;该蛋白质的前60 个氨基酸残基中预测的跨膜螺旋氨基酸残基数量为0.149 520,N-端位于细胞质侧膜的总概率为0.008 960,接近于0。预测整个蛋白质为膜外蛋白的概率超过1,而为膜内蛋白和跨膜蛋白的概率为0 (图5)。预测LoXTH23 蛋白定位于细胞外基质和液泡的分值分别为7 和4,表明 LoXTH23 蛋白可能定位于细胞外基质。

图5 LoXTH23 蛋白跨膜结构预测Fig.5 Prediction of the tansmembrance structure of LoXTH23 protein
2.5 LoXTH23 蛋白的二级和三级结构
LoXTH23 蛋白的二级结构预测结果(图6)显示:该蛋白包含有4 种二级结构,包括44 个氨基酸形成的α-螺旋(占15.44%)、88 条延伸链(占30.88%)、16 个氨基酸形成的β-转角(占5.61%)和137 条随机卷曲(占40.87%),因此,该蛋白的主要结构为随机卷曲;其三级结构预测结果(图7)显示:该蛋白三维模型主要以无规则卷曲为主,符合二级结构预测结果。

图6 LoXTH23 蛋白二级结构预测Fig.6 Prediction for the secondary structure of LoXTH23 protein
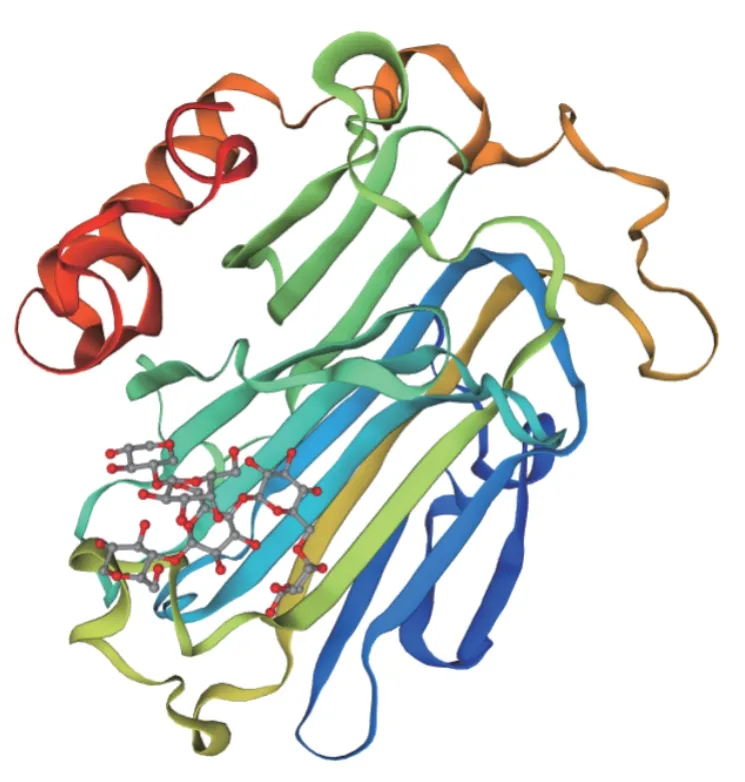
图7 LoXTH23 蛋白的三级结构预测Fig.7 Prediction for the tertiary structure of LoXTH23 protein
由图8 可知:LoXTH23基因编码蛋白的氨基酸残基原始剪切位点的最大值为0.663,信号肽最大值为0.684,综合剪切位点最大值为0.997,平均信号肽分值为0.840。
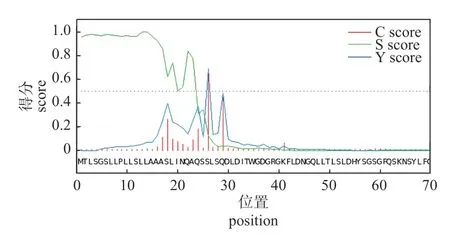
图8 LoXTH23 蛋白的信号肽预测Fig.8 Signal peptide prediction of LoXTH23
2.6 LoXTH23 蛋白磷酸化位点
预测LoXTH23 蛋白磷酸化位点为30 个,其中丝氨酸位点最多(20 个),表明该蛋白磷酸化位点以丝氨酸为主(图9)。
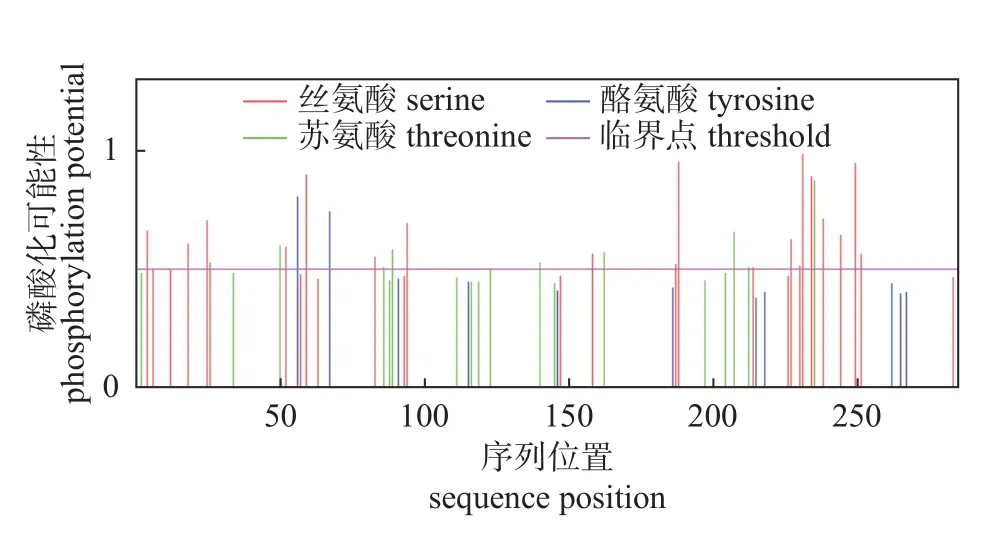
图9 LoXTH23 蛋白磷酸化位点预测Fig.9 Phosphorylation site prediction of LoXTH23 protein
2.7 LoXTH23 基因的系统发育树
由图10 可知:百合的LoXTH23与油棕(Elaeis guineensis)聚为一类,在进化上有一定的同源性,二者亲缘关系较近;与银白杨(Populus alba)和拟南芥(Arabidopsis thaliana)的亲缘关系较远。
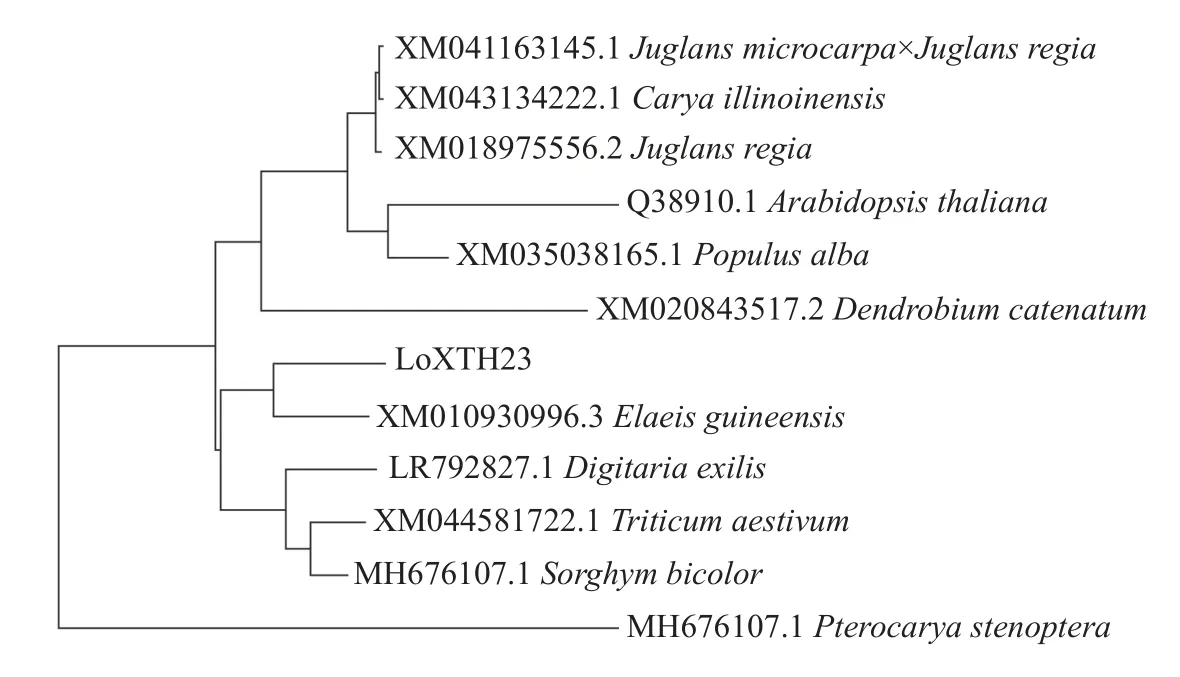
图10 LoXTH23 的系统发育树Fig.10 Phylogenetic tree of LoXTH23
2.8 LoXTH23 基因在小鳞茎不同休眠时期和不同组织的表达量
由图11 可知:试验0 d 时,LoXTH23基因在百合小鳞茎中的相对表达量开始升高,并在10 d 时相对表达量达到最高;该基因在根和小鳞茎中的表达量高于其他组织,在茎中的表达量最低。
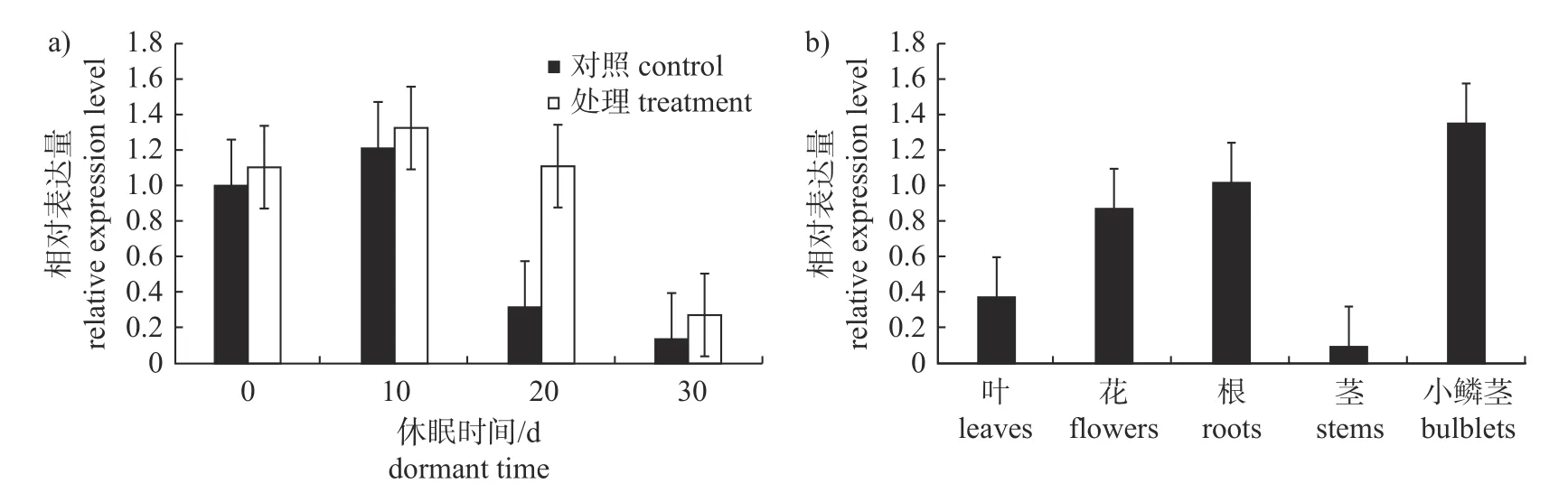
图11 LoXTH23 基因在小鳞茎不同休眠时期(a)和不同组织中(b)的表达量Fig.11 Expression levels of LoXTH23 gene in different dormant periods of small bulbs (a) and different tissues (b)
3 讨论
随着生活水平和质量的提高,人们对观赏植物的需求也在上升。百合作为重要的观赏植物,生产受到其休眠期的影响。XTH基因广泛存在于植物中,通过调节半纤维素的合成影响细胞壁刚性,进而影响细胞行使功能及植物对逆境和生长发育的响应[20-23],是植物形态建成的重要参与者之一。相关研究表明:XTH基因家族也在种子休眠中起到重要作用,如:XTH23基因在龙眼的胚胎早期发育过程中起重要作用[17];天麻的休眠解除与XTHs基因家族密切相关[16]。因此,分析XTH家族相关基因在百合鳞茎休眠中的作用及其作用机理,对深入了解百合鳞茎休眠机制和培育百合新品种具有重要意义。
本研究从百合小鳞茎中克隆得到1 个与休眠解除相关的基因LoXTH23,其开放阅读框全长858 bp,编码285 个氨基酸,含有1 个典型的保守GH16 结构域;LoXTH23 蛋白带负电荷残基数量大于带正电荷残基数量,其亚细胞主要定位于细胞质基质外,是1 个存在信号肽、能引导蛋白质跨膜运输的分泌型蛋白;该蛋白与油棕的同源蛋白聚成一簇,表明这2 个蛋白之间具有较强的亲缘关系。大豆同源基因GmXTH23亚细胞定位在细胞膜上,这可能是不同物种之间的差异所造成的[24];也有研究表明:细胞外基质存在大量信号分子,对细胞的生长发育及增殖具有重要作用[25],推测百合LoXTH23也存在类似功能。该结果为进一步研究LoXTH23基因在百合种球休眠中的功能奠定了基础。
课题组通过前期转录组数据分析百合种球响应外界乙烯信号诱导解除休眠的过程,并发现LoXTH23基因呈差异性表达;本研究进一步发现:经乙烯溶液处理后,LoXTH23基因在鳞茎开始萌发时的表达量显著上调,表明该基因在百合种球打破休眠时起重要作用;第10 天时LoXTH23基因的表达量最高,推测该基因可能是响应乙烯调控,通过促进细胞壁伸长而促进根系生长,从而在小鳞茎萌发前期起作用。İŞKIL 等[26]研究证实:外界胁迫下,拟南芥XTH家族基因,特别是AtXTH23促进了拟南芥根系的生长,这与本研究结果相似,但该基因如何参与调控百合鳞茎细胞壁的生理活动、在休眠信号通路上起到何种作用等具体功能还需进一步研究。
4 结论
LoXTH23基因可能在西伯利亚百合小鳞茎休眠解除调控进程与萌发中起重要作用。

