人工周期冻融胚胎移植患者移植前后雌激素浓度变化及与治疗结局的关系*
樊艳玲 樊月 丰程文 刘宝莲 韩宝生
(1.唐山市妇幼保健院生殖医学中心,河北 唐山 063003;2.华北理工大学,河北 唐山 063210)
在试管婴儿治疗周期中,由于促性腺激素等药物的作用,在一个卵巢刺激周期通常可以获得多个卵子,从而获得多个胚胎,而一次移植不超过2枚胚胎,对多余胚胎进行冷冻;对于取消新鲜周期全胚冷冻者或有剩余胚胎冷冻者,可以在下一次治疗周期移植解冻的胚胎,称为冻融胚胎移植(Frozen embryo transfer,FET)[1-2]。在进行胚胎移植前首先要进行传染病及妇科检查,随后则可进行内膜准备,内膜准备一般分为自然周期和人工周期两种方案。人工周期建立是使用雌激素促使内膜生长,超声持续监测内膜厚度,当内膜厚度达到8 mm以上时,再用黄体酮进行内膜的转化[3]。人工周期FET的妊娠结局受到多种因素的影响,子宫内膜容受性与胚胎植入密切相关,是决定辅助生殖技术成功与否的关键因素之一[4-5]。雌激素有促进子宫内膜表面上皮、腺体、间质、血管呈增殖性变化的作用,是控制性促排卵中重要的监测指标[6-8]。目前关于人工周期FET患者雌激素浓度对妊娠结局的影响多有研究,但对于FET前后不同雌激素浓度变化与妊娠结局的关系尚无明确报道。本研究通过分析人工周期FET患者移植前后雌激素浓度变化及与治疗结局的关系,探讨移植后不同时间点雌二醇(Estradiol,E2)、孕酮(Progesterone,P)浓度对妊娠结局的预测价值,以期为临床进行人工周期FET提供更多决策依据。
1 资料与方法
1.1 一般资料 选取2021年1月—2022年1月在唐山市妇幼保健院接受人工周期FET的患者105例为观察对象,根据治疗后的妊娠结局(妊娠结果判定[9]:胚胎移植后28~30 d经阴道B超检查宫腔内可见孕囊者为临床妊娠)分为妊娠组(47例)和未妊娠组(58例)。本研究符合《赫尔辛基宣言》相关伦理准则。所有患者人工周期FET均由同一组医师完成。 纳入标准:①均接受人工周期FET。②年龄≤40岁。③冻融胚胎均依据胚胎质量评价标准[10]。④临床资料缺失,无法进行研究。排除标准:①存在可能影响雌激素水平的相关疾病。②存在子宫内膜病变、子宫形态异常或生殖器官异常等疾病。③存在其他全身重要器官损伤者。④入组前1个月服用影响雌激素浓度变化的药物。
1.2 人工周期FET方法 ①子宫内膜的准备:检测子宫内膜厚度,若未达到要求则不能进行胚胎移植。②解冻冷冻胚胎:对胚胎进行检测,选择适当数量的合格胚胎进行解冻,准备移植。③移植:解冻后,医师将选定的胚胎移植到患者的子宫内,然后完成移植。④黄体支持:移植后给予黄体酮软胶囊(浙江爱生)0.2 g口服,1次/d,以及黄体酮注射液(浙江仙琚)40 mg肌肉注射,1次/d。黄体支持至移植后14 d,再根据妊娠情况决定是否继续。
1.3 观察指标 比较两组患者年龄、不孕年限等一般资料;比较两组患者FET前和FET后第7天、第14天血清E2和孕酮P浓度;比较两组患者FET后第1天后子宫内膜血流参数;Pearson相关性分析分析雌激素与子宫内膜血流参数的关系;ROC曲线分析雌激素对妊娠结局的预测效能。
1.3.1 血清雌激素浓度检测 于FET前(接受FET当天早晨)和FET后第7天、第14天分别采集患者空腹静脉血5 mL,进行离心沉淀,将分离后的血清放入-70 ℃的冰箱中保存待检测。采用贝克曼库尔特UniCel DxI 800全自动化学发光免疫分析仪及配套试剂检测血清E2和P浓度。
1.3.2 子宫内膜血流参数检测 应用彩色多普勒超声诊断仪于FET后第1天检测所有患者子宫内膜血管指数(Vascularization index,VI)、血流指数(Flow index,FI)及血管血流指数(Vascularization flow index,VFI),每个参数均检测3次,取平均值。

2 结果
2.1 两组患者一般资料比较 两组患者在年龄、不孕年限、子宫内膜厚度、移植胚胎数比较差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较
2.2 两组患者FET前后E2血清浓度变化 两组患者血清E2浓度均随着移植时间的增加而增加,且各时间点妊娠组血清E2浓度显著高于未妊娠组(P<0.05),见表2。

表2 两组患者FET前后血清E2浓度变化
2.3 两组患者FET前后血清P浓度变化 两组患者血清P浓度均随着移植时间的增加而增加,且各时间点妊娠组血清P浓度显著高于未妊娠组(P<0.05),见表3。

表3 两组患者FET前后血清P浓度变化
2.4 两组患者FET后子宫内膜血流参数变化 两组患者胚胎FET后VI差异无统计学意义(P>0.05),妊娠组FI和VFI显著高于未妊娠组(P<0.05),见表4。
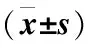
表4 两组患者FET后子宫内膜血流参数变化
2.5 雌激素浓度对妊娠结局的预测效能 FET后第7天的E2浓度预测妊娠结局的AUC为0.929,明显优于FET前(0.860)和FET后第14天(0.839),差异均有统计学意义(Z=2.374、2.288,P=0.018、0.022);其中FET后第7天截断值为265.95 ng/L,敏感度为81.03%,特异度为97.87%。FET后第7天的P水平预测妊娠结局的AUC为0.793,与FET前(0.823)和FET后第14天(0.746),差异均无统计学意义(P>0.05)。见图1、2,表5。

图1 E2浓度预测人工周期FET妊娠结局的ROC曲线

图2 P浓度预测人工周期FET妊娠结局的ROC曲线

表5 雌激素浓度对妊娠结局的预测效能
2.6 FET后第7天雌激素浓度与FET后第1天子宫内膜血流参数的相关 Pearson相关性结果发现,FET后第7天血清E2、P浓度与FET后第1天患者子宫VI水平呈负相关(r=-0.262、-0.220,P=0.007、0.024),与FET后第1天患者子宫FI水平呈正相关(r=0.277、0.238,P=0.004、0.015),与FET后第1天患者子宫VFI水平呈正相关(r=0.846、0.570,P<0.001)。
3 讨论
FET技术是获得胚胎后进行的一种相关辅助生育技术,目前FET的内膜准备方法最常见的就是人工周期和自然周期。但自然周期主要适用于月经周期规律、能正常排卵的患者,多数患者难以满足上述要求,则需进行人工周期方案,通过药物模拟自然受孕状态时的内膜状态及体内雌激素水平,促进子宫内膜发育到一定厚度进行FET[11-12]。既往仅通过子宫内膜厚度及状态分型评估FET周期子宫内膜的受容性,有一定的局限性,仍出现部分患者无法正常妊娠[13]。在分子生物学领域,子宫内膜活检可以相对准确地评价子宫内膜状态[14],但检查结果较滞后,在 FET 周期中的应用受限。研究[15-17]发现,雌激素参与子宫内膜增生、转化、胚胎植入和早期胚胎发育,是妊娠的决定因素。E2是体内主要由卵巢成熟滤泡分泌的一种天然雌激素,血液中E2浓度达到一定的水平才可进行冷冻胚胎移植。相关研究[18]报道,血清E2水平较好的患者行体外受精胚胎移植的临床妊娠结局较好。P是卵巢分泌的具有生物活性的主要孕激素,可以给胎儿的早期生长及发育提供支持和保障。相关研究[19]报道,患者P激素水平过低可能导致不良妊娠结局。由此可见,探究人工周期FET患者移植前后雌激素浓度变化与妊娠结局的关系是非常必要的。
既往研究[20]发现,适宜水平的血清P浓度可改善妊娠结局;另有研究[21]发现,低E2水平与高流产率和低活产率相关,对FET结局有一定的影响。本研究结果显示,两组患者血清E2、P浓度均随着移植时间的增加而增加,且各时间点妊娠组血清E2、P浓度显著高于未妊娠组。提示对于雌激素水平过低的人工周期FET患者,应积极配合药物治疗改善体内激素水平,提高妊娠成功率。
子宫内膜血流信号减弱、缺失或血管分布稀疏是胚胎种植失败的原因之一[21]。已有研究[22]报道,子宫内膜较高的FI、VFI有利于临床妊娠。本研究妊娠组与未妊娠组患者胚胎FET后VI无明显差异,但妊娠组FI和VFI显著高于未妊娠组。本研究Pearson相关性结果发现,FET后血清E2、P浓度与子宫FI、VFI水平呈正相关,提示人工周期FET患者雌激素浓度变化可能与子宫内膜血流参数有关,进而影响子宫内膜转态,导致不同的妊娠结局。
既往研究[23]报道,体外受精胚胎移植周期中E2浓度变化有预测妊娠结局的价值。本研究ROC曲线结果发现,FET后第7天的E2水平预测妊娠结局的AUC为0.929,明显优于FET前(0.860)和FET后第14天(0.839);其中FET后第7天截断值为265.95 ng/L,敏感度为81.03%,特异度为97.87%。FET后第7天的P水平预测妊娠结局的AUC为0.793,与FET前(0.823)和FET后第14天(0.746),各时间点的预测效能无明显差异。提示人工周期FET前后检测雌激素浓度均可预测患者妊娠结局,但FET后第7天的预测效能最好。分析其原因可能是,雌激素水平过高或过低均会影响胚胎的正常着床,而人工周期FET后第7天雌激素水平适中,可能更好地预测妊娠情况[24]。
综上所述,人工周期FET患者FET后雌激素水平明显增加,血清E2、P浓度均对妊娠结局有较好的预测价值。但本研究仍存在部分不足,如样本数量较少、为单中心研究,可能会对数据的准确性存在一定的影响,后期仍需进一步采用动物试验分析不同雌激素水平对人工周期FET治疗结局的影响。
4 结论
人工周期FET患者FET后雌激素水平明显增加,血清E2、P浓度对妊娠结局有较好的预测价值。

