分子吸附再循环系统治疗脓毒症肝衰竭的临床疗效*
王静 辛绍斌 孙强 马旺 王永明 申翔 乔佑杰
(天津市人民医院重症医学科,天津 300121)
脓毒症是重症监护病房患者死亡的最常见原因,全球每年发病率约为1 800万例,死亡率为28%~40%[1]。在所有脓毒症中相关肝损伤发生率为34%~46%,肝功能衰竭的发生率为1.3%~22.0%[2-7]。肝功能衰竭与脓毒症的严重并发症有关。脓毒症合并肝功能障碍的患者往往有更高的死亡率,能达到54%~68%,其明显高于脓毒症并发其他脏器功能障碍的死亡率[3-4,7]。脓毒症肝衰竭是脓毒症死亡的高危因素[8]。目前,对脓毒症肝衰竭尚无特异性治疗手段。分子吸附再循环系统(Molecular adsorbem recirculating system,MARS)是一种杂合的血液净化方式,能清除血液中的多种物质。本研究回顾性分析MARS对脓毒症肝衰竭患者的治疗效果,观察其对血流动力学、肝肾功能、凝血、炎症因子等方面的影响,评价MARS对脓毒症肝衰竭的治疗价值。
1 资料与方法
1.1 一般资料 收集2020年11月—2021年9月天津市人民医院重症医学科收治的15例脓毒症肝衰竭患者。纳入标准:所有入选患者符合Sepsis-3脓毒症诊断标准[9]:①存在感染证据。②序贯性器官功能衰竭评分(Sequential Organ Failure Assessment,SOFA)≥2.0。肝衰竭符合《肝衰竭诊治指南(2018年版)》[10]诊断标准:①极度乏力,并伴有明显厌食、腹胀、恶心、呕吐等严重消化道症状。②短期内黄疸进行性加深,血清总胆红素(TBil)≥10×正常值上限(ULN)或每日上升≥17.1 umo/L。③有出血倾向,凝血酶原活动度(PTA)≤40%,或国际标准化比值(INR)≥1.5,且排除其他原因。④肝脏进行性缩小。排除标准:①既往有慢性肝脏疾病。②中毒或药物性肝损伤。③存在梗阻性黄疸。④肝脏肿瘤或肝脏部分切除术后。⑤严重免疫缺陷。⑥严重循环衰竭,凝血功能障碍无法行血液净化者。本研究已通过天津市人民医院伦理委员会审批。最终纳入患者15例,男性11例,女性4例;平均年龄(63.73±12.67)岁。脓毒症感染情况:重症肺炎6例、急性胆囊炎1例、腹腔感染3例、肠道感染4例、软组织感染1例。其中合并呼吸衰竭有创机械通气12例,循环功能障碍需使用血管活性药物7例,肾功能障碍7例。依据患者血液净化治疗方法分为MARS组及对照组。MARS组9例患者共进行MARS治疗25次,平均每例2.5次(1~9次);对照组6例患者共进行连续静脉-静脉血液透析滤过(Continuous veno-venous hemodiafiltration,CVVHDF)14次,平均每例2.3次(1~4次)。
1.2 治疗方法及分组 所有患者入院后均在重症监护室进行监护治疗,予以常规检查、护理及内科综合治疗,包括针对脓毒症的抗感染治疗,基础疾病和并发症治疗,保肝治疗,调节水电解质紊乱、维持酸碱平衡及内环境稳定治疗,合并呼吸、循环、肾脏功能衰竭的予以相应的脏器功能支持治疗,补充人血白蛋白及新鲜冰冻血浆等对症支持治疗。MARS组在予以内科综合治疗同时加用MARS治疗。MARS治疗使用“金宝”分子吸附循环系统主机MARS Monitor 1TC及“金宝”连续血液净化机,配以“金宝分子吸附再循环套装”。白蛋白透析管路以200 g人血白蛋白及生理盐水预充,透析液使用石家庄四药有限公司生产的血液滤过置换液,血液流速及白蛋白透析液流速均为150~180 mL/min,透析液流速为1~2 L/h;每次治疗时间6~8 h。对照组在予以内科综合治疗同时加用CVVHDF治疗。置换液及透析液均采用石家庄四药有限公司生产的血液滤过置换液,并根据电解质、酸碱平衡情况调整置换液电解质及酸碱配置。血液流速180~200 mL/min;血液滤过置换液前稀释∶后稀释=1∶2,置换液流速为30~40 mL/(kg·h);透析液流速为1~2 L/h;根据患者容量负荷情况调整超滤速度,一般为100~250 mL/h;每次治疗时间为12 h。
1.3 观察指标 患者行MARS/CVVHDF治疗时密切监测呼吸、心率、血压等生命体征,每次MARS/CVVHDF治疗前后分别取血标本,检测血气分析、血常规、降钙素原、凝血指标、肝功能、肾功能、血氨、动脉血乳酸、TNF-α、IL-6、IL-10,观察患者血管活性药物用量等指标。
1.4 治疗效果判断标椎[10]有效:乏力、纳差、腹胀、出血等临床症状明显好转,肝性脑病消失;黄疸、腹水等体征明显好转;肝功能指标明显好转 (TBil下降>40%或者 INR<1.5)。无效:乏力、纳差、腹胀等临床症状体征加重;肝功能指标加重;新发并发症和/或肝外器官功能衰竭,或原有并发症加重。

2 结果
2.1 两组一般资料比较 两组患者年龄、性别、治疗前APACHE Ⅱ评分、SOFA评分及MELD评分比较,差异均无统计学意义(P>0.05),见表1。
2.2 两组治疗前后心率、MAP比较 两组治疗前心率、平均动脉压MAP比较差异无统计学意义(P>0.05);MARS组治疗后心率较前有所降低,MAP较前有所升高,差异具有统计学意义(P<0.05)。对照组治疗后心率、MAP较治疗前无明显变化(P>0.05),MARS组较对照组治疗后心率有所下降,MAP有所上升,差异具有统计学意义(P<0.05),见表2。提示在稳定血流动力学方面MARS治疗明显优于CVVHDF治疗。
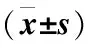
表2 两组治疗前后心率、MAP比较
2.3 两组治疗前后血总胆红素、血氨及乳酸比较 两组治疗前血清总胆红素(TBil)、血氨及血乳酸比较差异无统计学意义(P>0.05);MARS组治疗后血清总胆红素、血氨及血乳酸较前有所降低,差异具有统计学意义(P<0.05);对照组治疗后血氨及血乳酸均较前有所下降,差异具有统计学意义(P<0.05),血清总胆红素较治疗前无明显变化(P>0.05);MARS组治疗后较对照组TBil下降明显,差异具有统计学意义(P<0.05),见表3。这提示,与CVVHDF相比,MARS可以有效清除血清总胆红素,清除血氨、乳酸的能力也不逊于CVVHDF。

表3 两组治疗前后血总胆红素、血氨及乳酸比较
2.4 两组治疗前后血清尿素、肌酐比较 两组治疗前、后血尿素(UREA)、血肌酐(Cr)比较差异无统计学意义(P>0.05);两组治疗后UREA、Cr较治疗前均有所降低,差异具有统计学意义(P<0.05),MARS组在尿素、肌酐等水溶性毒素清除方面效果明显,与对照组比较无明显差异(P>0.05),见表4。

表4 两组治疗前后血清尿素、肌酐比较[M(P25,P75)]
2.5 两组治疗前后血小板、PT-INR比较 两组治疗前、后血小板、PT-INR比较差异无统计学意义(P>0.05),见表5。提示MARS组较对照组治疗后未见明显凝血异常。
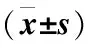
表5 两组治疗前后血小板、PT-INR比较
2.6 两组治疗前后血IL-6、TNF-α及IL-10比较 两组治疗前血清IL-6、TNF-α及IL-10比较差异无统计学意义(P>0.05);两组治疗后血IL-6、TNF-α及IL-10较治疗前均有所降低,差异具有统计学意义(P<0.05);治疗后MARS组较对照组IL-6、TNF-α及IL-10下降更为显著,差异具有统计学意义(P<0.05),见表6。提示在清除炎症因子方面,MARS组优于对照组。

表6 两组治疗前后血IL-6、TNF-α及IL-10的比较
2.7 两种方案治疗效果比较 两组治疗脓毒症肝衰竭,其临床症状均有不同程度的改善。MARS组有效率高于对照组(P<0.05),差异有统计学意义,见表7。

表7 两种方案治疗效果比较[n(×10-2)]
3 讨论
脓毒症是重症医学领域高死亡率的疾病,虽然欧洲危重病学会(ESICM)和美国重症医学会(SCCM)自2002年起发起的拯救脓毒症运动(Suiviving Sepsis Campain,SSC)颁布了多版指南,但目前仍未找到特异性治疗方案。脓毒症是人体对感染反应失调引起的危及生命的器官功能障碍[9],脏器功能障碍是其重要的组成部分。在调节人体免疫系统和代谢方面肝脏承担着重要的作用。脓毒症并发肝功能障碍和肝衰竭可导致脓毒症进行性加重及死亡率显著上升[11-12]。 脓毒症肝衰竭最重要的治疗措施首先是充分治疗脓毒症,快速识别和修复感染病灶,迅速引入有计划的抗感染疗法;同时针对脏器功能予以维持、恢复、替代等治疗,防止多器官衰竭的进一步发展。当肝功能衰竭时传统内科治疗方式的临床效果不是十分理想[13-14]。各种原因引起的肝衰竭前、早、中期均可考虑人工肝治疗;晚期肝衰竭患者虽可进行治疗,但并发症增多,治疗风险大,患者获益可能减少,临床医师应权衡利弊,慎重进行治疗,同时积极寻求肝移植机会,为自发肝再生或进行紧急肝移植争取时间[15]。
MARS是一种杂合人工肝模式,由德国Rostock大学肝脏病研究中心自1993年研制,包含了血液循环、白蛋白循环和透析液循环三个部分,其原理是患者血液通过血液循环,流经主透析器,该透析器的MARSFLUX透析膜选择阈值约为50 kDa,半透膜的另一侧代替普通透析液的是白蛋白透析液。患者血液流经透析膜,其中的蛋白结合毒素和水溶性毒素被转运至白蛋白透析液中,白蛋白与毒素结合后流经低通量透析器、活性炭和阴离子树循环使用[16]。 MARS充分利用了血液透析和血液灌流吸附的技术特点,最大限度地清除脓毒症肝衰竭患者体内不同性质、不同大小的毒素。Lexmond等[17]研究显示,MARS既可有效地清除肝衰竭患者体内蓄积的血氨、尿素、肌酐等水溶性毒素,也可清除与蛋白结合的胆汁酸、胆红素等中、小分子毒素。另外Sponholz等[18]将MARS与单次白蛋白透析作比较,发现MARS对毒素清除明能力显优于单次白蛋白透析。本研究通过对每次血液净化前后相关数据的采集及统计学分析,结果显示,MARS在脓毒症肝衰竭的治疗中清除物质更为全面,替代肝脏的程度更大,对白蛋白结合的大分子毒素,如胆红素清除效果好,明显优于CVVHDF,同时对水溶性物质的清除如乳酸、血氨、UREA、Cr也有良好的清除效果,与CVVHDF无明显差异,能最大限度地减少这些毒素浓度过高造成的肝肾损害。
不稳定的血流动力学在脓毒症、脓毒症休克的治疗、尤其是血液净化治疗时,以及保护和改善脏器功能方面是至关重要的。 之前的研究表明,MARS疗法倾向于恢复低全身血管阻力(SVR)、动脉低血压,并减少肝衰竭患者对血管升压药支持的需求,其原因不是降温效应,而是内源性血管舒张物质(如一氧化氮)水平的降低[19-21]。本研究通过监测患者的心率、血压结果显示,MARS较CVVHDF在稳定血流动力学方面更有优势。
机体失控性炎症反应学说被认为脓毒症发病机制的重要基础,脓毒症时炎性细胞过度激活,肝脏是释放炎症介质、启动炎症反应、清除细菌内毒素的主要场所。脓毒症并发肝脏功能障碍后,会影响其他脏器的炎症反应,从而使脏器功能损伤进一步加重[22]。MARS对于脓毒症肝衰竭来说,不仅仅是肝脏替代治疗,其对脓毒症的也具有积极的治疗作用。本研究结果显示,MARS治疗后,IL-6、IL-10、TNF-α的水平都有明显下降。提示MARS可以有效地清除炎症因子,这一作用可以减少“炎症风暴”对脏器的进一步影响。为脓毒症的进一步治疗,肝脏的恢复打下良好的基础。
MARS的安全性研究已经确定血小板计数的轻微下降是最显著的副作用[19,23-24]。脓毒症肝衰竭时可出现广泛的凝血紊乱,从实验室结果的轻微偏差(凝血时间延长、血小板减少等)直至严重凝血病和(或)弥散性血管内凝血(DIC)发生。有研究显示,造成这个结果的主要原因是微血管内皮受损,进一步影响纤溶和凝血系统间的平衡,以及多种凝血因子的合成能力下降[25]。本研究结果显示,MARS治疗后血小板有轻度下降,但INR未见明显延长,且与CVVHDF治疗无显著差异,具有良好的安全性。这可能是因为MARS过程中人体血液仅在血液循环的回路中通过MARSFLUX透析膜与白蛋白透析液有选择性进行毒素的清除, 而不是将人体血液或血浆做非选择性地置换或吸附,从而最大程度地保存了原有的凝血因子等有益物质。本研究为回顾性研究,纳入样本数量有限,今后在临床工作中将继续总结,扩大样本量,更好地评估疗效。
4 结论
MARS在脓毒症肝衰竭的治疗中较CVVHDF更为全面,既能清除炎症因子、与白蛋白结合的毒素、又能清除水溶性中小分子物质, 而且在血流动力学及凝血功能方面具有良好的安全性,为脓毒症肝衰竭的治疗提供了新思路、新手段。

