Circ_DOCK1调节miR-122-5p/PPIB轴对结直肠癌细胞增殖、迁移和侵袭的影响*
金美 巴桑 次仁
(日喀则市人民医院,西藏 日喀则 857000)
结直肠癌是全球第三大常见恶性肿瘤,是导致癌因性死亡的第二大原因[1],对人类健康造成了极大的影响,我国近年来的结直肠癌发病率和死亡率均持续升高,造成了严重的癌症负担[2-3]。因恶性肿瘤发生早期无特异性的症状,且受健康检查意识薄弱、漏诊及结肠镜检查覆盖不全等综合因素影响,多数结直肠癌患者就诊时已失去最佳手术时机,预后不佳。因此探索结直肠癌的发病机制,寻找新的治疗靶点对于结直肠癌的防治有重要意义。多项研究证实,非编码RNA参与癌症表型,关于非编码RNA的干预研究为结直肠癌的治疗提供了新的前景[4-6]。环状核糖核苷酸(circRNA)作为非编码RNA,能够调节微小RNA(miRNA)和信使RNA(mRNA),并充当miRNAs的分子海绵和转录调节因子,与RNA结合蛋白质结合翻译蛋白,影响细胞的生命活动[7]。研究发现circ_胞质分裂作用因子1(Dedicator of cytokinesis 1,circ_DOCK1)在结直肠癌中表达异常,且能影响人脑血管平滑肌细胞的增殖和凋亡[8-9]。miR-122-5p作为小型非编码RNA已经被证实参与多种癌症的发生发展[10-11]。肽酰脯氨基顺反异构酶B(Peptidyl-prolyl cis-trans isomerase,PPIB)有肽酰脯氨基顺反异构催化活性,在miRNA调控下能发挥转录因子的作用,促进细胞的生长和增殖[12]。故本研究探讨circ_DOCK1通过调节miR-122-5p/PPIB轴对结直肠癌细胞增殖、迁移和侵袭的影响,以期为结直肠癌的靶向治疗提供新的研究方向。
1 材料与方法
1.1 临床样本 选取2020年5月—2021年5月收治的经病理诊断证实且术前未接受化疗的30例结直肠癌患者癌组织与癌旁组织标本(距离癌组织5 cm),患者年龄36~80岁,男性18例,女性12例,平均(64.69±10.58)岁;分化程度:高分化4例,中分化15例,低分化11例;TNM分期:I/II期12例,III/IV期18例。研究项目经医院伦理委员会批准,且患者均签署知情同意书。
1.2 实验材料 人结直肠癌细胞SW480株(中国科学院上海细胞库),10%胎牛血清、1%双抗(链霉素+青霉素)(南京科佰生物科技有限公司)DMEM培养基,于37 ℃、5% CO2密闭式孵箱内培养。Trizol RNA抽提试剂、荧光素酶检测试剂盒、LipofectamineTM3000阳离子脂质体(美国Invitrogen公司),circ_DOCK1干扰质粒(sh-circ_DOCK1),miR-17-5p反义寡核苷酸重组质粒(anti-miR-17-5p)和miR-17-5p模拟物(miR-17-5p mimics)(苏州吉玛基因股份有限公司);3550UV酶标仪、7500实时荧光定量PCR仪、电泳仪、CheniDoc XRS化学发光成像分析系统(Bio-rad公司),徕卡生物倒置显微镜(德国Leica公司)。
1.3 实时荧光定量PCR检测circ_DOCK1、miR-122-5p、PPIB表达水平 结肠癌组织和癌旁组织加入液氮中研磨,以Trizol试剂盒提取总RNA,逆转录试剂盒将RNA逆转为cDNA,分别扩增circ_DOCK1、miR-122-5p、PPIB和内参U6及β-actin基因,引物序列设计由上海生工生物工程有限公司合成,制备PCR反应体系,2×Sybgreen预混合物10 μL,cDNA模板8.8 μL,上下游引物各0.6 μL,总体积20 μL,严格按照试剂盒说明书操作,在PCR结束后直接获取目的基因相对表达水平(本研究细胞实验均重复3次)。
1.4 人结直肠癌细胞SW480的培养与转染 取对数生长期人结直肠癌细胞SW480,1×104/孔密度接种于96孔板中,至细胞融合率达到70%,按照LipofectamineTM3000脂质体转染试剂盒说明书操作,分别转染sh-circ_DOCK1(sh-circ_DOCK1组)、干扰对照载体(NC-circ_DOCK1组)和sh-circ_DOCK1+anti-miR-17-5p(挽救组)。
1.5 CCK-8检测细胞增殖能力 转染后培养0 h、24 h、48 h和72 h时分别在培养孔中加入10 μL的CCK-8工作液,37 ℃孵育2 h,酶标仪检450 nm处的吸光度(A)值,绘制生长曲线。
1.6 划痕实验检测细胞迁移能力 转染后的细胞以1×104/孔密度接种于6孔板中,24 h待细胞贴壁生长后以10 μL移液枪头在培养板中划直线,更换为含10%血清的新鲜培养液,37 ℃、5%CO2环境中继续培养,48 h后倒置显微镜下观察细胞迁移情况。
1.7 Transwell实验检测细胞侵袭能力 转染后的细胞1×105个接种于Transwell小室上室,加入200 μL无血清培养液,下室加入500 μL的DMEM培养基,孵育箱培养48 h,去除上室细胞,4%多聚甲醛固定,0.1%结晶紫染色15 min,晾干后拍照计算穿模细胞数。
1.8 双荧光素酶报告基因实验 细胞接种于24孔板,贴壁后待转染,将含有miR-122-5p潜在结合位点的circ_DOCK13′非翻译区(3′-untranslated region,3′UTR)和UPF1 3′-UTR荧光素酶报告质粒(PmirGLO)和结合位点突变的荧光素酶质粒与anti-miR-17-5p、miR-17-5p mimics共转染至人结直肠癌细胞SW480,孵育48 h,按照荧光素酶报告系统检测荧光素酶活性。

2 结果
2.1 临床标本circ_DOCK1、miR-122-5p、PPIB表达水平比较 与癌旁组织比较,癌组织的circ_DOCK1、PPIB mRNA表达量升高,miR-122-5P表达量下降,差异有统计学意义(P<0.05),见图1、2。

图1 癌组织与癌旁组织circ_DOCK1、PPIB mRNA表达量比较

图2 癌组织与癌旁组织circ_DOCK1、miR-122-5p、PPIB mRNA表达电泳图
2.2 人结直肠癌细胞SW480 circ_DOCK1、miR-122-5p、PPIB表达水平比较 与挽救组和NC-circ_DOCK1组比较,sh-circ_DOCK1组的circ_DOCK1和PPIB mRNA表达量下降,miR-122-5p表达量升高,差异有统计学意义(P<0.05);挽救组和NC-circ_DOCK1组的circ_DOCK1、miR-122-5p及PPIB mRNA表达量比较,差异无统计学意义(P>0.05),见图3、4。

图3 Circ_DOCK1、miR-122-5p、PPIB表达水平比较
2.3 人结直肠癌细胞SW480增殖情况比较 3组转染后0 h、24 h的A值比较,差异无统计学意义(P>0.05),sh-circ_DOCK1组的48 h和72 h的A值低于挽救组和NC-circ_DOCK1组(P<0.05),挽救组和NC-circ_DOCK1的A值比较,差异无统计学意义(P>0.05)。见图5。

图4 人结直肠癌细胞circ_DOCK1、miR-122-5p、PPIB mRNA表达电泳图

图5 人结直肠癌细胞SW480增殖情况比较
2.4 人结直肠癌细胞SW480迁移和侵袭情况比较sh-circ_DOCK1组的细胞迁移率和穿膜细胞数均低于挽救组和NC-circ_DOCK1组(P<0.05),挽救组和NC-circ_DOCK1的细胞迁移率和穿膜细胞数比较,差异无统计学意义(P>0.05),见表1、图6、7。
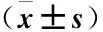
表1 人结直肠癌细胞SW480迁移和侵袭情况比较

图6 细胞迁移情况

图7 细胞侵袭情况
2.5 circ_DOCK1与miR-122-5p的靶向关系验证 利用生物信息学软件TargetScan、miRwalk初步预测circ_DOCK1与miR-122-5p 3′UTR的结合位点,显示circ_DOCK1序列中含有与miR-122-5p互补的核苷酸序列,见图8。双荧光素酶报告基因实验显示,转染miR-122-5p mimics后,circ_DOCK1的野生型荧光素酶报告质粒相对活性降低,转染anti-miR-122-5p后,circ_DOCK1的野生型荧光素酶报告质粒相对转录活性增加,差异有统计学意义(P<0.05),转染miR-122-5p mimics、anti-miR-122-5p的circ_DOCK1突变型荧光素酶报告质粒相对活性值无明显变化(P>0.05)。见表2。

图8 circ_DOCK1与miR-122-5p的结合位点
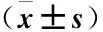
表2 circ_DOCK1荧光素酶活性
3 讨论
随着基因检测、筛查等技术的进步,寻找恶性肿瘤的基因治疗靶点成为研究热点。circRNA作为新型的内源性非编码RNA,是由前mRNA和非编码RNA的非规范反向剪接产生的单链RNA的共价环,较线性的RNA更为稳定,在真核细胞中广泛存在,参与控制细胞周期、肿瘤发生和化学抗性[13-14]。有研究证实,circRNA调节的主要机制之一是作为竞争性内源性RNA或RBP分子海绵调控靶基因的表达,影响恶性肿瘤的进展[15]。
DOCK1属于胞质分裂贡献因子家族成员,具有鸟嘌呤核苷酸交换因子活性,而DOCK1异常是多种免疫缺陷疾病的重要原因。DOCK1在甲状腺癌、肝癌、骨肉瘤等多种恶性肿瘤中具有促癌基因属性,参与肿瘤的生长、侵袭、转移等生物学过程。研究发现来自circRNA的DOCK1能过抑制甲状腺细胞中的miR-124的表达,阻断anus激酶/信号转导及转录激活因子/腺苷5′-单磷酸活化蛋白激酶信号通路的信号转导,并参与通过下调miR-124导致甲状腺癌的发生;还可通过miR-654-5p/SMAD同源物2轴抑制肝癌的进展,并能调节miR-339-3p/胰岛素样生长因子1受体轴促进成骨肉瘤的肿瘤发生和顺铂耐药[16-18]。一项动物实验发现,miR-122-5p能通过细胞分裂周期和细胞凋亡调控因子1增强肠上皮细胞放射敏感性,加重小鼠放射性直肠损伤[19]。Yin等[20]一项细胞实验中,miR-122-5p亦能受circ_0007142的调节,启动下游CDC25A促进结直肠癌的进展。以上研究说明一种circRNA可调控多种靶基因,而一个靶基因受多种circRNA的调控。PPIB具有肽酰脯氨基顺反异构催化活性,当其顺反异构的催化活性被阻断,则作为细胞外基质主要成分的胶原蛋白成熟被延迟,而细胞外基质是癌细胞发生转移需要突破的第一道屏障[21]。在本研究中发现circ_DOCK1、PPIB mRNA在结直肠癌组织中高表达,miR-122-5p低表达;在SW480细胞中抑制circ_DOCK1的表达,而miR-122-5p表达升高,PPIB mRNA表达下降,且SW480细胞的增殖、转移和侵袭能力下降,说明circ_DOCK1和PPIB在结直肠癌中高表达,而miR-122-5p低表达,敲低circ_DOCK1能影响miR-122-5p和PPIB表达,并抑制结直肠癌的增殖、侵袭和转移。
本研究为了评估circ_DOCK1在SW480细胞能够由miR-122-5p介导,将敲低circ_DOCK1的细胞共转染anti-miR-17-5p,结果逆转了敲低circ_DOCK1的作用效应。此外通过双荧光素酶报告基因结果显示,转染miR-122-5p mimics后,circ_DOCK1的野生型荧光素酶报告质粒相对活性降低,转染anti-miR-122-5p后circ_DOCK1的野生型荧光素酶报告质粒相对转录活性增加,说明过表达miR-122-5p能结合circ_DOCK1抑制报告基因荧光素酶活性,证明了两者的靶向关系,即circ_DOCK1在结直肠癌中充当miR-122-5p的分子海绵,竞争性结合miR-122-5p,调节PPIB,影响结直肠癌的进展。
4 结论
综上所述,circ_DOCK1在结直肠癌组织中的表达异常升高,并可通过调节miR-122-5p/PPIB轴影响结直肠癌细胞增殖、迁移和侵袭。

