不同种植年限羊肚菌根际土壤真菌多样性及代谢通路
韩雨潼,岳增良,张国印,郜 静,李 玭,王立安,李守勉,赵振重,刘晓薇,王 凌
(1.河北省农林科学院农业资源环境研究所,河北石家庄 050051;2.河北省羊肚菌产业技术研究院,河北邢台 055450;3.河北省肥料技术创新中心,河北石家庄 050051;4.河北师范大学生命科学学院,河北石家庄 050024;5.河北农业大学园艺学院,河北保定 071001;6.河北省柏乡县自然资源和规划局,河北邢台 055450)
羊肚菌属子囊菌门(Ascomycota)盘菌纲(Pezizomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)羊肚菌属(Morchella),是土生类真菌,俗名羊肚菜,有“菌王之王”的美誉[1]。它富含多糖、矿物质、蛋白质、微量元素(硒、有机锗)、氨基酸等[2],具备极高的药用价值和经济价值。基于生物学特性研究,羊肚菌具有康体抗癌、促进机体免疫活性等多种作用[3-6],由于野生羊肚菌稀缺导致羊肚菌市场供不应求、有价无市,故近年来人工栽培羊肚菌发展势头迅猛[7-8]。我国现有30个种类的羊肚菌,占全球总类的一半(30/61),基于系统发育学分类:羊肚菌黑色类群13个,黄色类群17个[9-10]。目前,我国人工栽培羊肚菌成功驯化的品种主要集中在黑色类群中的六妹羊肚菌(Morchellasextelata,编号:Mel-6)、七妹羊肚菌(Morchellaseptimelata,编号:Mel-7)、梯棱羊肚菌(Morchellaimportuna,编号:Mel-10)[11]。
研究表明,羊肚菌生长与土壤环境密切相关[12],然而目前针对羊肚菌根际土壤的相关研究甚少。国外羊肚菌相关研究现状趋于在分子生物学水平上利用其生物学特性来研究羊肚菌的药用价值[13-14]和基于系统发育学鉴定新的羊肚菌物种[15];国内羊肚菌产业研究在野生羊肚菌及其生长土壤生境相关方面取得一些进展,最新研究进展表明,新疆昭苏县黑色腐质土上层(0~20 cm)羊肚菌根际微生物多样性最丰富,且土样中富含多种固氮菌[16]。甘肃省野生羊肚菌所处生境中,土壤含水量、养分对其根际土壤细菌优势菌群影响程度较大[17],速效钾、谷氨酰胺酶与真菌优势菌门(子囊菌门)呈显著正相关关系[18]。
前人研究中缺乏人工栽培羊肚菌根际土壤微生物优势菌群与环境因子的关联性以及群落功能代谢途径的研究。根据河北省羊肚菌产业现状[19],土壤生境与设施环境调控是影响羊肚菌产量的两大因素,本研究通过对根际土壤微生物群落进行高通量测序,分析不同种植年限的土壤生境中种植羊肚菌后的微生物群落多样性、群落组成、菌群同土壤环境因子的互作关系,以及真菌群落主要代谢途径,为探究羊肚菌根际微环境,制定适宜河北省人工栽培羊肚菌生长的土壤生境标准提供科学的理论依据。
1 材料与方法
1.1 供试材料基本信息
供试材料采样时间为2021年8月,试验田位于河北省邢台市柏乡县(114°70′E,37°48′N)。采样点种植品种为六妹羊肚菌,试验分设3组采样:未种植羊肚菌的对照样本(编号:CK)、种植1年羊肚菌的样本(编号:OYC)、种植4年羊肚菌的样本(编号:FYC),上述土壤质地分类参照《中国土壤》[20]。分别进行根际土壤取样[21],每组样品3次重复,共9个样本,用干冰低温保存带回实验室后放入-80 ℃冷冻柜储存备用。样本理化性质及酶活性详见表1。
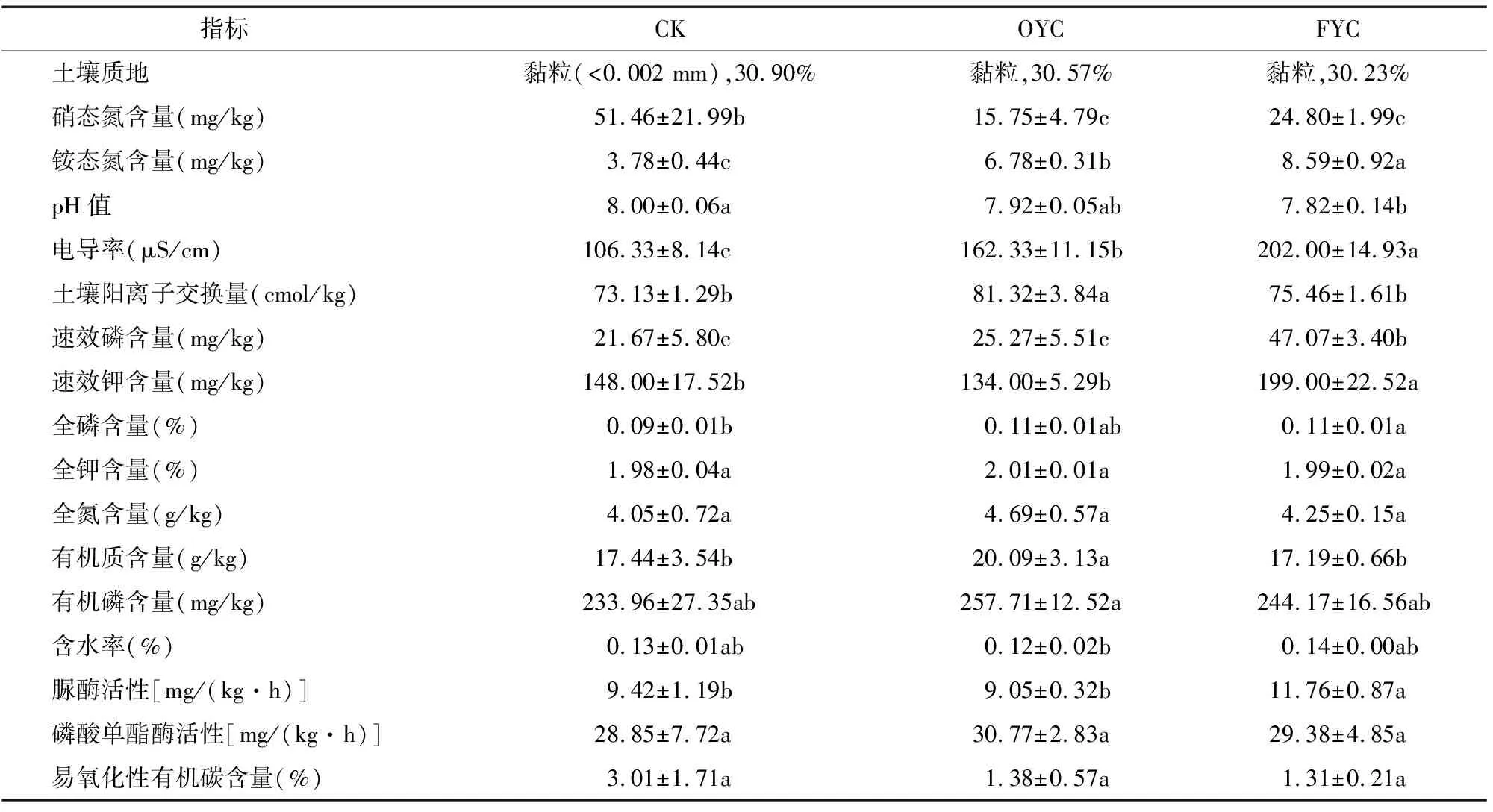
表1 样本根际土壤理化性质及酶活性
1.2 土壤理化性质与酶活性测定方法
采用光度法测定铵态氮含量;紫外分光光度计法测定硝态氮含量;凯式定氮法测定土壤含氮量;电位法测定土壤pH值;利用电导法测定电导率;利用乙酸铵法测定土壤阳离子交换量;使用火焰原子吸收仪测定速效钾含量;碳酸氢钠浸提法测定速效磷含量;全磷、全钾的含量均使用火焰光度计基于氢氧化钠熔融法测定;有机质含量由重铬酸钾容量法测定;灼烧法测定有机磷含量;尿素残留量法测定土壤脲酶活性;磷酸单酯酶活性的测定采用对硝基苯磷酸盐法;易氧化性有机碳含量的测定基于高锰酸钾氧化法[22-23]。
1.3 样本DNA抽取、PCR扩增及高通量测序
使用试剂盒MP-soil抽提样本土壤微生物群落全部DNA后,将利用1%琼脂糖凝胶电泳提取的基因组DNA通过使用NanoDrop 2000超微量分光光度计(编号:ND-2000)对其浓度进行测定;使用MiSeqPE30平台,对真菌ITS1F_ITS2R区域利用PCR扩增引物:ITS1F(5′-C T T G G T C A T T T A G A G G A A G T A A-3′)和ITS2R(5′-G C T G C G T T C T T C A T C G A T G C-3′)[24]。PCR扩增设计:95 ℃ 3 min;95 ℃ 30 s,退火温度30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min,停止于10 ℃。将各样本重复3次后,利用2%琼脂糖凝胶电泳检测其混合后的PCR产物,后采用AxyPrepDNA凝胶回收试剂盒高效回收。
1.4 数据分析
基于统计学使用贝叶斯算法对OTU代表序列(相似水平97%)进行分类运算以获得每个OTU对应的物种分类信息;使用Unite数据库[25],对微生物群落进行了α多样性分析;利用R语言工具,分析微生物群落结构组成、属水平物种丰度聚类分析;通过VIF方差膨胀因子分析和RDA分析,反映样本的真菌优势菌群与土壤环境因子之间的相关关系[26]。
2 结果与分析
2.1 羊肚菌根际土壤真菌群落多样性及组成分析
2.1.1 羊肚菌根际土壤真菌多样性分析 由表2可知,3组样本的真菌群落覆盖率都达到99.9%,极大地保证了本次数据分析结果的有效性和准确性。与未种植羊肚菌的对照样本CK相比,种植1年的OYC和种植4年的FYC这2组样本中真菌Ace指数、Chao1指数、Shannon指数显著降低(P<0.05),Simpson指数相对较高,说明种植羊肚菌后的土壤生境中真菌群落丰度、多样性均有一定程度的降低。
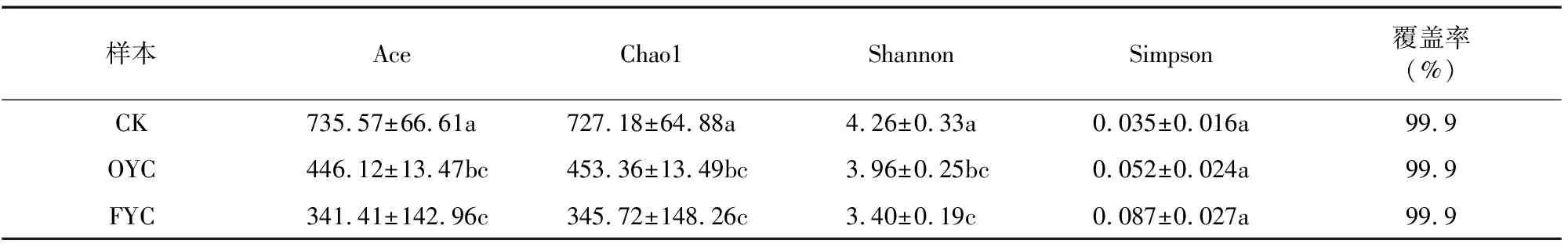
表2 羊肚菌根际土壤真菌α多样性分析
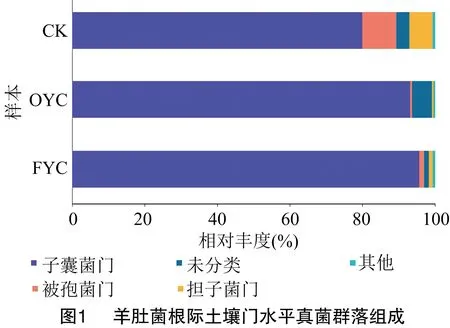
2.1.2 羊肚菌根际土壤真菌群落组成分析 门水平上,共检测到13个真菌群落。由图1可知,CK的优势菌门包括子囊菌门(Ascomycota)(79.89%)、被孢霉门(Mortierellomycota)(9.38%)和担子菌门(Basidiomycota)(6.40%);样本OYC的优势菌门为子囊菌门(93.12%)、unclassified_k_Fungi(5.45%);样本FYC的优势菌门仅有子囊菌门(95.60%)。各类样本中排名第1位的优势菌门都是子囊菌门,也是羊肚菌本身所属的菌门,在OYC和FYC样本中,子囊菌门的相对丰度与CK相比,分别增加了13.23百分点和15.71百分点。说明随着种植年限增加,子囊菌门的菌群丰度逐年提升。
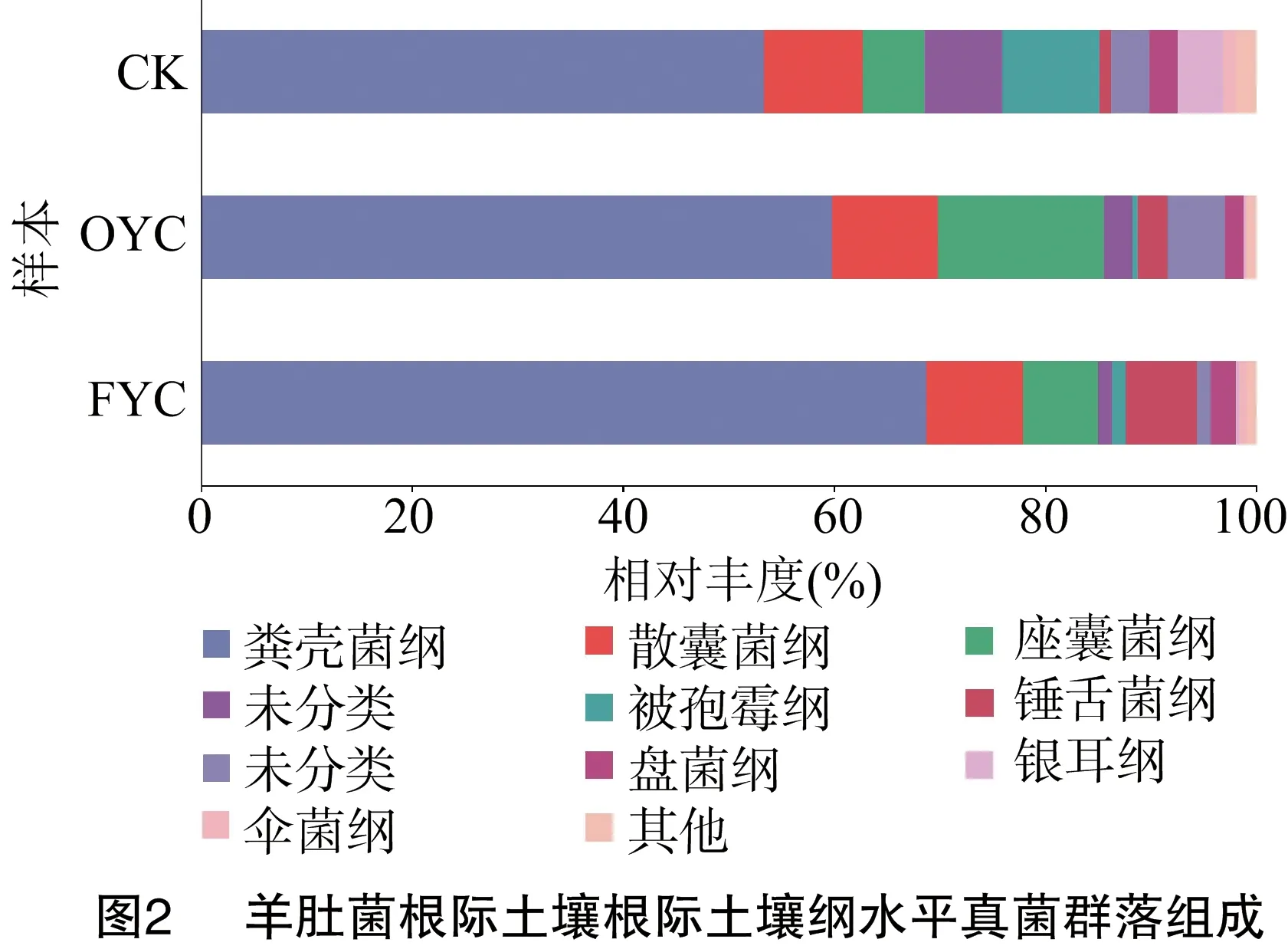
由图2可知,纲水平上,共检测到42个真菌群落。粪壳菌纲(Sordariomycetes)(53.35%)、散囊菌纲(Eurotiomycetes)(9.38%)、被孢霉纲(Mortierellomycetes)(9.15%)是CK的优势菌纲,样本OYC的优势菌纲包括粪壳菌纲(59.85%)、座囊菌纲(Dothideomycetes)(15.71%)和散囊菌纲(10.00%),样本FYC的优势菌纲为粪壳菌纲(68.75%)、散囊菌纲(9.17%)。各类样本中排名第1位的优势菌纲均为粪壳菌纲,其相对丰度在OYC和FYC样本中较CK,分别提升了6.50百分点和15.40百分点。说明随种植年限增加,粪壳菌纲的菌群丰度逐年提升。
2.2 羊肚菌根际土壤真菌群落聚类分析
对3组样本基于属水平进行物种分类,选择总丰度前20的物种,依据相对丰度将其分块聚集,并结合物种所属的纲水平更为明晰地展现优势菌群。被孢霉属(Mortierella)作为CK的优势菌属,它隶属于被孢霉纲,且相对丰度为9.15%。样本OYC的优势菌属为拟棘壳孢属(Pyrenochaetopsis),隶属于座囊菌纲,相对丰度为12.05%。样本FYC中的优势菌属新赤壳属(Neocosmospora)、毛壳菌属(Chaetomium),同属于粪壳菌纲(Sordariomycetes),相对丰度分别为16.43%、13.46%。说明3组样本的优势菌属具有很大差异性,且各组样本优势菌属的相对丰度都高于其他2组该菌属的相对丰度(图3)。
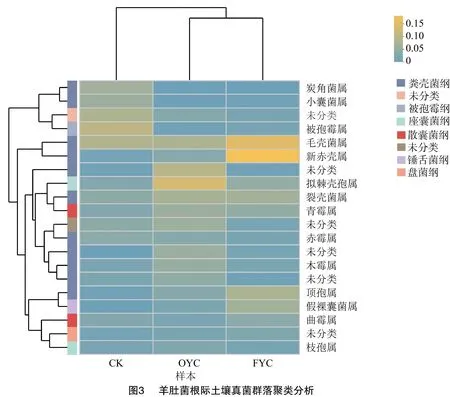
2.3 羊肚菌根际土壤真菌优势菌群与土壤环境因子相关性分析
2.3.1 VIF方差膨胀因子分析 在RDA分析之前,首先将土壤环境因子进行VIF方差膨胀因子分析,筛选后保留多重共线性较小的土壤环境因子(VIF<5)为速效钾含量、磷酸单酯酶活性、有机质含量、含水率、铵态氮含量和速效磷含量(表3)。
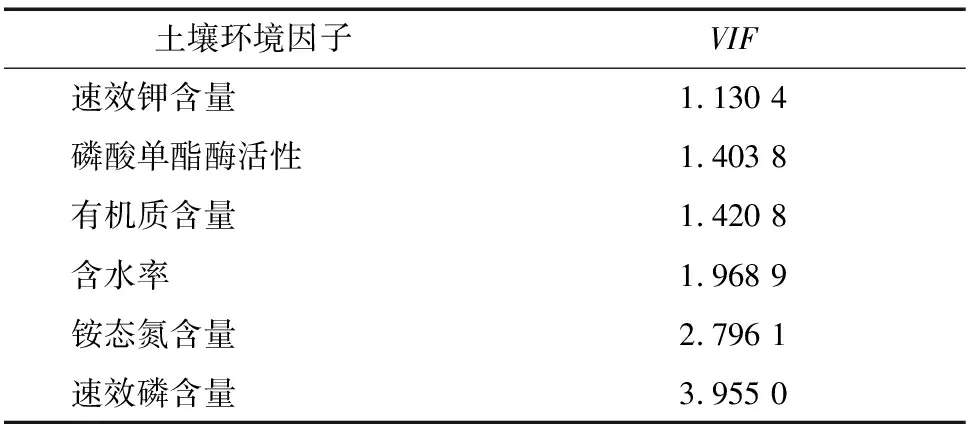
表3 VIF方差膨胀因子分析筛选后的VIF
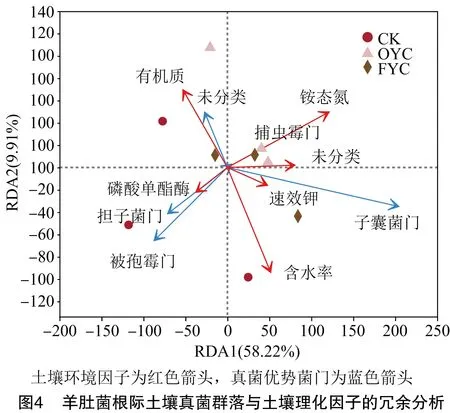
2.3.2 真菌与土壤环境因子的冗余分析 选取相对丰度前5的真菌优势菌门,且土壤环境因子对其影响程度表现为含水率>铵态氮含量>有机质含量>速效磷含量>速效钾含量>磷酸单酯酶活性。优势菌门排名第1位的子囊菌门与速效钾含量、速效磷含量、铵态氮含量、含水率呈正相关关系,且与速效磷、速效钾含量显著正相关,而与磷酸单酯酶活性、有机质含量呈显著负相关关系;分别排在第2、3位的被孢霉门和担子菌门均与含水率、磷酸单酯酶活性呈正相关关系,与铵态氮含量等其他4个环境因子呈负相关关系,捕虫霉门(Zoopagomycota)与铵态氮含量、速效磷含量、速效钾含量呈正相关关系,而与含水率、有机质含量、磷酸单酯酶活性呈负相关关系(图4)。
2.4 羊肚菌根际土壤真菌群落代谢通路分析
通过FUNGuild对真菌进行功能分类,主要功能是腐生真菌代谢,说明腐生营养型真菌大量存在,其主要作用是加速土壤腐殖质的形成和分解,促进碳、氮循环。各样本功能预测中排名第1的均是未定义的腐生真菌(Undefined Saprotroph),其相对丰度在CK、OYC、FYC样本中分别是23.57%、29.77%、38.77%,OYC、FYC样本与CK相比,其相对丰度分别增加了6.20百分点、15.20百分点,说明种植羊肚菌更能促进腐生真菌代谢效率(图5)。

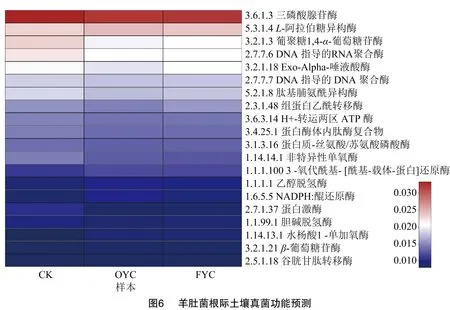
通过PICRUSt2对ITS测序数据进行功能预测和丰度统计,由图6可知,各样本中相对丰度最高的是EC编号为3.6.1.3的酶,基于brenda酶数据库(BRENDA Enzyme Database,https://www.brenda-enzymes.info)进行查询统计,三磷酸腺苷酶(酶编号:EC3.6.1.3,简称ATPase),属于水解酶,作用于酸酐,在含磷酸酐中,催化水解三磷酸腺苷(ATP),产物为二磷酸腺苷(ADP)和无机磷酸,即为羊肚菌提供土壤生长环境中可吸收的无机磷。
3 讨论与结论
早期研究表明,植物根际是一个动态环境,植物种类和土壤类型两大主要因素决定作物根系附近微生物群落结构,且根际微生物群落组成与植物互相影响[27-29]。羊肚菌作为草腐菌,不同于木腐菌生长与林木具有菌根关系[30],而人工栽培羊肚菌,缺乏森林、草木等多元环境,必然更多受到土壤理化性质、微生物优势菌群等多种自然因素及人为施用农田投入品因素的影响。本次研究结果表明,在北方pH值呈碱性土壤中种植羊肚菌不同年限后,其根际土壤真菌菌群组成发生变化,物种多样性大幅降低,相较于陈诚等在四川酸性土壤中得出的羊肚菌栽培后真菌多样性降低的结论[31],说明种植羊肚菌后真菌多样性降低这一结果可能与土壤pH值没有直接关联。未种植羊肚菌时,优势真菌门包括子囊菌门、被孢霉门及担子菌门,而种植羊肚菌后,随着年限增长,子囊菌门趋向于最优势菌群。通过对比赵玉卉等在甘肃野生羊肚菌根际土壤样本中得出的优势菌群为子囊菌门和担子菌门[18]这一结论,表明在野生羊肚菌与人工栽培羊肚菌这2种不同生境中,羊肚菌所在的子囊菌门始终占优势,且其下的粪壳菌纲随种植年限增长,其优势型亦更为明显,表明土壤中的真菌多样性随种植年限的增加而逐渐趋于单一化。
已有研究表明,羊肚菌子实体生长需要大量养分摄入,保持土壤中氮、磷等元素的平衡可促使羊肚菌出菇[32-33]。本次研究结果表明,含水率、铵态氮含量、有机质含量、速效磷含量、速效钾含量、磷酸单酯酶活性这些土壤环境因子对羊肚菌生长确实具有显著影响,且速效磷、速效钾含量与羊肚菌所在的子囊菌门呈显著正相关关系,而磷酸单酯酶活性、有机质含量与其呈显著负相关关系。目前,报道的研究成果中,阎威文等研究发现,影响吉林辽源地区羊肚菌根际真菌优势菌群的最重要的土壤环境因子是全氮、有机碳[34]。全氮是土壤当中全部的氮养分,而铵态氮是土壤中无机氮里最易被作物直接吸收的活性氮,故本研究结果有更进一步的细化,同时也作为甘肃野生羊肚菌根际土壤中子囊菌门与速效钾含量、谷氨酰胺酶活性、脲酶活性等呈正相关关系这一结论的差异对比及内容补充[18]。
在同一地块连续多年种植羊肚菌后,腐生真菌随着年限增长,土壤中腐生营养型真菌相对丰度增长了6.20百分点(样本OYC)、15.20百分点(样本FYC),腐生真菌易携带病原体,说明土壤病虫害隐患增加,故在田间管理中需注意土传病害感染的预防,应选择适宜的土壤调理剂品类,在今后的研究中将作进一步探究。且真菌功能作用的主要代谢途径为三磷酸腺苷酶(ATPase)通过催化水解释放能量的过程,即转化营养物质供羊肚菌吸收。ATP酶配体相互作用,土壤中有机物对酶活性产生抑制或活化作用,基于功能预测结果中腐生真菌的大量衍生,可以猜测腐生真菌对ATP酶具有活化作用。
综上,本研究作为人工栽培羊肚菌根际土壤相关研究的重要发现,探讨了土壤环境与种植年限导致羊肚菌根际土壤真菌群落多样性与群落组成变化,发现了人工栽培过程中对真菌优势菌群最具影响的土壤环境因子,明确了真菌优势菌群主要功能及酶代谢途径,对今后河北省羊肚菌人工栽培管理措施的标准化制定具有重要意义。

