肝硬化腹水患者血清与腹水中LDH、GLU、SAAG水平与肝功能分级及预后关系*
张欢 刘华柱 黄小梅 张丽丽 马欢
(电子科技大学医学院附属绵阳医院·绵阳市中心医院消化内科,四川 绵阳 621000)
腹水属于肝硬化患者常见并发症,多由门静脉压力增高、低蛋白血症、血管活性增强或肝内淋巴回流受阻等引起,是肝硬化病情进展严重的重要标志,出现腹水症状的患者一年病死率约15%[1]。肝脏是维持机体体液内正常葡萄糖(GLU)水平的重要脏器组织,肝硬化患者多因肝功能衰竭而出现糖代谢异常[2]。乳酸脱氢酶(Lactate dehydrogenase,LDH)是机体内参与糖分酵解的重要过氧化氢酶,当肝脏受损时,细胞组织及血清中的LDH易渗入到患者的腹水中,造成腹水LDH指标出现异常。血清腹水白蛋白梯度(Serum ascites albumin gradient,SAAG)是反映门静脉高压的关键性指标,通过监测SAAG水平变化可帮助临床对腹水的发生及严重程度进行诊断鉴别[3]。由于肝硬化腹水的诊治一直是临床工作的难点及研究的热点[4],因此,本研究探讨肝硬化腹水患者血清与腹水中LDH、GLU、SAAG水平对肝功能分级及预后的评估价值,以期为肝硬化患者的诊治提供参考依据。
1 对象与方法
1.1 研究对象 回顾性分析我院2017年4月~2020年4月收治的90例肝硬化腹水患者的病例资料。入选患者中男57例,女33例;年龄23~75岁,平均(45.87±10.59)岁;肝炎后肝硬化47例,酒精性肝硬化23例,自身免疫性肝硬化11例,其他不明原因9例;合并糖尿病者19例,合并高血压者15例;肝功能Child-Pugh分级标准[5]下肝功能A级(A组)者21例,B级(B组)者43例,C级(C组)者26例;截止2021年10月存活(存活组)76例,死亡(死亡组)14例。纳入标准:①临床诊断满足《肝硬化诊治指南》标准[6]。②伴明显腹胀、下肢水肿、少尿等症状。③均进行腹腔穿刺术。④入院时均采集血清及腹水标本。⑤临床资料完整。⑥患者及其家属知情同意并签署知情同意书。排除标准:①肾源性、心源性等其他原因引起的腹水。②合并严重循环系统疾病或恶性肿瘤。③伴急性上消化道大出血、原发性腹膜炎。④伴有严重肠胀气或腹腔内粘连。⑤入院48 h内死亡患者。
1.2 方法 ①所有患者入院后均按照《肝硬化腹水及相关并发症的诊疗指南》[7]进行规范诊治,根据腹水情况及病因进行利尿、抗感染、护肝等对症治疗,另外给予营养支持治疗并合理限制盐分摄入。②收集所有患者临床病例资料中入院时的血清及腹水LDH、GLU、ALB水平。其中血清及腹水ALB水平由全自动生化分析仪(罗氏诊断公司,Cobas8000)行溴甲酚绿法所得,血清及腹水GLU水平由GLU检测试剂盒(罗氏诊断公司,国械准字20172400436)行己糖激酶法所得,血清及腹水LDH水平根据LDH检测试剂盒(罗氏诊断公司,国械准字20162404206)行比色法所得。根据血清及腹水ALB值计算SAAG水平,即血清ALB与腹水ALB的差值。对比分析不同肝功能分级及预后患者血清与腹水中LDH、GLU、SAAG水平。③随访:所有患者采用门诊或电话方式随访18个月,患者自出院开始接受随访,每3个月随访1次,随访终点为患者全因死亡或截至到2021年10月,记录患者生存情况。
1.3 统计学分析 采用SPSS 21.0软件进行统计学分析,计数资料用率(%)表示,两组间对比用卡方(2)检验,计量数据给予正态及方差齐性检验满足要求,用均数±标准差表示,组间行t检验;采用受试者工作特征(ROC)曲线评估血清及腹水中LDH、GLU、SAAG水平对肝功能分级的诊断价值;采用Logsitic回归分析血清及腹水中LDH、GLU、SAAG水平与肝功能分级的关系;采用Kaplan-Meier绘制生存曲线分析,以P<0.05为差异有统计学意义。
2 结果
2.1 不同肝功能分级患者一般资料比较 不同肝功能分级患者一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
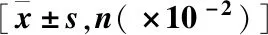
表1 不同肝功能分级患者一般资料比较Table 1 Comparison of general data of patients with different liver function grades
2.2 不同肝功能分级患者血清与腹水LDH、GLU、SAAG水平比较 C组血清与腹水LDH、GLU、SAAG水平均高于A组及B组,B组血清与腹水LDH、GLU、SAAG水平均高于A组,3组比较差异有统计学意义(P<0.05),见表2。

表2 不同肝功能分级患者血清与腹水LDH、GLU、SAAG水平比较Table 2 Comparison of levels of LDH,GLU and SAAG in serum and ascites of patients with different liver function grades
2.3 不同预后患者血清与腹水LDH、GLU、SAAG水平比较 死亡组血清与腹水LDH、GLU及SAAG水平均高于存活组,两组比较差异有统计学意义(P<0.05),见表3。

表3 不同预后患者血清与腹水LDH、GLU、SAAG水平比较Table 3 Comparison of levels of LDH,GLU and SAAG in serum and ascites of patients with different prognosis status
2.4 血清与腹水LDH、GLU、SAAG水平对肝功能分级的评估价值 将肝功能分级进行二分类(C级=1;C级以下=0),血清及腹水LDH、GLU、SAAG水平诊断肝功能分级的效能较高,SAAG水平的诊断效能最高(P<0.05)。血清LDH约登指数最大时截断值为292.78 IU/L,诊断肝功能C级的AUC为0.826,敏感度、特异度分别为96.15%、56.25%;腹水LDH约登指数最大时截断值为135.93 IU/L,诊断肝功能C级的AUC为0.823,敏感度、特异度分别为69.23%、82.81%;血清GLU约登指数最大时截断值为8.05 mmol/L,诊断肝功能C级的AUC为0.775,敏感度、特异度分别为53.85%、87.50%;腹水GLU约登指数最大时截断值为8.16 mmol/L,诊断肝功能C级的AUC为0.830,敏感度、特异度分别为76.92%、76.56%;SAAG约登指数最大时截断值为22.99 g/L,诊断肝功能C级的AUC为0.922,敏感度、特异度分别为88.46%、87.50%。见表4、图1。

表4 血清与腹水LDH、GLU、SAAG水平对肝功能分级的预测价值Table 4 Predictive value of levels of serum and ascites LDH,GLU and SAAG on liver function grading

图1 血清与腹水LDH、GLU、SAAG水平诊断肝功能分级的ROC曲线Figure 1 ROC curves of levels of serum and ascites LDH,GLU and SAAG in the diagnosis of liver function grading
2.5 影响患者肝功能分级的危险因素分析 经Logistic回归分析得出,入院时SAAG水平>22.99 g/L是患者肝功能分级为C级的独立危险因素(P<0.05),见表5。

表5 影响肝功能分级的危险因素Logistic回归分析Table 5 Logistic regression analysis of risk factors affecting liver function classification
2.6 不同SAAG水平的肝硬化腹水患者生存分析 90例患者18个月总生存率为84.44%,入院时SAAG呈高水平(>22.99 g/L)的患者18个月生存率低于SAAG呈低水平(≤22.99 g/L)的患者(P<0.05),见表6、图2。

图2 不同SAAG水平的肝硬化腹水患者生存曲线图Figure 2 Survival curve of cirrhotic ascites patients with different SAAG levels

表6 不同SAAG水平的肝硬化腹水患者的生存分析Table 6 Survival analysis of cirrhotic ascites patients with different SAAG levels
3 讨论
肝硬化腹水可加重肝硬化患者肝功能的损伤程度,造成腹膜炎、肝肾综合征甚至肾功能衰竭,严重影响肝硬化患者的预后[8]。因此,临床正确评估肝硬化腹水患者的临床指征及肝功能,明确肝硬化相关指标与腹水患者肝功能严重程度及预后的关系,对早期诊断并及时治疗腹水,提高患者生存质量,改善患者预后有着重要意义[9-11]。
肝功能Child-Pugh分级是目前临床普遍采用的评估患者肝脏储备功能的量化分级标准,分为A、B、C三级,评级越高说明患者肝脏病变程度及储备功能越差[12]。本研究显示:肝功能C级患者的血清与腹水LDH、GLU、SAAG水平均高于A级和B级,B级患者血清与腹水LDH、GLU、SAAG水平均高于A级,且血清及腹水LDH、GLU、SAAG对肝功能分级的效能均较高,其中SAAG的效能最高,诊断肝功能C级的AUC为0.922,敏感度、特异度分别为88.46%、87.50%。这些结果提示血清与腹水LDH、GLU、SAAG水平的升高可能与肝硬化腹水患者的肝功能受损情况有关,肝脏储备功能越差的患者,其血清与腹水LDH、GLU、SAAG水平越高,且SAAG水平最能反映患者肝功能情况。由于LDH是肝脏实质细胞中内将乳酸催化成丙酮酸这一过程逆转的重要氧化还原酶,而这一逆转属于糖异生,肝硬化患者的肝脏组织纤维化,肝细胞糖代谢主要由糖异生代替,外加门静脉压力增大,使得肝脏实质细胞受到损伤后,血清及肝周组织内的LDH外渗入腹水中,腹水LDH含量随之上升[13-14]。另有研究证实肝硬化患者血清LDH水平变化与肝脏病变及代偿程度有关,腹水一般发生于肝硬化失代偿期,此时的血清LDH普遍增高,肝脏的糖代谢功能异常,腹水GLU水平随着血液GLU的升高而呈上升趋势[15-16]。本研究还显示,SAAG水平是影响肝功能分级的独立危险因素。究其原因可能为:肝硬化腹水形成的主要原因是肝脏纤维化后肝内血管变形,门静脉血流受阻,导致门静脉血管内压力增高,毛细血管静脉压增高,水分漏入腹腔[17]。SAAG的高低可以直接反映血管内血浆胶体渗透压与腹水胶体渗透压之间的差异,间接反映患者是否为门静脉高压性腹水,该差值越大说明血浆与腹水胶体渗透压间差异越大,门静脉压力越高,临床将SAAG超过11 g/L的腹水诊断为门静脉高压性腹水[18-19]。张鸣等[20]研究表明,随着SAAG越高,肝功能Child-Pugh分级越高,说明肝硬化患者SAAG升高程度与肝脏衰退程度密切相关,且SAAG不受肝性脑病、腹水等主观因素影响,可客观、准确反映肝硬化腹水患者肝细胞储备功能,这与本研究结果一致。因此,入院时的SAAG水平可以作为肝硬化腹水患者肝功能严重程度的关键性指标。
由于腹水是肝硬化患者预后不良的主要表现,因此本研究进一步分析了SAAG水平与肝硬化腹水患者预后生存率的关系,结果显示:入院时SAAG呈高水平(>22.99 g/L)的患者18个月生存率低于SAAG呈低水平(≤22.99 g/L)的患者,说明SAAG水平与肝硬化腹水患者预后有关,患者SAAG水平越高,患者预后越差。王晓春等[21]研究表明,随着腹水量的增多,患者肝功能损害更加严重,出现腹膜炎、肾衰竭及电解质紊乱等并发症的几率更大,影响治疗效果及患者预后。Prabhu等[22]的研究表明,随着SAAG水平上升,肝硬化失代偿期患者肝性脑病越严重,预后越差,SAAG的升高与HE的严重程度及腹水程度密切相关。
4 结论
随着血清与腹水LDH、GLU、SAAG水平的升高,肝硬化腹水患者的肝功能分级增高,预后不良发生率上升,其中SAAG水平是影响肝功能严重程度的独立危险因素,可作为评估患者预后的重要指标。

