采前喷施胺鲜酯对采后‘巨峰’葡萄果实品质和活性氧代谢的影响
余 鹏,孟祥轩,余义和,杨英军
(河南科技大学园艺与植物保护学院,河南 洛阳 471023)
葡萄(Vitis viniferaL.)果实汁多味美,含有大量对人体有益物质,具有较高的营养和药用价值[1]。随着人们对水果保健功能的逐渐重视,对葡萄的需求量也日益增加。然而葡萄果实采后活性氧(reactive oxygen species,ROS)代谢旺盛,极易在贮藏期间发生腐烂变质,严重影响葡萄的营养和商业价值。据统计,我国每年葡萄在贮藏期的损失量高达葡萄总产量的27%以上,造成巨大的经济损失[2]。
目前,应用在葡萄上的保鲜方法主要有低温、高压静电处理、热处理、辐照等物理保鲜方法,具有操作简单方便等优点,但其投入成本和技术设备要求高,无法大面积推广;生物保鲜包括涂膜和天然提取物保鲜等方法,此方法虽然有一定的保鲜效果,但具有处理后果实品质不稳定、成本高等缺点;化学保鲜包括臭氧、二氧化氯、二氧化硫、1-甲基环丙烯等处理方法,化学保鲜效果不错,但完全无毒、经济实用且广谱抑菌的理想防腐保鲜剂尚未发现;气调贮藏的保鲜效果较好,但成本和维护费用高,只适用于大型企业,适用面小[3-4]。因此,有必要对葡萄的新型保鲜技术进行深入研究。
ROS是‘巨峰’葡萄(Vitis viniferaL.hVitis labruscaL.‘Kyoho’)有氧代谢过程中产生的一类氧化能力强、化学性质较活泼的含氧物质,包括g、丙二醛(missile defense agency,MDA)等,主要在线粒体内产生,是植物在有氧代谢过程中电子传递至氧分子时产生的活跃并具毒害作用的含氧物质的总称[5]。ROS清除酶和内源抗氧化物质共同组成ROS清除系统。ROS清除酶主要有超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(aseorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)、谷胱甘肽还原酶(gluathione reductase,GR)等;内源抗氧化物质有还原型抗坏血酸(reduced ascorbic acid,AsA)、还原型谷胱甘肽(reduced glutathione,GSH)[6-8]。正常情况下,通过及时清除葡萄内产生的ROS,使ROS的产生与清除处于平衡,从而保证果实品质;但采后葡萄体内ROS清除能力下降,ROS的产生与清除失去平衡,导致葡萄体内积累过多的ROS,加速其衰老和变质。
胺鲜酯(diethyl aminoethyl hexanoate,DA-6)是一种新型无毒的植物调节剂,化学式为C12H25NO2,可提高植物过氧化物等活性,具有容易调配、操作方便的优点,同时具有改善果实品质的功能[9-10]。已有研究发现,采前喷施DA-6可以保持龙眼果实果皮细胞膜完整性,提高采后龙眼果实的耐贮性及采后果皮的ROS清除能力[11-12]。此外,在葡萄着色初期喷施30% DA-6和乙烯利复配剂可促进葡萄着色,增加可溶性固形物和VC含量,提高果实品质[13]。目前,通过采前喷施DA-6探索其对采后‘巨峰’葡萄品质和ROS代谢影响的研究尚鲜见报道。
本研究以‘巨峰’葡萄为实验材料,通过采前喷施不同浓度DA-6,分析了不同质量浓度DA-6对‘巨峰’葡萄果实采后品质和ROS代谢的影响,旨在为提高葡萄采后品质及贮运保鲜提供有效的技术方法和理论依据。
1 材料与方法
1.1 材料与试剂
‘巨峰’葡萄采摘于河南科技大学葡萄试验基地。挑选大小、颜色、成熟程度相似的葡萄果实。葡萄采收后立即送至实验室,清水洗净并晾干后,将葡萄于(0f 1)℃、相对湿度65%~70%条件下贮藏[14]。
氮蓝四唑、甲硫氨酸、核黄素、对氨基苯磺酸二硫代硝基苯甲酸、硫代巴比妥酸、邻菲罗啉、α-萘胺郑州慧耕达生物科技有限公司;过氧化氢、抗坏血酸、三氯乙酸、盐酸羟胺、三氯化铁、乙醇、磷酸、乙二胺四乙酸、磷酸二氢钠、石英沙、碳酸钙 河南宝格生物技术有限公司;硫酸 北京化工厂。
1.2 仪器与设备
FHM-5果实硬度计、PAL-1型数显糖度计 点将(上海)科技股份有限公司;PAL-ACID1数显酸度计ATAGO(爱拓)中国分公司;VELOCITY 18R高速离心机 天美仪拓实验室设备(上海)有限公司;UV-4802紫外分光光度计 尤尼柯(上海)仪器有限公司;Cubis II电子天平 德国赛多利斯公司。
1.3 方法
1.3.1 样品预处理
本实验分别使用质量浓度0(对照)、10、30、50、70 mg/L DA-6在葡萄转色期喷施于果实表面,每种处理选取6 穗,一共30 穗。采集贮藏0、20、30、40、50、60 d的葡萄果实进行实验。每个处理设置3 次重复。
1.3.2 品质指标的测定
在各个阶段实验前对果实称质量并记录,按公式(1)计算质量损失率。

果实硬度测定:使用FHM-5果实硬度计测定果实赤道线3 个点的硬度,单位为N。
总可溶性固形物(total soluble solids,TSS)质量分数测定:参照田雪婷[15]的方法,采用PAL-1型数显糖度计测定果汁中TSS质量分数。
可滴定酸(titratable acid,TA)质量分数测定:参考陈楚英等[16]的方法,采用数显酸度计测定TA质量分数。
1.3.3 ROS清除酶活力的测定
选取质量浓度0 mg/L DA-6处理的果实作为对照组,质量浓度50 mg/L DA-6处理的果实为处理组。
酶液提取:两个处理组中各取一颗果实,去皮、梗、籽后,液氮研磨后转移到研钵中,加入适量磷酸盐缓冲液(50 mmol/L、pH 7.0)并在冰浴中研磨,充分混匀后定容,在4 ℃、15000hg下离心20 min,转移上清液并用磷酸盐缓冲液定容至20 mL,取上清液作为活性氧清除酶提取液。
参照Han Cong等[17]的方法测定SOD活力,单位为U/gmf;参照Shadmani等[18]的方法测定CAT活力,单位为U/gmf;参照曹建康等[19]的方法测定APX活力,单位为U/gmf;根据Solarbio试剂盒(BC1160)说明书测定GR活力。
1.3.4 内源抗氧化物含量测定
选取质量浓度0 mg/L DA-6处理的果实作为对照组,质量浓度50 mg/L DA-6处理的果实为处理组。称取1 g葡萄鲜果样品,参考Arakawa等[20]的方法进行AsA含量测定,单位为nmol/gmf,计算如公式(2)所示;称取5 g葡萄冻果样品,参考曹建康等[19]的方法进行GSH含量测定,单位为nmol/gmf,计算如公式(3)所示。

式中:V1为样品总体积/mL;n为A s A 物质的量/nmol;V2为吸取样品体积/mL;m为样品质量/g。
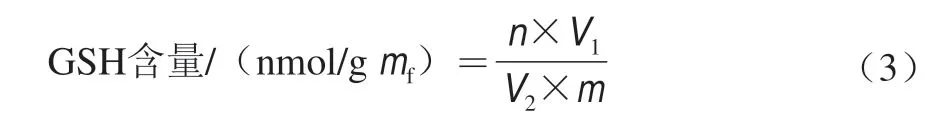
式中:n为GSH物质的量/nmol;V1为提取液总体积/mL;V2为吸取样品体积/mL;m为样品质量/g。
选取质量浓度0 mg/L DA-6处理的果实作为对照组,质量浓度50 mg/L DA-6处理的果实为处理组。称取5 g葡萄鲜果样品,参考曹建康等[19]的方法测定·产生速率,单位为nmol/(ming gmf),计算如公式(4)所示。

式中:n为·物质的量/nmol;V1为提取液总体积/mL;V2为吸取样品体积/mL;t为样品反应时间/min;m为样品质量/g。
称取1 g葡萄鲜果样品,参考曹建康等[19]的方法测定MDA含量,单位为µmol/gmf,计算如公式(5)所示。
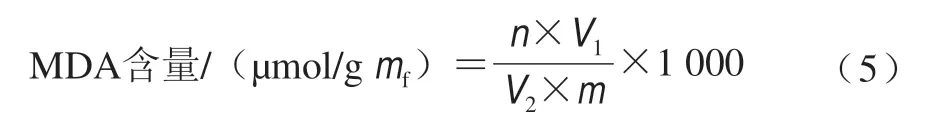
式中:n为MDA物质的量/µmol;V1为样品总体积/mL;V2为测定样品体积/mL;m为样品质量/g。
1.3.6 DPPH自由基清除率和总还原能力的测定
选取质量浓度0 mg/L DA-6处理的果实作为对照组,以质量浓度50 mg/L DA-6处理的果实为处理组。参考Floegel等[21]的方法测定DPPH自由基清除率,称取1 g葡萄鲜果样品进行实验,DPPH自由基清除率单位为%,计算如公式(6)所示。参考Chen Chen等[22]的方法测定总还原能力,称取1 g葡萄鲜果样品进行实验,总还原能力单位为g/kg。
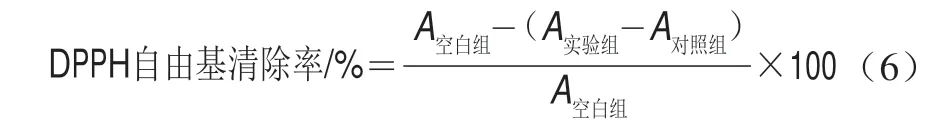
1.4 数据处理与分析
以上实验均进行3 次,数据用平均值±标准差表示。利用Excel 2019软件作图,采用SPSS 26软件对各组数据进行单因素方差分析。
2 结果与分析
2.1 采前喷施DA-6对贮藏期‘巨峰’葡萄果实品质的影响
随着贮藏时间的延长,各个处理组的果实质量损失不断加剧。由表1可知,在贮藏20、30 d时,质量浓度30、50、70 mg/L DA-6处理的果实质量损失率显著低于其他处理组(P<0.05);贮藏40 d时,质量浓度50 mg/L DA-6处理果实的质量损失率显著低于质量浓度0、10、70 mg/L DA-6处理果实(P<0.05);贮藏50、60 d时,质量浓度50 mg/L DA-6处理果实的质量损失率显著低于其他处理组(P<0.05)。贮藏20 d时,各处理组之间果实硬度均无显著性变化(P>0.05);贮藏30 d起,质量浓度50 mg/L DA-6处理的果实硬度明显高于其他处理组。

表1 采前喷施DA-6对贮藏期‘巨峰’葡萄果实质量损失率、硬度、TSS、TA质量分数的影响Table 1 Effect of preharvest spray of DA-6 on mass loss percentage,hardness,total soluble solid content and titratable acidity of ‘Kyoho’grapes during postharvest storage
贮藏20、30 d时,各处理组间TSS质量分数均无显著性差异(P>0.05);贮藏40 d时,质量浓度50 mg/L DA-6处理的果实TSS质量分数高于其他处理,且与质量浓度0、10、30 mg/L DA-6处理组具有显著性差异(P<0.05);贮藏50、60 d时,质量浓度10、30、50、70 mg/L DA-6处理的果实TSS质量分数均明显高于对照组。在整个葡萄贮藏期间,各处理间果实TA质量分数均无显著性差异(P>0.05)。上述结果表明采前喷施DA-6可有效维持果实的贮藏品质,其中质量浓度50 mg/L DA-6处理效果最佳,故选择质量浓度50 mg/L DA-6进行后续实验。
2.2 采前喷施DA-6对贮藏期‘巨峰’葡萄果实抗氧化酶的影响
由图1A可知,在贮藏期间对照组和处理组的SOD活力均呈现先升高后下降的趋势,且贮藏30 d后对照组果实SOD活力显著低于质量浓度50 mg/L DA-6处理果实(P<0.05);贮藏0~40 d,质量浓度50 mg/L DA-6处理的果实SOD活力呈上升趋势,在40 d时SOD达到最高值后开始下降。与SOD活力变化趋势相似,CAT活力在贮藏阶段同样呈现先升高后下降的趋势(图1B)。其中,处理组果实CAT活力在贮藏40 d达到峰值后开始下降,对照组则从贮藏20 d开始持续下降,且始终低于处理组CAT活力。由图1C可知,处理组与对照组葡萄的APX活力在葡萄贮藏阶段大体上呈现先下降后上升的趋势,且质量浓度50 mg/L DA-6处理的果实APX活力一直高于对照组。由图1D可知,处理组与对照组GR活力变化趋势保持一致,均在贮藏40 d前呈上升趋势,40 d后开始下降;贮藏30 d后质量浓度50 mg/L DA-6处理的果实GR活力显著高于对照组(P<0.05)。结果表明,采前喷施DA-6可显著提高采后果实SOD、CAT、APX、GR活力。

图1 采前喷施DA-6对贮藏期‘巨峰’葡萄果实SOD(A)、CAT(B)、APX(C)、GR(D)活力的影响Fig.1 Effect of preharvest spray of DA-6 on activities of SOD (A),CAT (B),APX (C) and GR (D) in ‘Kyoho’ grape fruit during postharvest storage
2.3 采前喷施DA-6对贮藏期‘巨峰’葡萄果实AsA含量和GSH含量的影响
果实内AsA含量与GSH含量越高,代表果实遭受ROS侵害越轻,抗氧化效果越好。由图2A可知,贮藏期间处理组和对照组的AsA含量变化趋势一致。在贮藏前期(0~20 d),对照组和处理组的AsA含量和GSH含量无显著性差异(P>0.05);贮藏30 d后,质量浓度50 mg/L DA-6处理果实的AsA含量显著高于对照组(P<0.05)。同样,在贮藏30、40、60 d时,质量浓度50 mg/L DA-6处理果实的GSH含量显著高于对照组(P<0.05),总体保持下降趋势(图2B)。这表明采前喷施DA-6显著提高了采后葡萄果实AsA含量和GSH含量。

图2 采前喷施DA-6对贮藏期‘巨峰’葡萄果实AsA含量(A)和GSH含量(B)的影响Fig.2 Effect of preharvest spray of DA-6 on ASA (A) and GSH (B)contents in ‘Kyoho’ grape fruit during postharvest storage
2.4 采前喷施DA-6对贮藏期‘巨峰’葡萄果实g产生速率和MDA含量的影响


图3 采前喷施DA-6对贮藏期‘巨峰’葡萄果实g 产生速率(A)和MDA含量(B)的影响Fig.3 Effect of preharvest spray of DA-6 on superoxide anion production rate (A) and MDA content (B) of ‘Kyoho’ grape fruits during postharvest storage
2.5 采前喷施DA-6对贮藏期‘巨峰’葡萄果实DPPH自由基清除率和总还原能力的影响
葡萄果实中DPPH自由基清除率和总还原能力是评估果实的抗氧化能力的重要指标,越高表明抗氧化能力越好。由图4A可知,处理组和对照组的DPPH自由基清除率随着贮藏时间的延长呈现持续下降的趋势。在贮藏期前期(0~30 d),对照组和处理组之间的DPPH自由基清除率没有显著性差异(P>0.05);贮藏30 d后,质量浓度50 mg/L DA-6处理组果实DPPH自由基清除率显著高于对照组(P<0.05)。由图4B可知,处理组和对照组的总还原能力变化趋势大体一致。在贮藏20、30 d时,与对照组相比,质量浓度50 mg/L DA-6处理的果实总还原能力显著高于对照组(P<0.05)。结果表明,采前喷施DA-6可有效提升果实DPPH自由基清除率和总还原能力,提高果实抗氧化能力。
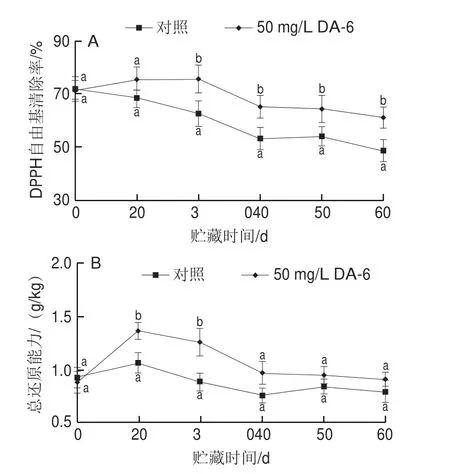
图4 采前喷施DA-6对贮藏期‘巨峰’葡萄果实DPPH自由基清除率(A)和总还原能力(B)的影响Fig.4 Effect of preharvest spray of DA-6 on DPPH radical scavenging capacity (A) and total reducing power (B) of ‘Kyoho’ grape fruit during postharvest storage
3 讨论
采后果实贮藏时间长短与果实ROS代谢相关[23]。本研究通过在‘巨峰’葡萄转色期喷施不同质量浓度的DA-6,测定果实品质(ROS代谢强度的生理指标),探究DA-6对葡萄贮藏期品质和ROS代谢的影响。结果发现,喷施不同质量浓度DA-6均可有效提高葡萄品质,延长葡萄的贮藏期,其中质量浓度50 mg/L DA-6处理效果最佳,可明显降低葡萄果实的质量损失率,保持果实硬度、TSS质量分数,从而提高了果实的品质;此外,通过分析与ROS代谢相关指标变化,包括SOD活力、CAT活力、APX活力、GR活力、AsA含量、GSH含量、·产生速率、MDA含量、DPPH自由基清除率和总还原能力,表明质量浓度50 mg/L DA-6处理对果实中ROS代谢产生明显影响。
葡萄果实的耐贮性与果实品质有关,随着贮藏时间的延长,果实内水分和营养物质也都发生了变化。在本研究中,与对照组相比,转色期喷施DA-6的葡萄果实能够在贮藏期保持较好的品质,其中质量浓度50 mg/L DA-6处理组果实的保鲜效果最佳(表1)。这与林毅雄等[11-12]研究结果一致,对龙眼果实采前喷施DA-6同样可得到提高果实贮藏品质的效果,增强果实的耐贮性,不同的是质量浓度10 mg/L DA-6处理对龙眼采后保鲜效果最佳,而本研究中质量浓度50 mg/L DA-6处理对‘巨峰’葡萄采后保鲜效果最显著。
当果实品质下降时,自由基代谢平衡系统被破坏,ROS大量积累,引起膜脂过氧化,ROS主要包括·OH、·、单线态氧(singlet oxygen,1O2)、H2O2等[24]。MDA是膜脂过氧化的最终产物,其含量直接反映了果实的品质。植物体内的抗氧化系统包含酶类和非酶类,可通过清除或转化ROS平衡细胞体内ROS含量。SOD、CAT、APX和GR是植物体内主要的ROS清除酶,其活力与ROS清除效率成正比。SOD将·歧化为H2O2和O2,H2O2再经CAT和APX催化生成无害的H2O和O2,随着·含量增长的减缓,MDA也随之增长,从而延长葡萄果实的保质期。罗杨等[25]研究表明SOD、APX、CAT活力上升,加快ROS清除反应,延缓采后新鲜木耳的衰老;Sun Junzheng等[23]研究表明SOD、APX、CAT、GR等ROS清除酶活力与·和MDA含量成反比,影响果实采后品质。同样,本研究表明采前喷施质量浓度50 mg/L DA-6显著提高了采后‘巨峰’葡萄果实中ROS清除酶活力,遏制了ROS的积累,延缓了果实的衰老,延长了果实的货架期。
AsA和GSH是非酶促防御系统中的重要抗氧化剂[26-27],保障AsA-GSH循环系统的正常运作,加速H2O2分解。已有研究发现通过提高SOD、CAT、APX活力和GR活力可以促进AsA和GSH的再生,从而延缓猕猴桃果实衰老[28]。本研究中,质量浓度50 mg/L DA-6处理组的葡萄果实AsA含量和GSH含量高于对照组,维持采后果实ROS清除能力,以提高果实的耐贮性。千春录等[29]的研究表明,较高的AsA含量和GSH含量可以有效减轻猕猴桃果实发氧化;林艺芬[30]的研究也同样表明AsA和GSH可以及时清除龙眼果皮中积累的ROS,维持果皮细胞膜结构完整,从而抑制采后品质发生劣变。
DPPH自由基清除率和总还原能力是评估果实抗氧化能力的重要指标[31]。已有研究发现较高的DPPH自由基清除率和总还原能力能有效减少ROS的产生和积累[32]。本研究中质量浓度50 mg/L DA-6处理组的葡萄果实DPPH自由基清除率和总还原能力均高于对照组,有效缓解了膜脂过氧化,保持了葡萄果实品质,提高了葡萄果实的耐贮性。郭欣等[32]研究也同样表明较高的DPPH自由基清除率和总还原能力可以延缓西番莲果实衰老;Lin Yifen等[33]研究表明,较高的DPPH自由基清除率和总还原能力可以延缓果皮褐变与病害的发生。
4 结论
本研究结果表明,喷施质量浓度10、30、50、70 mg/L的DA-6处理可有效维持贮藏期‘巨峰’葡萄外观品质,其中质量浓度50 mg/L DA-6处理效果最好;进一步研究发现,质量浓度50 mg/L DA-6处理相较于对照组显著提升采后果实中SOD、CAT、APX、GR活力,维持果实内ROS清除能力;提高AsA含量和GSH含量,增强果实的抗氧化效果;提升DPPH自由基清除率和总还原能力,增强果实的抗氧化能力;降低·产生速率和MDA含量,控制果实的氧化速率。以此平衡‘巨峰’葡萄果实中ROS代谢,增强果实抗氧化能力,降低果实氧化速率,提高果实耐贮性,延缓果实衰老。本研究为葡萄贮藏保鲜提供了一种易操作且高效的方法。

