血清CYFRA21-1、HE4水平与非小细胞肺癌患者病理特征和预后的相关性*
汪赛兵 周美文 张宜武
(铜陵市立医院检验科,安徽 铜陵 244100)
据报道,肺癌发病率以及死亡率均位居恶性肿瘤首位,而我国每年约60万人死于肺癌[1]。因非小细胞肺癌发病较为隐匿,部分患者诊出时已处于中晚期,导致疗效不是特别理想,既往研究表明患者5年生存率平均为15%~17%[2]。故寻找可反映非小细胞肺癌患者病情进展及预后的标志物是目前肿瘤研究热点。肿瘤标志物(Tumor marke,TM)是肿瘤在发生、发展、浸润、转移过程中产生的物质,其含量通常远超正常人体内含量,可反映肿瘤的发生发展。血清细胞角蛋白19片段(Cytokeratin 19 fragment-1,CYFRA21-1)是癌细胞分化过程中产生的,在多种正常上皮组织中存在,因癌细胞坏死、溶解而释放入血中[3]。既往研究表明CYFRA21-1在肺癌中含量尤其丰富,并认为是检测肺鳞癌的首选TM[4]。解宝泉等[5]认为CYFRA21-1水平与存活期有一定的相关性,对于推断肺癌患者预后和指导治疗有重要意义。人附睾蛋白4(Human epididymal protein 4,HE4)最初被发现在卵巢癌患者中高表达,且对卵巢癌的诊断和复发监测有一定价值[6]。近年来研究发现HE4在肺癌中也存在高表达,并与患者不良预后相关[7]。目前针对非小细胞肺癌患者CYFRA21-1、HE4临床意义的研究多集中于诊断方面,在病情监测以及预后方面研究较少。基于此,本研究旨在探讨血清CYFRA21-1、HE4水平与非小细胞肺癌患者病理特征和预后的相关性,现报告如下。
1 资料与方法
1.1 一般资料 选择本院2017年2月~2019年5月诊治的112例非小细胞肺癌患者作为肺癌组。纳入标准:①符合肺癌诊断标准[8],且经病理组织确诊。②患者临床资料完整。③患者及家属知情并签署知情同意书。排除标准:①合并其他器官实质性疾病。②合并其他肿瘤者。③治疗前未检测血清CYFRA21-1、HE4水平或检测不齐全。④继发转移性肺癌者。⑤随访期间失访患者。另选择同期来院体检的健康志愿者92例作为对照组。肺癌组治疗后随访2年,根据患者预后情况分为预后良好组64例和预后不良组48例。本研究获医院伦理委员会审核批准。
1.2 方法 收集患者年龄、性别、病理类型、临床分期等病理资料。抽取所有研究对象清晨空腹静脉血3 mL,20~25℃室温下静置1 h,以3000 r/min离心15 min,取上清液待测。采用电化学发光法检测血清HE4水平,试剂盒由罗氏诊断公司提供;采用化学发光法检测血清CYFRA21-1水平,试剂盒罗氏诊断公司提供,所有操作步骤均严格按照说明书进行。通过电话、查阅病历资料、门诊复诊等方法对所有肺癌患者进行随访,随访截止日期为2021年5月31日,随访内容为了解患者目前生存情况以及不良预后(肺癌复发、转移或死亡)出现的具体时间,生存时间为患者确诊肺癌当日至患者出现不良预后或随访截止时间,时间均以“月”为单位。
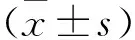
2 结果
2.1 两组一般资料比较 肺癌组男74例,女38例;年龄35~78岁,平均(54.62±10.35)岁;吸烟45例;饮酒31例;病理类型:腺癌66例,鳞癌46例;临床分期:Ⅰ期11例,Ⅱ期32例,Ⅲ期51例,Ⅳ期18例。对照组男61例,女31例;年龄38~81岁,平均(55.08±11.24)岁;吸烟34例;饮酒22例。两组患者一般资料比较差异无统计学意义(P>0.05)。
2.2 肺癌组与对照组血清CYFRA21-1、HE4水平比较 肺癌组患者血清CYFRA21-1、HE4水平均显著高于对照组(P<0.05),见表1。

表1 肺癌组与对照组血清CYFRA21-1、HE4水平比较
2.3 不同临床病理特征血清CYFRA21-1、HE4水平比较 不同性别、年龄以及病理类型患者血清CYFRA21-1、HE4水平比较无显著差异(P>0.05),但不同临床分期、转移情况患者血清CYFRA21-1、HE4水平比较差异有统计学意义(P<0.05),见表2。

表2 不同临床病理特征血清CYFRA21-1、HE4水平比较
2.4 血清CYFRA21-1、HE4水平与临床分期相关性 血清CYFRA21-1、HE4水平均与临床分期呈正相关(P<0.05),见表3、图1。

表3 血清CYFRA21-1、HE4水平与临床分期相关性

图1 血清CYFRA21-1、HE4水平与临床分期相关性
2.5 不同预后患者血清CYFRA21-1、HE4水平 预后不良组患者血清CYFRA21-1、HE4水平均显著高于预后良好组(P<0.05),见表4。

表4 不同预后患者血清CYFRA21-1、HE4水平
2.6 血清CYFRA21-1、HE4水平对肺癌预后的预测价值 ROC曲线显示当血清CYFRA21-1>6.43 μg/mL或HE4水平>73.12 pmol/L时,肺癌患者预后不良风险增高;血清CYFRA21-1、HE4联合检测的AUC值以及敏感度均显著高于单一检测(P<0.05)。见表5、图2。

表5 血清CYFRA21-1、HE4水平对肺癌预后的预测价值

图2 血清CYFRA21-1、HE4水平对肺癌预后的预测曲线
3 讨论
非小细胞肺癌发生诱因与人体生存环境关系密切,近年来,受环境污染、人类不良吸烟嗜好等诸多因素影响,肺癌发病率逐年攀升。据统计,2000年~2014年间我国城市地区肺癌增长率为3.0%~4.0%,农村地区为5.3%~7.0%[9]。目前我国早期确诊肺癌患者仅20%有手术机会,其余80%患者已丧失手术机会或无实质性手术效果[10]。故了解肺癌进展情况,对于临床医生诊治方案的确定十分重要。既往研究发现血清癌胚抗原(CEA)、CYFRA21-1等TM对于肺癌的发生具有较高的诊断价值[11]。单项TM在肺癌不同分期以及病理分型中具有一定的敏感度,但特异度较差,而多种TM的联合,在一定程度上可提高对于肺癌进展以及预后情况的判断准确性。
CYFRA21-1是近年来被深入研究的一种新型肺鳞癌TM,多存在于支气管树、肺泡等上皮细胞的胞浆内。该TM在一定程度上可提高肺癌早期诊断,在监测、疗效评估亦有较好价值,尤其适用于肺鳞癌。霍丹丹[12]通过比较分析发现CYFRA21-1水平在肺部良性疾病中表达较低,而在肺癌患者中显著增高。本研究也表明肺癌患者CYFRA21-1水平更高,与既往研究结果一致。肺癌细胞的凋亡会激活蛋白酶,促进细胞角蛋白被降解并释放入血,从而引起血液中CYFRA21-1含量的增高。HE4最初发现在人附睾远端上皮细胞中高表达的小分子分泌糖蛋白,最近研究表明HE4在除卵巢癌以外的其他癌症中也存在高表达现象,尤其是肺癌[13]。刘政宏等[14]采用免疫组化以及ELISA法在肺癌组织以及血清中均检测出了HE4的高表达;杜旭升等[15]表明免疫组化HE4阳性肺癌患者5年生存率显著低于阴性患者,并认为HE4表达与肺癌患者不良预后相关。本研究也发现肺癌患者血清HE4水平显著增高,进一步支持了既往研究。HE4在正常细胞内合成以及储存,正常情况下人血清中HE4含量极低,但当正常组织恶变以及浸润性癌细胞破坏正常组织结构后,HE4会被释放进入血液系统,导致血清HE4水平升高。在病理特征方面,本研究结果显示不同临床分期、转移情况患者血清CYFRA21-1、HE4水平比较有统计学意义,与既往檀燕[16]研究结果一致。且本研究还通过Spearman相关性发现血清CYFRA21-1、HE4水平均与临床分期呈正相关,进一步表明血清CYFRA21-1、HE4水平的高表达与非小细胞肺癌患者部分临床病理特征有一定相关性,有望成为监测肺癌病情的辅助指标。但本研究中肺癌病理类型与CYFRA21-1、HE4水平无相关性,与耿纪群等[17]研究结果不相符,推测其原因可能是本研究纳入患者多为中晚期患者,TM在不同病理类型中水平均较高,故差异不显著;同时还可能与上述两种TM对于病理类型诊断尚缺乏特异性有关。
目前临床对于血清TM是否对预后有意义尚存在争议,部分关于TM与肺癌预后的相关性研究得出了阴性结构。卢畅等[18]对肺癌患者TM与生存期关系研究中发现CYFRA21-1升高组与正常组生存期比较差异无统计学意义;陈雯微[19]对进展期肺癌患者化疗前后血清HE4水平对预后影响,未发现两组在总生存期上有统计学差异。但其他研究得出了相反结论,认为血清TM水平可预测肺癌患者预后。柴华等[20]研究显示肺癌转移组血清CEA、CA125水平显著高于未转移组。本研究结果显示预后不良组患者血清CYFRA21-1、HE4水平显著高于预后良好组,通过ROC曲线对上述指标的预后预测价值进一步分析,结果显示当血清CYFRA21-1、HE4联合检测的AUC值以及敏感度均显著高于单一检测,提示血清CYFRA21-1、HE4联合检测有望成为预测预后的辅助指标,且本研究提示当血清CYFRA21-1>6.43 μg/mL或HE4水平>73.12pmol/L时时,非小细胞肺癌患者不良预后的风险越大,临床对于此类患者应密切注意。但本研究样本量小,随访周期较短,后续期望更多的研究纳入更大的样本量以及更完整随访,进一步证实本研究结果。
4 结论
非小细胞肺癌患者血清CYFRA21-1、HE4水平均显著升高,且与临床分期密切相关,上述血清TM联合检测可较好的预测非小细胞肺癌患者预后,临床应重视对肺癌患者血清CYFRA21-1、HE4水平的监测,为非小细胞肺癌病情以及预后判断提供参考。

