丹酚酸A通过调节氧化应激抑制LPS诱导的人脐静脉血管内皮细胞NLRP3炎性小体的表达
张淼 邓悦 于克英 常丽萍 田腾辉 石锐 邵笑
动脉粥样硬化(atherosclerosis,AS)是由于胆固醇物质的过度沉积从而导致动脉硬化及管腔狭窄,进而在动脉壁上累积聚集形成AS[1]。炎症反应是AS的主要病因之一[2]。其中脂质沉积及炎性因子的释放能够造成内皮损伤、平滑肌细胞迁移及巨噬细胞极化,进而导致细胞外基质扩张,形成纤维帽,促进动AS斑块的形成[3]。
丹酚酸A(salvianolic acid A,Sal A)是唇形科植物丹参(SalviamiltiorrhizaBge.)的根茎中的主要活性成分,具有抑制氧化应激、抗炎、调节脂质代谢、保护血管内皮功能等作用[4],但尚未明确其对血管内皮细胞及炎性小体的影响和机制。因此本研究采用脂多糖(lipopolysaccharide,LPS)作用于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)造成炎性损伤,观察Sal A对HUVECs中活性氧(reactive oxygen species,ROS)含量及炎性小体相关指标的表达的影响,旨在明确Sal A对HUVECs损伤保护作用,为中医药预防和治疗AS提供科学依据。
1 材料与方法
1.1 实验细胞
HUVECs(武汉普诺赛生命科技有限公司)培养于DMEM培养基中(含10%胎牛血清及1%双抗),培养箱条件:37℃,5%CO2。
1.2 主要试剂和仪器
Sal A(索莱宝公司,批号:200D301);LPS(索莱宝公司,批号:820F038);胎牛血清(美国Clark公司,批号:FB25025);青链霉素双抗(美国Hyclone 公司,批号:SV30010);磷酸盐缓冲溶液(美国Hyclone 公司,批号:AC10257442);CCK-8试剂盒(索莱宝公司,批号:CA1210,);ELISA试剂盒(上海优选生物公司,批号:T1320);ROS检测试剂盒(碧云天生物技术公司,批号:S0033);总RNA提取试剂盒(天根生化科技有限公司,批号:DP419);RIPA裂解液(碧云天生物技术,批号:R0010);BCA蛋白浓度测定试剂盒(碧云天生物技术,批号:P0012);NLRP3一抗(美国CST 公司,批号:13158);ASC一抗(美国CST公司,批号:13833);GAPDH一抗(美国CST公司,批号:5174);辣根过氧化物酶二抗(Proteintech 公司,批号:SA00001)。
超净工作台(苏州净化有限公司);CO2细胞培养箱(美国Thermo公司);酶标仪(瑞士Tecan公司);RT-PCR仪(美国伯乐公司);智能成像系统(iBright,FL1000)。
1.3 CCK-8检测细胞活力
取对数生长期HUVECs细胞以每孔约1×104个接种于96孔板中,将细胞分为对照组、模型组、不同浓度Sal A组(6.25、12.5、25、50、100、200 μmol/L)及空白组(不含细胞)。待细胞完全贴壁后,弃培养基,对照组、空白组每孔加100 μL正常培养基,其余每孔加入含LPS(浓度1 μg/mL)的培养基100 μL以诱导炎性反应,培养4小时后,吸去培养基,对照组、模型组及空白组加入100 μL的正常培养基,各Sal A组分别加入浓度为6.25、12.5、25、50、100、200 μmol/L 的Sal A培养基,培养24小时后,每孔加入10 μL的CCK-8溶液,于培养箱中孵育2小时,在450 nm波长下测定吸光度(optical density,OD),并计算细胞活力。细胞活力(%)=(给药组-空白组)OD值/(对照组-空白组)OD值×100%,共测3次。
1.4 酶联免疫吸附法检测HUVECs中炎性因子肿瘤坏死因子-α(transforming necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的表达
取对数生长期HUVECs细胞以每孔约1×105个接种于6孔板中,将细胞分为:对照组、模型组、Sal A低剂量组、Sal A中剂量组及Sal A高剂量组。待细胞完全贴壁后,弃培养基,对照组加1 mL正常培养基,其余每孔加入含脂多糖(浓度1 μg/mL)的培养基1 mL以诱导炎性反应,培养4小时后,吸去培养基,对照组、模型组加入1 mL正常培养基,Sal A低剂量组、中剂量组及高剂量组分别加入浓度为6.25、12.5、25 μm/L 的SalA培养基1 mL,24小时后,将各组孵育后的细胞上清液以3000 r/分钟,离心10分钟除去颗粒和聚合物,严格并按照酶联免疫吸附法试剂盒说明书进行测定,共检测3次。
1.5 活性氧ROS检测
取对数生长期HUVECs细胞以每孔约1×105个接种于6孔板中,分组及给药同1.4;收集细胞后,严格按照ROS试剂盒说明书进行操作以测定各组细胞中活性氧ROS含量,检测3次。
1.6 实时荧光定量PCR检测含NLP家族Pyrin域蛋白3重组蛋白(recombinant NLR Family Pyrin domain containing protein3,protein3,NLRP3)、凋亡相关斑点样蛋白(adaptor protein apotosis speck-like protein containing CARD,ASC)、半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)、白细胞介素(interleukin,IL)-18、IL-1β mRNA表达
取对数生长期HUVECs细胞以每孔约1×105个接种于6孔板中,分组及给药同1.4,培养24小时后弃培养基,每孔加入1 mL RNA裂解液,按试剂盒步骤提取总RNA,检测RNA浓度及纯度,合格后转录为cDNA,继而进行实时荧光定量PCR扩增(扩增条件:95℃,30 s,95℃,5 s,60℃,30 s,40个循环),最后用2-ΔΔCT计算各目的基因的表达变化,检测3次。PCR引物序列见表1。

表1 引物序列
1.7 蛋白免疫印迹检测NLRP3、ASC蛋白表达
取对数生长期HUVECs细胞以每孔约1×105个接种于6孔板中,分组及给药同1.4,培养24小时后弃培养基,给予RIPA裂解液提取总蛋白,BCA法测定各组细胞蛋白浓度后将浓度调平;配置6%及12%分离胶,5%浓缩胶,各组蛋白等量上样进行电泳,转膜,5%脱脂奶粉室温封闭1小时,4度一抗(1∶1000)封闭过夜,后经二抗(1∶2000)室温孵育1小时;超敏ECL试剂盒显色,成像仪拍照。使用Image J软件带进行灰度值分析,目的蛋白均以GAPDH为内参,每个指标测定3次。
1.8 统计学方法
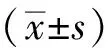
2 结果
2.1 Sal A对HUVECs细胞活性的影响
与对照组比较,模型组在LPS刺激后细胞活性显著下降(P<0.05);与模型组比较,Sal A各组在一定范围内以浓度依赖方式提高细胞活性,当浓度为25 μm/L时效果最明显(P<0.05)。见表2。

表2 Sal A对HUVECs细胞活性的影响
2.2 Sal A对HUVEC细胞TNF-α、IL-1β表达的影响
CCK-8检测细胞活性结果提示,Sal A浓度为25 μm/L时,细胞活性升高最为显著,故以LPS 1 μg/mL +Sal A 25μmol/L为高剂量组,LPS 1 μg/mL +Sal A 12.5μmol/L为中剂量组,LPS 1 μg/mL +Sal A 6.25 μmol/L为低剂量组。酶联免疫吸附法检测结果表示:与对照组比较,模型组TNF-α、IL-1β含量显著增高(P<0.05);与模型组比较,Sal A低剂量组、中剂量组及高剂量组中TNF-α、IL-1β表达显著下降(P<0.05)。见表3。

表3 Sal A对HUVECs细胞TNF-α、IL-1β表达的影响
2.3 Sal A对HUVECs细胞ROS表达的影响
与对照组比较,模型组ROS表达显著升高(P<0.05);与模型组比较,Sal A低、中、高剂量组ROS表达均有所降低(P<0.05)。见表4。
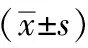
表4 Sal A对HUVECs细胞ROS表达的影响
2.4 Sal A对HUVECs细胞NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表达水平的影响
与对照组相比,模型组NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA的表达量升高(P<0.05);与模型组相比,Sal A低、中、高剂量组中NLRP3、ASC、 Caspase-1、IL-1β、IL-18 mRNA表达水平均降低(P<0.05)。见表5。

表5 Sal A对HUVEC细胞NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表达水平的影响
2.5 Sal A对HUVECs细胞NLRP3、ASC蛋白表达水平的影响
与对照组相比,模型组NLRP3、ASC 蛋白表达量升高(P<0.05);与模型组相比,各浓度Sal A组中NLRP3、ASC 蛋白表达水平均降低(P<0.05)。表6、见图1。

表6 丹酚酸A对HUVECs细胞NLRP3、ASC蛋白表达水平的影响

注:A 对照组;B 模型组;C Sal A低剂量组;D Sal A 中剂量组;E Sal A高剂量组。
3 讨论
NLRP3炎性小体的结构包括受体蛋白NLRP3、凋亡相关斑点蛋白ASC及效应蛋白Caspase-1以三部分[5]。当NLRP3炎性小体激活后,半胱氨酸天冬氨酸蛋白酶的无活性前体pro-Caspase-1,在ASC的作用下聚集并被水解为具有生物活性的Caspase-1,继而Caspase-1将无活性的pro-IL-1β和pro-IL-18,剪切为炎性因子IL-1β、IL-18,从而发细胞焦亡[6]。研究表明,与正常组织比,人颈动脉斑块中NLRP3、ASC、IL-1β和IL-18 mRNA表达显著增高[7]。目前研究认为NLRP3炎症小体激活的机制复杂,大致可分为以下三种方式:(1)离子再分布,当细胞外ATP含量升高,P2X嘌呤受体7(P2X7)信号通路介导离子通道开放,从而促进K+外流,NLRP3炎性小体在钾离子通量发生改变时被激活[8];(2)溶酶体损伤,当胞外晶体或特殊颗粒如蛋白聚集体等进入细胞内后,引起溶酶体破裂,在多种组织蛋白酶作用于细胞膜,促进钾离子外流,进而促进NLRP3炎症体的聚集和激活;(3)ROS的产生,ROS作为NLRP3炎性小体形成和激活的关键因素,可依赖PAMPs和DAMPS通过ROS依赖的信号通路产生,当ROS的产生和清除失衡时,引起氧化应激,进而导致DNA损伤、脂质过氧化和蛋白质的氧化修饰[9]。研究表明,线粒体功能障碍,则能够导致mtROS的产生,激活NLRP3炎性小体,同时氧化的mtDNA也是激活NLRP3炎性小体的原因之一[10]。
内皮功能障碍是AS发生发展的重要因素之一,可通过炎症、氧化应激及自噬等不同机制参与动脉粥样硬化的发生。内皮细胞作为NLRP3炎性小体激活后的产物IL-1β的靶细胞之一,当炎症反应被激活后,内皮细胞功能不仅受到影响,还能够促进内皮细胞分泌粘附分子和趋化因子以进一步促进炎症[11]。当NLRP3炎性小体被激活后,其分泌的IL-18和IL-1β能够引起内皮细胞的氧化应激及炎症反应,这种由NLRP3炎性小体介导的氧化应激及炎性反应,又会进一步增加DAMPs的释放,进而形成不良循环。
中药材丹参常用于预防和治疗心血管疾病,其味苦,微寒,具有活血祛瘀,凉血消痈功效,如《本经》言其有主治“心腹邪气……破癥除瘕”作用。其水溶性酚类化合物Sal A被证实有抗AS、抗炎作用[12-15],但尚无其通过氧化应激调控NLRP3炎性小体的表达作用于血管内皮细胞的研究,因此本实验探究了推测Sal A的抗氧化应激及抗炎作用,证明了其对氧化应激反应及炎性小体的抑制作用,为中医药治疗AS提供了科学依据。但炎性小体对AS的作用机制复杂,Sal A是否通过其他信号通路作用于炎性小体及其抗AS的作用具体机制仍需进一步研究。

