按照损伤控制原则改进ALPPS手术的可行性及效果*
孔亚林 李捷 孔令红 赵刚 王成 赵静 何晓军 韩旭 刘承利
(1.空军军医大学附属空军特色医学中心肝胆外科,北京 100142;2.淄博市中心医院肝胆外科,山东 淄博 255036)
根治性切除是唯一明确可以治愈肝脏恶性肿瘤的方法,但由于残肝不足的可能性,根治性切除手术受到了严重制约[1-2]。联合肝脏离断和门静脉结扎的分期肝脏切除术(Associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)可以诱导残余肝脏体积加速生长,拓宽了根治性切除的适应证,降低了术后肝功能衰竭的风险[3-4]。然而,由于围术期高死亡率和并发症高发生率,ALPPS一直伴随着巨大争议。从2015年以来,由空军军医大学附属空军特色医学中心(原空军总医院)联合淄博中心医院共同制定并实施了ALPPS风险控制策略,取得了理想的效果。本研究回顾性分析了近5年施行损伤控制性ALPPS手术的经验,目的是阐明ALPPS在治疗复杂肝脏恶性肿瘤中的作用。
1 资料与方法
1.1 一般资料 回顾性分析2015年3月1日~2020年2月29日期间在空军特色医学中心(原空军总医院)和淄博中心医院合作进行损伤控制性ALPPS手术患者65例的临床资料。患者根据临床表现、实验室检查及影像学检查明确诊断,并经病理证实。本研究中的每位患者都自行做出最终选择并签署知情同意书。
1.2 纳入及排除标准 除常规术前评估外,将Child-Pugh肝功能分级联合终末期肝病评分系统用于术前肝功能评估。C级肝功能或MELD评分超过24分的患者均被排除。ALPPS手术对残余肝脏体积要求:①正常肝脏情况下,残余肝脏体积/标准肝脏体积<30%。②异常肝脏情况下,残余肝脏体积/标准肝脏体积<40%。③结直肠癌肝转移未行肝脏灌注化疗时残余肝脏体积/标准肝脏体积<20%,或者行肝脏灌注化疗后 残余肝脏体积/标准肝脏体积<30%。此外,对残余肝脏体积还要求:①正常肝脏情况下残余肝脏体积/体重<0.5%。②异常肝脏情况下残余肝脏体积/体重<0.8%。每例患者均行肝脏活检及病理检查,并根据NASH CRN评分系统评估肝脏状况[5-6]:F0=无纤维化;F1=窦周或汇管区周围纤维化;F2=窦周和汇管区周围纤维化;F3=桥接纤维化;F4=肝硬化。异常肝脏定义为F≥2。最后,联合吲哚菁绿血浆代谢率检验,将ALPPS的纳入标准设定为[(残余肝脏体积/标准肝脏体积)×吲哚菁绿血浆代谢率]<5%[7-8]。术前测定功能性残肝体积,并与影像学计算的理论残肝体积进行对比。排除标准:①残肝上存在不可切除的肿瘤病灶。②肝外存在不可切除的肿瘤病灶。③肝硬化合并严重的门脉高压。④无法达到R0切除的肝脏恶性肿瘤。⑤患者对麻醉或手术不能耐受。手术并发症按照Clavien-Dindo分级方法, IIIb级以上确定为严重并发症[2,9-10]。
1.3 术前残肝体积的精准评估及手术规划 按照Stevenson公式和Urata公式计算体表面积及标准肝脏体积,利用64排螺旋CT为基础的三维成像重建计算剩余肝脏体积[5]。通过3D处理软件进行分析,采用区域生成法对肝脏、肿瘤、胰腺和脾脏进行三维重建,获取额肿瘤与周围毗邻信息,遵循R0切除原则进行模拟手术。术前根据程氏标准、Michel标准和Nakamura标准对门静脉、肝动脉、肝静脉的解剖及变异进行精确评估,以实现肿瘤的完整切除[6]。利用内置软件对肝脏三维模型进行分割和模拟手术,计算肝脏和肿瘤体积、切除肝脏体积以及剩余肝脏体积。
1.4 ALPPS的手术步骤 采用微波消融辅助下经腹腔镜肝脏实质原位分离方法进行一期手术。前入路方式于近肝门处Glisson's鞘内分别解剖肝右动脉、门静脉和胆管,建立肝后隧道后利用弹力带悬吊肝脏,利用微波消融装置 (Habib 4X, RITA 4401L, Angio Dynamics Inc,美国)在腹腔镜超声(EUP-OL334, ALOKA,日本)引导下行肝实质分离。对于拟行右半肝切除的患者,仅结扎门静脉右侧,肝实质沿正中裂右侧向肝中静脉右侧切开;对于联合S4段切除的患者,在左侧门静脉脐部右侧切开肝脏实质,保留S1段门静脉蒂;对于联合S1段切除的患者,肝中静脉左侧切开肝脏实质并向静脉导管延伸,保留尾状门脉蒂;对于计划行右侧肝脏楔形切除术的患者,肝实质的断面略偏向于右侧门脉分支主干的右侧,并结扎右侧门脉段间分支而保留门脉蒂[7]。手术规划(见图1)。Habib 4X的工作功率设定为70~80瓦,每个点的消融时间为3~6分钟,点对点距离为2.5~3cm,深度刚好到达弹力悬吊带的前壁。以0号可吸收线(PDS)作为肝右动脉、右胆管和肝后隧道的标记。二期手术采用开放式手术方法。采用沿右肋缘下反L形切口,入腹后离断肝右动脉和右侧胆管,将标记为肝后隧道的PDS线提起后沿分界线行肝部分切除术,切除一期术后萎缩的肝叶。
1.5 一期术后肝脏体积及功能性肝脏体积的测算 一期术后第7天开始行CT检查计算残肝体积,每隔6~8天重复一次,直到残肝体积及残肝体积/体重达到进行二期手术的安全标准。计算动力学生长速率(KGR),即初始体积评估时的肝脏增生程度除以一期手术后的周数[8]。ALPPS术前及一期手术后1周,使用Symbia T16扫描仪(德国西门子),以肌醇-6-磷酸酯钠作为显影剂进行SPECT检查评估功能性残肝体积。
1.6 术后随访 患者出院后每4~6周例行随访一次,直至患者死亡或研究结束。记录患者的病史、体格检查和实验室检查结果。
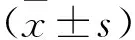
2 结果
2.1 患者一般资料 65例患者符合ALPPS纳入标准,其中60例患者完成了损伤控制性ALPPS手术。其中位年龄27~61岁,男52例,女8例;肝癌44例,肝内胆管癌3例,结直肠癌肝转移13例;乙肝病毒感染45例;肿瘤大小约8.2~18.6cm3;肿瘤数目1~5个;肿瘤分布右肝叶47例,右肝叶+S1 5例,右肝叶+S4 8例;Child-Pugh分级A 53例,B 7例,C 0例。MELD评分11.7(3~17)。术前治疗:TACE 17例,静脉化疗 9例,靶向药物 3例,联合治疗12例。5例未能完成ALPPS的患者中,3例因术中发现对侧肝脏多发转移病灶未能完成Ⅰ期手术;2例患者按照损伤控制原则完成Ⅰ期手术,但因各种非临床原因拒绝行Ⅱ期手术。

图1 一期手术中的消融横断线
2.2 一期手术情况及并发症 一期手术后常规给予药物保肝治疗后 5~7天肝功可恢复正常。平均手术时间156.8 min,平均出血量为165 mL。3例结直肠癌肝转移患者在Ⅰ期术中发现保留侧肝脏孤立性转移癌,予以行术中微波消融治疗,术中超声评估治疗效果满意。34例患者出现各种并发症,但无严重或危及生命的并发症。7例患者因低蛋白血症导致腹水或凝血异常行输血浆治疗。9例患者发生感染,表现为术后高热、白细胞计数升高,其中6例经CT诊断为胆漏,采用超声引导下经皮穿刺引流术治疗后缓解,Clavien-Dindo分级为Ⅲa级。另外3例感染患者因为合并低白蛋白血症和食欲差而给予肠外营养治疗3~5天后缓解,连同接受输血浆治疗的7名患者,这10例患者按照Clavien-Dindo分级确定为Ⅱ级。2例患者因低蛋白血症及腹水形成发生腹壁疝,给予局麻下行疝修补术及输注白蛋白治疗,Clavien-Dindo分级为Ⅲa级。见表1。

表1 ALPPS 一期术后的结果
2.3 术后残肝体积的代偿性增生 术前残肝体积为(388.6±122.5)cm3,残肝体积/标准肝脏体积为(33.2±8.6)%,残肝体积/体重为(0.78±0.14)%。两次手术的间隔时间为(16.4±5.7)d(中位17.6 d,范围12~26 d)。二期手术前残肝体积为(567.9±132.3)cm3, 残肝体积/标准肝脏体积为(51.6±12.7)%,残肝体积/体重为(0.94±0.22)%。增大体积为(179.3±72.4)cm3,增大比为(45.7±22.9)%。KGR为(13.2±7.6)cm3/d。ALPPS前的平均功能性残肝比为34.7%,与术前相似。一期术后一周的平均功能性残肝比为45.8%,与CT计算值相似(47.2%,P=0.376)。
2.4 二期手术情况及并发症 15例患者行扩大的右侧肝脏楔形切除术,32例患者行右半肝切除术,8例患者行联合S4段切除,5例患者行联合S1段切除术。平均手术时间为305.3 min,平均出血量为628 mL。术后住院时间为(23.4±7.4) d。56例患者(93.3%)接受输血治疗,其中5例患者仅行输血浆治疗,平均输血浆8 u(3 u~12 u);51例患者同时接受输红细胞治疗,其中13例患者术中及术后均输注红细胞, 43例患者仅术后输红细胞,平均输红细胞6 u(2 u~14 u)。3例患者因为低蛋白血症和严重腹水发生伤口裂开,行全麻下的急诊减张缝合后好转(Ⅲb级)。5例患者发生急性呼吸窘迫综合征(ARDS)、急性左心衰竭、或急性肝衰竭(Ⅳa级),2例发生多器官功能障碍综合征(MODS,Ⅳb级),经重症监护室治疗后好转。Ⅱ期术后并发症及分级,见表2。

表2 ALPPS二期术后并发症情况及分级
2.5 随访情况 60例患者均完成系统随访,随访时间为(20.0±2.1)月。截至本研究统计结束,21例患者(35.0%)仍存活。总体中位生存时间为22.4(3.2~31.4)月。6例肝细胞肝癌患者术后6个月因肺转移或脑转移死亡,2例结直肠癌肝转移患者术后12个月因脑血管意外死亡,其余31例均死于肿瘤复发。3例一期术中行保留侧肝脏孤立性转移癌微波消融的结直肠癌肝转移患者,ALPPS术后均行静脉化疗联合西妥昔辅助治疗,其余结直肠癌肝转移患者ALPPS术后未再行系统性辅助治疗。结直肠癌肝转移患者中位生存时间为27.8(7.5~31.4)月,较原发性肝脏恶性肿瘤患者的中位生存时间14.2 (3.2~24.8)月显著延长(P<0.05)。
3 讨论
尽管根治性切除手术仍是肝脏恶性肿瘤的最佳治疗方法,但考虑到残肝体积不足以维持正常肝功能或者没有诱导肝脏快速增生的可靠方法,根治性切除手术受到了很大的限制[1,3,10-11]。目前常用的方法如TACE、门静脉栓塞(PVE)、门静脉结扎(PVL)至少需要4~8周才能使残肝体积增长20%~40%,很多患者在此过程中可能会因为肿瘤广泛转移而失去根治性切除的机会,只有不到10%的患者能够获得根治性切除机会。ALPPS已经被证明为是一种有效的快速增加残肝体积的根治性肝癌切除方法,手术间隔平均12.3 d,较PVE、PVL显著缩短,从而提高了肝脏恶性肿瘤的手术切除率[12]。由于早期的ALPPS一期手术多采用开放手术完成右门静脉结扎和肝实质离断,术中产生两个较大的肝断面,并发症发生率增加了一倍,同时腹腔内的广泛粘连使二期手术难以实施。一期手术中大出血或反复的肝门阻断对肝功能影响显著,尤其是对肝硬化患者,导致手术间隔时间延长,从而限制了ALPPS的推广[13-16]。降低ALPPS的并发症发病率和死亡率的关键在于快速提高一期手术后残肝体积的生长速度、同时尽量减少手术创伤,这一观念已成为广泛共识[17]。本研究中,我们采用风险控制策略对ALPPS进行改进,在不同程度肝损害的患者中取得了较为理想的效果。
本研究没有刻意排除肝硬化患者,而是注重术前对肝功能的评估。一方面结合Child-Pugh和MELD评分排除ALPPS的禁忌症患者,并使用残肝体积/标准肝脏体积、残肝体积/体重指数作为ALPPS的客观适应症指标;另一方面,利用功能残肝体积和I吲哚菁绿血浆代谢率准确评估剩余肝脏功能,适当扩大了ALPPS的适应症。因此,部分Child-Pugh分级为B级肝损害的巨大肝癌患者也成功的施行了ALPPS,减少了术后肝衰的发生。通过三维重建,精细的肝脏解剖结构和肝内血管系统得以呈现,并准确测量肿瘤之间的距离以及二级或三级肝动脉、门静脉分支的距离,从而确定手术切除范围,确保肝脏静脉流出道的安全[18]。
既往研究[19-20]发现,50%~80%的肝脏实质部分离断也可以达到相近的肝脏增生效果。基于这一理论,在一期手术中用微波消融代替完全肝脏离断,在腹腔镜下术中超声的引导下,健侧与患侧肝叶之间形成无血区,避免了肝断面的形成,降低了胆漏和失血的发生率,为二期手术提供了理想条件。一期手术时间缩短,出血量少,无严重并发症的发生和术中输血。本研究发现,二期手术前残肝体积/标准肝脏体积的平均比值、残肝平均增加值以及平均增加比例虽然略低于一些研究,但功能性残肝体积的增加明显,可以确保二期手术的安全。文献报道的ALPPS术后并发症发生率和死亡率分别为16%~64%和12%~23%,但其中大部分患者并没有合并肝硬化。本研究中2/3的患者为HBV相关性肝硬化,其中7例为B级肝功状态,均顺利完成手术,无围术期死亡,其关键在于避免了胆漏合并严重感染的发生。本组患者的中位生存时间为22.0个月,与文献报道相似,但考虑到肝脏肿瘤的临床分期和肝硬化因素,可以认为ALPPS的损伤控制策略具有良好的长期效果。有研究[21]认为一期手术持续时间和术中输红细胞是ALPPS相关风险的独立危险因素,本研究采用的腹腔镜微创手术和原位肝实质部分离断方法减少了术中出血,减少了术中对肿瘤的挤压,并通过肝组织的凝固性坏死避免了术中肿瘤转移,有效的提高了手术效果。
4 结论
损伤控制策略下的ALPPS手术方式能够有效降低手术风险,提高肝脏恶性肿瘤的根治性手术切除率,并逐步成为治疗复杂肝脏恶性肿瘤的可靠手术方式。

