EPAS-1在透明细胞性肾细胞癌中的表达及意义*
陈海滨 王立姣 赵鹏 赵建军 谭超
(河北工程大学附属医院 1.泌尿外二科;2.呼吸内二科;3.胸外科,河北 邯郸 056004)
透明细胞性肾细胞癌临床常见[1-2],尽管治疗手段取得了重要的进步,但其5年生存率仍然较低[3-4]。基因的异常表达是肾肿瘤发生和进展的重要分子遗传因素[5-6]。近年学者发现内皮PAS结构域包含蛋白-1(EPAS-1)与肿瘤的形成有关。EPAS-1又称低氧诱导因子2α(HIF-2α),是1997年克隆出的含有HLH-PAS的蛋白,是缺氧的主要转录因子,在低氧时引起酶或基因变化发挥促进肿瘤进展的作用[7]。EPAS-1主要在低氧区域诱导癌基因表达、调节细胞异型增生促进血管新生,主要是为适应细胞微环境中的低氧状态[8]。目前EPAS-1在透明细胞性肾细胞癌中的研究鲜少,其与细胞增殖的关系尚需要阐明。
1 资料与方法
1.1 一般资料 收集2017年1月~2017年7月在我院确诊为透明细胞性肾细胞癌并行手术治疗的患者78例。其中男40例,女38例,年龄43~85岁,中位年龄60岁。肿瘤最大径(0.6~9.5)cm,平均(4.3±1.1)cm;分级(Fuhrman):Ⅰ级9例,Ⅱ级34例,Ⅲ级29例,IV级6例;其中30例伴有肾窦累犯,48例无肾窦累犯。均留取术后新鲜的肿瘤组织作为观察组,留取距肿瘤标本肉眼可见的边缘>3 cm的正常肾组织作为对照组,样本均于-80℃冰箱中冻存。纳入标准:①首次发病并手术治疗,术后病理为透明细胞性肾细胞癌,并符合WHO中的标准及分型。②临床及随访资料完整。排除标准:①诊断不明确或病理形态中伴有异源性上皮或间叶分化的肿瘤。②术前行放、化疗。③伴有其它器官严重的内科系统疾病。患者或家属签定知情同意书,研究符合《赫尔辛基宣言》中的相关要求,并经医院伦理委员会批准。
1.2 实验材料 选择人肾透明细胞癌786-0细胞系和人肾皮质近曲小管上皮HK-2细胞系,购自中国科学院上海细胞库。培养基PRMI1640及胎牛血清购自Gibco公司;ECL显色液购自Thermo公司;EPAS-1、GAPDH、PCNA、二抗和DAB购自苏州睿赢生物技术公司;CCK-8试剂盒购自上海碧云天生物公司;RIPA裂解液、胰酶消化液、质粒提取试剂盒、二抗及DAB购自武汉三鹰生物公司;载体和引物均由苏州吉玛基因生物公司合成,酶标仪为Thermo公司生产的MK3,PCR仪为美国Bio Rad IQ5。
1.3 方法
1.3.1 细胞的构建和培养 液氮中取出人肾透明细胞癌786-0细胞系和人肾皮质近曲小管上皮HK-2细胞系,冰上复苏,应用10%胎牛血清RPMI 1640培养基,在37℃、5%的CO2浓度的孵育箱中进行培养。当细胞生长融合度至80%左右时,进行细胞传代,调整细胞浓度为5×105个/mL接种于12孔板中,每孔1 mL。选择人肾透明细胞癌786-0细胞系,设计小干扰RNA EPAS-1质粒并构建质脂体载体转染建立小干扰RNA EPAS-1组(siRNA EPAS-1组),并设立786-0细胞系的空白对照组(NC组)。
1.3.2 实时荧光定量PCR实验 应用实时荧光定量PCR(RT-PCR)法检测EPAS-1 mRNA的表达。Trizol提取总RNA后应用 Nanodrop2000微量紫外分光光度计测量提取的总RNA浓度和纯度。引物序列:上游:TACGTGTGCCCGGTTACGTCGACCG,下游:TCGGGTTAAAGGCCAGATAGTAGAG。以RNU6B为内参基因,引物序列:上游:TCGTGATA GTGATGATCCAGCCA,下游:CGTAGTAGTAC AGATAGTAGATGA。逆转录合成cDNA,反应条件:16℃ 30 min;42℃ 30 min,85℃ 5 min后,4℃恒温。实时荧光定量PCR反应条件:95℃ 10 min;95℃ 15 s,60℃ 1min,30个循环后进行延伸。读取Ct值,以2-ΔΔCt法表示结果,以RQ进行定量分析。
1.3.3 免疫组化实验 应用免疫组化SP法检测组织中EPAS-1和PCNA蛋白的表达。切取4 μm切片,严格按实验步骤加入一抗和二抗后行DAB显色。操作由同一主管技师完成,做好质控工作,减少人为误差。EPAS-1的显色部位是细胞质和(或)细胞膜,以黄色-棕褐色为阳性。以二维评分法进行定量(着色强度和阳性率)。着色强度:无着色为0分,弱为1分,中为2分,强为3分。阳性率:选择5个高倍(400倍)视野进行观察,取平均值,阳性率<5%为0分,5%~10%为1分,以11%~25%为2分,以26%~50%为3分,以>50%为4分[9-10]。二者相乘为最终评分,总分范围0~12分。以≤3分为阴性,以>3分为阳性。计算阳性率。PCNA的表达部位是细胞核,以黄色--棕褐色为阳性,选择热点区进行观察,共选择5个高倍(400倍)视野计算阳性率,取平均值,其阳性率即为增殖指数。
1.3.4 Western Blot实验 应用Western Blot法检测EPAS-1和PCNA的表达。以GAPDH为对照,基于新鲜组织,提取总蛋白,BAC法行蛋白浓度测定,SDS-PAGE凝胶配置后上样、电泳、转膜、封闭,严格按照说明书进行操作。利用Odessey红外荧光成像仪扫描PVDF膜,以GAPDH为对照,分析灰度值,进行结果分析。
1.4 术后随访 患者均进行术后3年生存时间的随访,截止时间点为2020年7月31日。
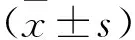
2 结果
2.1 两组中EPAS-1表达阳性率的比较 观察组中EPAS-1的阳性率高于对照组(P<0.05),见表1、图1。

表1 两组中EPAS-1表达阳性率的比较[n(×10-2)]

图1 EPAS-1的表达(IHC SP法)
2.2 EPAS-1在观察组不同临床病理特征中表达阳性率的比较 EPAS-1的阳性率在不同Fuhrman分级、肿瘤最大径及PCNA增殖指数的表达中差异有统计学意义(P<0.05);而在有无肾窦累犯、不同性别及年龄分组的表达中差异无统计学意义(P>0.05)。见表2、图2。

表2 EPAS-1在观察组不同临床病理特征中表达阳性率的比较[n(×10-2)]

图2 肿瘤中PCNA的表达(400×)
2.3 观察组中EPAS-1的表达与生存时间的相关性 随访截止发现存活49例,死亡28例(其中1例因脑出血死亡,1例为意外死亡,均计为删失值),失访1例。应用K-M生存分析显示EPAS-1的表达与生存时间有关(2=4.0213,P=0.0210)。见图3。

图3 EPAS-1表达的生存分析
2.4 人肾透明细胞癌786-0细胞系和人肾皮质近曲小管上皮HK-2细胞系中EPAS-1蛋白和mRNA的表达比较 Western Blot结果显示人肾透明细胞癌786-0细胞系中EPAS-1蛋白的表达明显高于人肾皮质近曲小管上皮HK-2细胞系(P<0.05);RT-PCR结果显示人肾透明细胞癌786-0细胞系中EPAS-1 mRNA的表达明显高于人肾皮质近曲小管上皮HK-2细胞系(P<0.05)。见表3、图4、图5。

表3 两组细胞系中EPAS-1蛋白和mRNA表达的比较

图4 EPAS-1蛋白的表达
2.5 人肾透明细胞癌786-0细胞系的siRNA EPAS-1组和NC组中PCNA蛋白和mRNA的表达比较 Western Blot结果显示,siRNA EPAS-1组中PCNA蛋白的表达明显低于NC组(P<0.05);RT-PCR结果显示siRNA EPAS-1组中PCNA mRNA的表达明显低于NC组(P<0.05)。见表4、图6、图7。

表4 siRNA EPAS-1组和NC组中PCNA蛋白和mRNA的表达比较

图6 siRNA EPAS-1组和NC组中PCNA蛋白的表达

图7 PCNA mRNA的表达
3 讨论
透明细胞性肾细胞癌病变形成与基因和遗传因素有关[11]。EPAS-1是从小鼠下丘脑细胞和HeLa细胞中克隆出的全长cDNA序列[12],其开放阅读框2607bp,编码869个氨基酸,分子量为96.5kDa[13-14]。EPAS-1的基因定位于染色体的2p16-21,共有15个外显子、14个内含子[15],5′-端与AHR基因的内含子具有高度保守性,3′-端只有1个内含子[16]。EPAS-1与家族的同一成员HIF-1α具有相似的生化和转录活性。研究显示在缺氧条件下,两种蛋白质均能快速增多,而氧恢复后均快速下降[17]。同时抗氧化剂(NMPG)、蛋白酶体抑制剂等的处理也能引起细胞内两种蛋白的增加,而H2O2能引起两者表达的下降[18-19]。EPAS-1与HIF-1α的不同点表现为两种蛋白质含量不一样,一般来说,肿瘤细胞内EPAS-1含量较高,而HIF-1α主要表达在间质细胞和组织细胞内。EPAS-1和HIF-1α调控下游因子可能不同,EPAS-1主要是调控PCNA介导的细胞增殖,表现为肿瘤细胞增殖的特性,而HIF-1α主要是调控VEGF介导的血管生成,表现为间质的支持作用。EPAS-1对肿瘤相关巨噬细胞介导的作用不如HIF-1α的作用强[20]。
本研究结果显示,透明细胞性肾细胞癌中EPAS-1的表达明显高于正常肾组织,人肾透明细胞癌786-0细胞系中EPAS-1蛋白和mRNA的表达明显高于人肾皮质近曲小管上皮HK-2细胞系,提示EPAS-1高表达是肿瘤形成的重要促进因素,即EPAS-1具有癌基因样的作用。且EPAS-1表达的阳性率在不同肿瘤最大径及PCNA增殖指数的表达中差异有统计学意义,siRNA EPAS-1组中PCNA蛋白和mRNA的表达明显低于人肾透明细胞癌786-0细胞系,提示EPAS-1高表达是肿瘤细胞增殖的重要促进因子,抑制EPAS-1的表达能减弱肿瘤细胞的增殖,提示EPAS-1参与肿瘤细胞的分裂增生及肿瘤生长。结果显示EPAS-1的表达与肿瘤的Fuhrman分级相关,由于Fuhrman分级与肿瘤进展及预后相关,因此EPAS-1表达升高是肿瘤进展及不良预后的重要指标,实验观察到EPAS-1的表达与生存时间有关,也进一步明确了EPAS-1与预后的关系。但是EPAS-1对预后的具体判断价值尚需要进行多中心、多因素及大样本分析后进一步明确。EPAS-1的异常表达对mRNA转录、翻译均有重要的调节作用,并能调控核质的运输,引起细胞增殖及肿瘤细胞的转化[21]。EPAS-1在发挥功能时也常受很多因素的影响,如应激反应、细胞微环境的改变等。也有研究认为EPAS-1是诱导癌基因形成的因子之一,对细胞的浸润性生长有重要促进作用[22]。EPAS-1能与AHR相互作用,与缺氧反应元件(5′-TACGTGCG-3′)结合,上调缺氧因子的表达。蛋白酶体的抑制剂能引起细胞内EPAS-1的活性改变,可以消除细胞内活性氧改变,使EPAS-1的表达升高[23-24]。EPAS-1也具有肿瘤血管生成的促进作用,肿瘤进展过程中的缺氧环境能使EPAS-1的转录活性增强,促进肿瘤的侵袭和转移[25]。EPAS-1可提高其下游糖酵解酶基因的表达,影响肿瘤的失控性增殖和能量代谢[26]。
4 结论
EPAS-1在肾透明细胞癌中表达升高,在不同临床病理特征中的表达有差别。EPAS-1可能对肿瘤细胞增殖有一定促进作用。检测EPAS-1的表达可能与肿瘤的预后有关。

