TGF-β1通过JAK2/STAT3信号对胃癌细胞侵袭和转移的影响*
王卉卉 张炜宇 李爱英 刘颖
(1.南京市江宁医院肿瘤内科,江苏 南京 211100;2.东南大学附属中大医院普外科,江苏 南京 210009)
胃癌作为一种早期症状不明确的恶性肿瘤,患者在治疗后还会有复发和转移的风险,也是造成死亡的主要因素,大多数情况下都是在50~60岁之间发生[1-2]。胃癌患者患病初期不具有明显症状,病情处于潜伏期时,患者为对身体的微小反应未重视,以至于失去诊断的最佳时期,发现时通常已经处于发展状态,开始向周围组织转移[3]。胃癌临床治疗基于外科,通过化学疗法、放射疗法、生物学疗法等综合治疗来进行辅助,但效果不理想易复发[4]。近几年研究表明,作为调节细胞增殖及分化的重要因素,胃癌的浸润及转移受到TGF-β1的表达的间接影响。TGF-β1参与了许多生理学和病理学过程,可引起细胞外矩阵和基底膜的分解,从而促进癌细胞的转移和迁徙能力[5-6]。JAK2/STAT3信号传输路径与血液肿瘤、乳腺癌、前列腺癌等恶性肿瘤的病因有关,JAK2/STAT3信号传递路径异常活跃,抑制这一通路将成为肿瘤治疗的新目标[7-8]。STAT3在恶性肿瘤中主要表现为持续的酪氨酸氧化状态,下游靶基因失调由STAT3过度活化造成,引起不被控制的细胞增殖,阻碍肿瘤细胞的凋亡[9]。癌细胞增值肿瘤微血管生成,参与肿瘤的免疫回避,并抑制免疫功能,致使癌细胞侵袭、转移致其他脏器。本研究探讨TGF-β1通过JAK2/STAT3信号对胃癌细胞侵袭和转移的影响,现将结果报告如下。
1 材料与方法
1.1 主要试剂和仪器 Trizol试剂(浙江AMEKO),逆转录试剂盒(武汉赛维尔),RT-PCR试剂盒、流式细胞(上海优予,BCA蛋白浓度测定试剂盒、RPMI-1640培养基(上海一研)。
1.2 细胞处理及分组 准备含10%牛胎血清的RPMI-1640培养基,向培养基中加入处理后的BGC-823细胞和1%氰基链霉素,2~3 d的传代培养,在37℃,CO25%的条件下培养,细胞生长至80%~90%,离心5 min,调整细胞浓度1×104/ mL,24 h后按1∶5接种到培养瓶。弃去培养基,加入由10%FBS/F12配制成的0 μg/L(0 μg/L组)、1.0 μg/L(1.0 μg/L组)、10 μg/L(10 μg/L组)、50 μg/L(50 μg/L组)四种浓度的 TGF-β1反应12 h。
1.3 细胞形态学观察 选择不同浓度TGF-β1处理后的BGC-823细胞,做成细胞涂抹标本,二甲苯脱蜡时间15 min,用乙醇驼色,用苏木素-伊红(HE)染色,染色后乙醇脱水,每张涂片随机选择视野,置于显微镜(400×)下观察BGC-823细胞形态。
1.4 RT-PCR法检测细胞中JAK2/STAT3的表达 Trizol法提取经过处理的BGC-823细胞的总RNA,将提取出的总RNA 反转录成 cDNA,此过程遵照说明书进行,用DNA荧光染料SYBR GreenⅠ对JAK2/STAT3表达水平进行检测,内参为β-actin。在60℃环境下10 min、95℃ 和720℃环境下各 30 s、95℃环境下5 min,循环次数以40为准,实验次数至少3次,取基因相对表达量进行分析,引物序列,见表1。

表1 PCR引物序列
1.5 Westernblot检测细胞中JAK2/STAT3蛋白 裂解经过处理的BGC-823细胞,提取组织中的总蛋白质浓度,用100 V SDS-PAGE电泳总蛋白质,用Bradford法定量蛋白质样本,转印到PVDF膜上,10%山羊血清封闭0.5 h。4℃一抗过夜孵育,二抗室温孵育1 h,室温洗膜3次,GAPDH做内参,用Quantity one 4.0软件分析JAK2/STAT3蛋白表达。
1.6 流式细胞术检测BGC-823调亡情况 将TGF-β1梳理后的BGC-823细胞置入孔板中进行培养,浓度为2×106细胞/ mL,培养时间为24 h,培养完成后采用0.25%胰蛋白酶进行消化,再用70%乙醇固定,4℃环境下静置1 d,离心5 min,弃去上清液,用PBS洗涤5 min,重复三次,室温37℃,避开光照进行染色,时长30 min,用流式细胞仪分析细胞凋亡程度。
1.7 细胞克隆测定BGC-823细胞存活率 不同浓度TGF-β1处理的细胞种植到含 10 mL 培养液的培养皿中,37℃环境下培养,孵育 14 d 细胞克隆成功,用 4% 多聚甲醛固定细胞15 min,加入结晶紫染色液,染色时长 20 min,计数细胞克隆数,对各组细胞存活率进行计算。[克隆形成率(%)=(形成的细胞克隆数/接种细胞数)×100%]
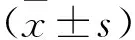
2 结果
2.1 HE染色 0 μg/L组中,细胞核呈椭圆形,形状规则,且细胞排列松散,随着TGF-β1浓度增加,细胞开始逐渐增多,细胞多为圆形,多个细胞聚集,出现巨核细胞或多核细胞,50 μg/L组与其他组相比细胞数量最多(P<0.05),见图1。

图1 HE染色结果
2.2 BGC-823细胞中JAK2与STAT3的表达情况 RT-PCR法用于检测经0、1.0 、10、50 μg/L的TGF-β1处理后细胞中JAK2与STAT3的表达水平,发现0 μg/L组JAK2、STAT3表达最低,随着TGF-β1的浓度增加JAK2、STAT3表达也增加,JAK2依次为0.618±0.114、0.637±0.177、0.919±0.351、1.268±0.278,STAT3依次为0.624±0.121、0.647±0.162、0.981±0.174、1.297±0.264(均P<0.05),见图2。

图2 各组细胞胃癌JAK2与STAT3mRNA的表达情况
2.3 JAK2与STAT3蛋白表达 0 μg/L组JAK2与STAT3蛋白表达最低(P<0.05),50 μg/L组JAK2与STAT3蛋白表达最高(P<0.05),随着TGF-β1浓度增加JAK2与STAT3蛋白也明显上升,蛋白表达与浓度成正比(均P<0.05),见图3。

图3 各组细胞胃癌JAK2与STAT3蛋白的表达情况
2.4 BGC-823细胞凋亡变化 流式细胞术检测发现经不同浓度TGF-β1处理后,0μg/L组细胞凋亡最多,50μg/L组细胞凋亡最少,随浓度增加依次减少,凋亡率分别为2.48±0.21、2.31±0.19±0.11、0.818±0.08(均P<0.05),见图4。

图4 BGC-823细胞凋亡变化
2.5 细胞克隆测定细胞BGC-823细胞的克隆能力 细胞克隆实验检测发现在0 μg/L组BGC-823的单克隆群数最少(P<0.05),而50 μg/L组细胞单克隆群数显著增加(P<0.05),随着TGF-β1浓度增加BGC-823单克隆形成率有上升趋势(均P<0.05),见图5。

图5 BGC-823细胞的克隆能力
3 讨论
胃癌是常见的临床消化系统肿瘤,近年来发病率有所下降,但发病率和死亡率依然占世界全身性恶性肿瘤的8%和10%[1]。胃癌的早期诊断能减缓病情进展,加之有效的治疗方法也是改善患者预后的重要手段,据统计,早期胃癌如果能得到针对性治疗,可将患者5年生存率提升至90%或以上[11]。但即使是发达国家,被确诊的患者50%以上都进入了疾病发展期,手术完全消除病变和转移的可能性在50%以下[12]。胃癌的病因是相当复杂的病理学过程,包括多个基因和分子信号传输路径,与胃癌有关的许多因子被发现了,但对胃癌的目标疗法起决定性的作用并不多[13]。根据病因和目标疗法的研究基础。JAK2/STAT3信号通路和TGF -β1以及一些炎症关联因子慢慢地被用于胃癌的治疗[14]。
通过观察HE染色、细胞凋亡变化、克隆能力发现0 μg/L组细胞核呈椭圆形,形状较规则,细胞排列松散,随着TGF-β1浓度增加,细胞开始逐渐增多,呈圆形型排列紧密,多个细胞聚集,有巨核细胞或多核细胞出现,50 μg/L组与其他组相比细胞数量最多。流式细胞术检测发现经不同浓度TGF-β1处理后,0 μg/L组细胞凋亡最多,50 μg/L组细胞凋亡最少,随浓度增加依次减少,细胞克隆实验检测发现在0 μg/L组BGC-823的单克隆群数最少,而50 μg/L组细胞单克隆群数显著增加,随着TGF-β1浓度增加BGC-823单克隆形成率有上升趋势。研究显示,TGF -β1是具有25 kd分子量的二本链多肽,可促进细胞增殖,调节细胞分化,并且促进细胞外矩阵合成的作用[15]。有研究表明,TGF -β1在很多的肿瘤中出现过表达,并且在肿瘤细胞的EMT进行的诱导中发挥重要的作用,TGF-β1活性得到抑制可使肿瘤体积减少[16]。有研究显示,TGF-β1及其关联TGF-β信号传输路径,在胰脏癌等其他恶性肿瘤的发张过程中也有TGF-β1参与[17],国内外的多的研究显示,TGF-β1/ 2可作为恶性肿瘤的预后指标使用[18]。相关研究显示,TGF-β1的负调节可以对向肿瘤关联成纤维细胞的分化产生抑制作用,并且可以阻碍肿瘤增生的微小环境的形成[19],这与本文研究相符。
通过检测JAK2/STAT3表达情况和蛋白变化发现,RT-PCR法用于检测经0、1.0、10、50 μg/L的TGF-β1处理后细胞中JAK2与STAT3的表达水平,发现0 μg/L组JAK2、STAT3表达最低,随着TGF-β1的浓度增加JAK2、STAT3表达也增加。Westernblot检测结果显示0 μg/L组JAK2与STAT3蛋白表达最低,50 μg/L组JAK2与STAT3蛋白表达最高,随着TGF-β1浓度增加JAK2与STAT3蛋白也明显上升,蛋白表达与浓度成正比。有研究证实,STAT3蛋白是一种异常活跃的转录因子[20],通过与JAK2激酶反应增加活性使自己磷酸化,特定靶基因因受到磷酸化的STAT3影响,开始转录功能,并诱导相关蛋白,影响细胞增殖、分化和凋亡[21-22]。有研究显示,JAK2 / STAT3是VEGF基因的直接转录活性化因子,根据p53的作用机制调节HIF-1活性[23]。有研究显示,JAK2/STAT3可以促进肿瘤细胞VEGF的形成,促进血管新生血管内皮细胞游走和细胞管结构的形成。
4 结论
本研究结果显示,TGF-β1通过活化JAK2/STAT3信号传输路径,可增强胃癌细胞的浸润和转移。

