白果内酯标准样品的研制
付瑞明,胡金春,孟兆青,李强,曹桂云,王岱杰,闫慧娇*
(1.齐鲁工业大学(山东省科学院) 山东省分析测试中心 山东省大型精密仪器分析应用技术重点实验室, 山东 济南 250014;2.山东宏济堂制药集团股份有限公司,山东 济南 250000)
标准样品作为均匀的、确定了特性值的材料或物质[1],在仪器校准、分析检测和质量控制中必不可少。随着中医药的国际化,其生产及科研工作中都急需与ISO对接的标准样品,而我国研发的中药标准样品难以满足相关行业的发展需要[2],研制具备量值传递功能且可溯源的有证国家标准样品具有重要的现实意义。
银杏是原产于我国的重要经济树种,银杏叶已收录于《中国药典》2015年版一部[3],是出口创汇的重要中药品种,富含大量的次生代谢产物,其中最具药用活性的成分是银杏类黄酮与萜内酯[4]。银杏叶提取物已经成为制药、保健品和化妆品行业最受欢迎的成分之一,银杏叶制剂在国内外市场供不应求,年销售总额达100亿美元,是全球领先的植物药品种[5]。
白果内酯(bilobalide)是一类具有特殊结构的倍半萜内酯类化合物[6-9](图1),是银杏叶中的主要活性成分,也是控制银杏叶药材质量和成药标准的重要指标[10-12]。白果内酯是用于治疗神经、脑和脊髓等相关疾病的药物[13-15],对银杏叶制剂的疗效和产品质量控制起着关键的作用。目前市场上白果内酯纯品主要为对照品,尚缺乏具备溯源性的国家标准样品。因此,本研究建立了银杏叶中分离纯化白果内酯的方法,根据GB/T15000.3—2008/ISO Guide 35:2006[16]研制了白果内酯国家标准样品,为银杏叶药材及相关制剂等产品的分析检测及质量控制提供实物标准支撑。

图1 白果内酯的化学结构式Fig.1 Chemical structure of bilobalide
1 材料
1.1 药材与试剂
银杏叶(银杏GinkgobilobaL.的干燥叶)(济南建联中药店);色谱纯甲醇、乙腈(山东禹王试剂有限公司);其他试剂均为分析纯。
1.2 仪器
1260高效液相色谱仪(美国安捷伦公司),UV-2550紫外可见分光光度计(日本岛津公司),600 MHz核磁共振波谱仪(美国瓦里安公司),6520 Q-TOF液质联用仪(美国安捷伦公司),R-3旋转蒸发仪(瑞士布奇公司),10N冷冻干燥仪(宁波新芝有限公司)。
2 方法与结果
2.1 白果内酯单体的制备
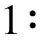

图2 白果内酯的制备液相色谱图Fig.2 Chromatogram of bilobalide purified using preparative LC
2.2 纯度分析
分别采用高效液相色谱(high performance liguid chromatography,HPLC)、薄层色谱(thin layer chromatography,TLC)、液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)、热重(thermogravimetric,TG)分析技术进行样品纯度分析。
2.2.1 HPLC法


图3 白果内酯的等度洗脱HPLC图谱Fig.3 HPLC Chromatogram of bilobalide by equivalent elution

图4 白果内酯的梯度洗脱HPLC图谱Fig.4 HPLC Chromatogram of bilobalide by gradient elution
2.2.2 TLC法

2.2.3 LC-MS法
色谱柱Navo-micro C18(250 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱0~30 min,10%~100%A;流速1.0 mL/min;柱温30 ℃;时间30 min。MS条件:电喷雾离子源ESI,毛细管电压4.0 kV,载气普氮流速10 L/min,温度300 ℃,扫描范围为m/z=100~1000。从样品总离子流图(图5~6)中未发现明显杂质峰存在。

图5 白果内酯正离子模式下总离子流图Fig.5 Chromatogram of the total ion flow of bilobalide in the cation mode

图6 白果内酯负离子模式下总离子流图Fig.6 Chromatogram of the total ion flow of bilobalide in the anion mode
2.2.4 TG分析
初温30 ℃,以10 ℃/min的速率升温,至最终温度600 ℃,气体N2;流量 100 mL/min。从TG分析图谱(图7)可以看出,TG曲线在28.1~280.9 ℃范围内为水平线,该温度范围内稳定性良好,316.7 ℃之后开始分解。多种方式的联合检验可判断出样品纯度高,杂质含量较少。

图7 白果内酯的TG曲线Fig.7 The TG curve of bilobalide
2.3 结构表征


表1 白果内酯的核磁共振氢谱数据Table 1 1H-NMR data of bilobalide

表2 白果内酯的核磁共振碳谱数据Table 2 13C-NMR data of bilobalide

续表2
2.4 均匀性检验
依据GB/T 15000.3—2008 第7章工作导则[16]要求,均匀性检验在相对独立和洁净空间进行分装,随机抽取10瓶,分别从每瓶中取样至4 mL棕色瓶,每份样品1.0 mg溶于1.0 mL色谱纯的甲醇,HPLC分析,以峰面积计算样品的纯度值,样品纯度总平均值为99.86%。以F检验确定白果内酯标准样品的均匀性数据是否符合正态分布,分析样品的瓶间均匀性和瓶内均匀性(图8)。

图8 均匀性检验结果Fig. 8 Measurement data of the homogeneity test
从均匀性检验的方差分析(表3)可见,瓶间自由度为9,瓶内自由度为20,经查表得F0.05(9,20)=2.94,由于F=SM瓶间/SM瓶内=1.25 表3 均匀性检验方差分析Table 3 Variance analysis of the homogeneity test 样品分装后于2~8 ℃保存。选择两年实验周期,对制备的白果内酯标准品取样进行HPLC分析,每份样品重复测定5次,统计分析采用t检验法[16]。随着时间的延长,24个月内检测值未见显著升高或降低,以直线为经验模型观察斜率值,预测稳定性变化,结果显示变化不显著,未观测到明显的不稳定性,即本样品在两年内的长期稳定性良好。稳定性检验结果见图9。 图9 稳定性检验结果Fig.9 Measurement data of the stability test 按照GB/T15000.3—2008标准要求,采用8个实验室协作实验定值,共随机抽取24瓶样品,平均寄送至8家实验室,每份样品重复检测2次,通过峰面积归一化法读取纯度[16, 19]。白果内酯纯度定值结果见图10,样品纯度总平均值,即协作实验室测定的白果内酯标准值为99.88%。 图10 协作定值数据Fig.10 Data of collaborative certification 标准样品的定值结果为标准值99.88%,代入数据计算得白果内酯标准样品的最终不确定度为0.22%。 本文建立了一种银杏叶中白果内酯单体的分离制备方法,具有制备成本低及效率高的特点,可以实现较大量地从银杏叶中分离制备出高纯度白果内酯单体成分。基于该技术并经8家实验室协作定值,成功研制出标准值为99.88%的白果内酯国家标准样品,95%置信区间的不确定度为0.22%,样品均匀性符合国家标准,2~8 ℃条件下24个月内的长期稳定性良好,顺利通过专家组验收。该研究解决了白果内酯及相关产品缺乏国家标准样品的问题,为我国银杏叶药材及相关制品的生产质量控制及分析检测提供了物质基础。
2.5 稳定性检验

2.6 定值检测


3 结论

