opaque-2 基因导入甜糯玉米表型分析及导入系群体初步创制
张惠惠,李余良,刘建华
(广东省农业科学院作物研究所/广东省农作物遗传改良重点实验室,广东 广州 510640)
【研究意义】近20 年来,甜糯玉米在我国华南地区发展快速。opaque2(o2)基因突变影响玉米籽粒胚乳中蛋白体形成、淀粉含量及氨基酸组成,其中,赖氨酸含量提高可使营养品质大幅度提升[1]。因此,利用o2突变基因提高甜糯玉米籽粒的赖氨酸含量,对于提高和改良甜糯玉米营养价值具有重要意义[2]。【前人研究进展】1960 年科学家发现o2突变玉米中赖氨酸和色氨酸含量大幅提高。Mertz 等证实o2突变玉米胚乳的赖氨酸含量比普通玉米提高69%[3]。研究认为,o2突变导致玉米转录功能受到抑制,使醇溶蛋白合成减少,非醇溶蛋白含量相应增加,从而使玉米籽粒的赖氨酸含量增加[4-6]。近年来,育种家通过不断积累修饰因子,成功培育出优质蛋白玉米,主要是利用o2和基因协同作用提高玉米赖氨酸含量,籽粒胚乳呈现透明硬质状态[7]。目前将o2基因导入糯玉米的研究表明,籽粒赖氨酸含量会有不同程度的提高[8-9]。但关于胚乳修饰的机制仍未被充分挖掘,o2基因在不同基因型背景下调控籽粒赖氨酸的积累研究还不多见。【本研究切入点】甜玉米是由于o2基因突变所致,而糯玉米因Waxy基因突变所致,糯玉米缺乏赖氨酸等人体必需氨基酸,因此营养价值受到极大限制[10]。优质蛋白鲜食玉米分子标记辅助育种过程中,o2突变体材料是最常用的高赖氨酸玉米供体[11]。近20 年来华南地区甜玉米产业进入高速发展阶段,作为特色优势作物,在农业生产和效益农业中发挥重要作用。通过分子标记辅助选择把含o2突变基因的高赖氨酸玉米转育甜玉米或糯玉米自交系,可创制高赖氨酸玉米材料,不仅能提高玉米的营养价值,而且能获得优质蛋白甜玉米种质资源,目前相关研究未见报道。【拟解决的关键问题】本研究以含o2突变基因的高赖氨酸玉米转育9 个甜玉米和1 个糯玉米自交系,以期后续研究利用后代籽粒表现及分子标记辅助选择构建甜/糯玉米o2近等基因系,为开展甜/糯玉米高赖氨酸育种研究提供借鉴。
1 材料与方法
1.1 试验材料
优质蛋白玉米HP3(o2/o2wx/wx)作为o2基因的供体亲本,来源于普通玉米自交系5026,属于黄改系类型,由陕西杨凌智种农作物科学研究所张学信老师惠赠。9 个甜玉米受体材料分别为F1、F3、F4、F5、F7、F8、F9、F10、F11,基因型均为O2/O2sh2/sh2;F1、F4、F5、F7 为黄色优质甜玉米自交系,F3、F8、F9、F10、F11 为白色优质甜玉米自交系。1 个糯玉米受体材料为N13-1,基因型为O2/O2wx/wx,为白色糯玉米自交系。以上材料品质优良、农艺性状稳定,均由广东省农业科学院作物研究所提供。
1.2 试验方法
1.2.1 田间种植 2020—2021 年在广东省农业科学院白云基地开展种植。供体材料种植2 行,受体材料及杂交回交、自交后代材料种植1~2 行,行长4 m,株距32 cm,行距60 cm。
1.2.2 甜/糯玉米o2近等基因系创制流程 以HP3 作为o2基因的供体亲本,与10 个甜/糯玉米自交系杂交,以受体材料作为轮回亲本回交或F1杂交种进行自交,根据籽粒表型及透射光观察籽粒透明程度进行子代初步筛选,然后利用SSR标记对回交或自交后代单株进行鉴定筛选。选择基因型为o2/_sh2/sh2或o2/_wx/wx且表型与受体亲本相似的杂合植株再进行回交或自交,最后自交多代选择o2基因纯合且稳定遗传的植株,直至成功创制o2/o2-NILs 甜玉米或糯玉米(图1)。

图1 甜/糯玉米o2 近等基因系创制流程Fig.1 Construction process of o2-NILs in sweet/waxy maize
1.2.3 玉米籽粒表型观察 观察玉米籽粒的饱满情况和色泽,并通过透射光观察籽粒透明程度。
1.2.4 SSR 标记检测 当植株生长到6~7 片叶时进行单株挂牌,取约0.5 g 幼嫩的叶片装入2.0 mL离心管,放入液氮冷冻后用研磨机将样品打磨成粉末状,采用改良CTAB 法[12]提取叶片基因组DNA,用灭菌ddH2O 将DNA 沉淀溶解,并稀释到90 ng/μL 左右。SSR 引物序列来自MaizeGDB,由擎科(广州)生物科技有限公司合成(表1)。PCR 体系15 µL,含2.4 µL 引物(20 µmol/L)、2.0µL DNA 模板、5.3 µL Taq PCR Master Mix(购自北京天根生化科技有限公司)和5.3 µL ddH2O。扩增产物进行6%非变性聚丙烯酰胺凝胶电泳,采用5×TBE 定容至800 mL,然后加200 mL 30%Acr Bis 定容至1 L 制成丙烯酰胺溶液,玻璃板制胶,插梳子静止1 h,待胶变干拔出梳子,放置在电泳槽,点样,电泳2 h,最后经染色得到清晰条带。
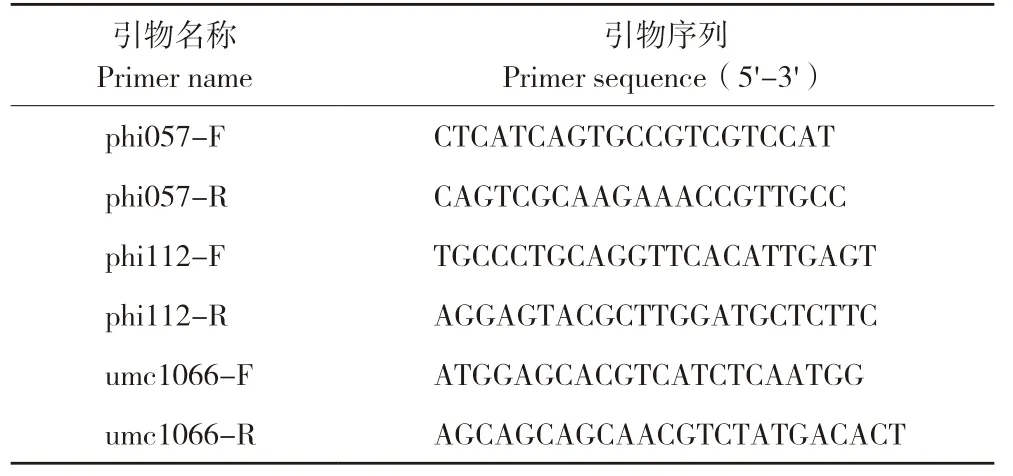
表1 引物名称和序列Table 1 Primer names and sequences
2 结果与分析
2.1 不同基因型玉米籽粒外观表型变化
从籽粒外观来看,供体亲本HP3(o2/o2 wx/wx)籽粒不透明,背面有凹陷,存在一定程度的皱缩,甜玉米籽粒明显干瘪皱缩,而N13-1 籽粒饱满有光泽,所有轮回亲本籽粒透光性好。当转入o2基因后,在杂交一代玉米穗上出现硬质、甜质不同类型的籽粒分离状态,即不同基因型背景下的突变体籽粒表型不一致,回交一代籽粒表现为不同程度的皱缩,表面凹陷。从图2 可以看出,大多数材料在o2基因突变后,籽粒饱满程度和胚乳透光度均不同程度降低,但也存在O2基因突变籽粒表型不明显的现象。整体来看,各组回交后代籽粒变小,呈现不同程度的不透光状态。

图2 亲本玉米及后代籽粒透光性情况Fig.2 Light transmittance performance of grains of parental maize and its offspring
2.2 供体与受体亲本多态性检测
检测供体和受体亲本材料间的多态性是创制近等基因系首要的工作,本研究利用SSR 标记phi057、phi112 和 umc1066 检测受体甜/糯玉米自交系和供体HP3-o2/o2多态性,建立了分子标记筛选各组子代基因型的方法。从图3 可以看出,标记phi057 能扩增出3 种片段大小不同的特异性条带,供体HP3 和各受体材料的多态性谱带不同,各受体材料之间也存在多态性,标记phi057在材料间多态性好,能够对它们进行鉴别,适合用于筛选3 种不同基因型的植株;而phi112 在供体HP3 的带型与受体材料F3、F8、F9 相同,与其他材料带型不同,不适合作为供体与所有受体材料鉴定的标记;从umc1066 标记分析结果看出,仅F4、F7、N13-1 带型不同于供体HP3,其他材料与供体条带相同,均不能区分供体和受体亲本材料。因此,可以选择phi057 标记对下一步回交或自交后代o2基因进行追踪和鉴定。

图3 SSR 标记检测玉米o2 供体自交系和受体自交系多态性Fig.3 Polymorphism of o2 donor and receptors inbred lines of maize detected by SSR markers
2.3 回交1 代群体的单株SSR 标记检测
将供体材料HP3 授粉予10 个受体材料形成各杂交组合,以各受体作为轮回亲本进行回交,利用SSR 标记phi057 检测回交群体中表现皱缩的甜玉米单株多态性。从图4A 可知,在HP3 与F4杂交组合的回交后代BC1F1群体基因型中,编号1、5、6、7、12、13、14 等为杂合个体,基因型为O2/o2;编号2、3、4、8、9、10、11、15 等带型与亲本F4 一致,是纯合显性个体,基因型为O2/O2。同样,从图4B 可以看出,在HP3 与F5 杂交组合的回交后代BC1F1群体基因型中,编号1、2、3、4、6、8、10、13、15、16 等为杂合个体,基因型为O2/o2;编号5、7、9、11、12、14 等带型与亲本F5 一致,为纯合显性个体,基因型为O2/O2;在HP3 与F7 杂交组合的回交后代BC1F1群体基因型中,编号1、3、5、7、9、12、13、14、17、18 等为杂合个体,基因型为O2/o2;编号2、4、6、8、10、11、15、16 等带型与亲本F7 一致,为纯合显性个体,基因型为O2/O2。图4C 显示,在HP3 与N13-1 杂交组合的回交后代BC1F1群体基因型中,编号1、2、3、4、5、7、10、12、13、18、21、22、25、26、27、28 为杂合个体,基因型为O2/o2;编号6、8、9、11、14、15、16、17、19、20、23、24、29、30、31、32 带型与亲本F5 一致,为纯合显性个体,基因型为O2/O2。田间保留杂合个体继续进行回交筛选,去除显性纯合植株。其余6 组材料经标记筛选也获得了一些杂合个体,表明o2基因已成功导入各受体材料,获得了供体的隐性突变基因。

图4 SSR 标记phi057 检测各BC1F1 群体的基因型结果Fig.4 Genotypes of BC1F1 population detected by SSR molecular marker phi057
2.4 自交群体的单株SSR 标记检测
对各杂交组合采用自交的方法,利用SSR 标记phi057 检测F2群体中表现皱缩的甜玉米单株多态性。图5A 显示,在HP3 与F7 杂交组合的自交后代F2群体基因型中,编号1、2、3、4、5、6、7、8、9、10、11 为杂合个体,基因型为O2/o2;编号12 带型不清晰。图5B 显示,在HP3 与N13-1杂交组合的自交后代F2群体基因型中,编号2、4、6、7、9、10、13 为杂合个体,基因型为O2/o2;编号1、3、5、8、11、12、14 带型与亲本N13-1一致,是纯合显性个体,基因型为O2/O2。同样,图5C 显示,在HP 3与F 8杂交组合的自交后代F2群体基因型中,检测的所有单株基因型均为杂合个体;在HP3 与F9 杂交组合的自交后代F2群体基因型中,编号为2、3、4、5、6、7、8、9、10 为杂合个体,基因型为O2o2;编号1、11、12带型与亲本F9 一致,是纯合显性个体,基因型为O2/O2。田间去除各组自交后代显性纯合植株,留下杂合基因型植株继续回交或自交。
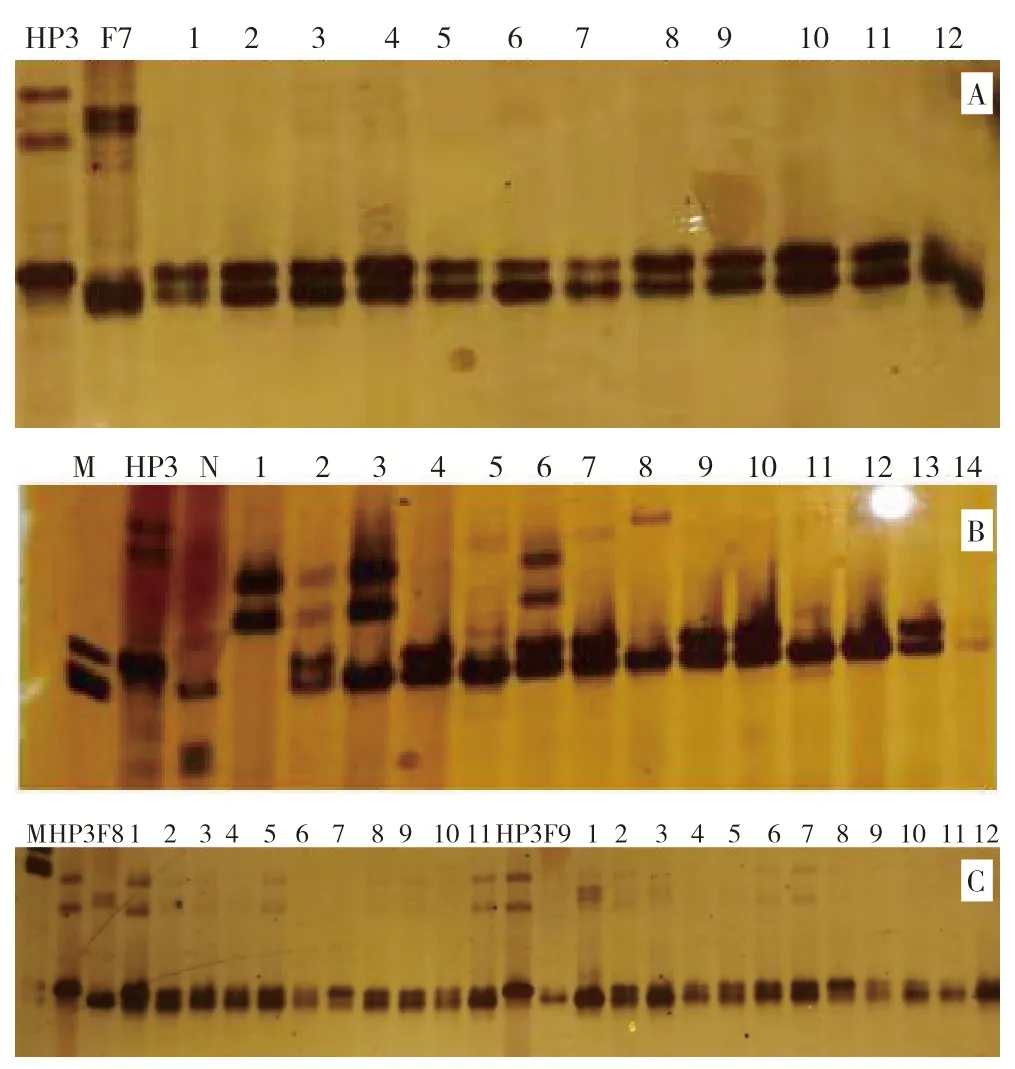
图5 SSR 标记phi057 检测的F2 自交群体基因型结果Fig.5 Genotypes of F2 populations detected by SSR molecular marker phi057
3 讨论
甜糯玉米可作为鲜食玉米,对人体具有很高的营养价值,但是赖氨酸、蛋氨酸、色氨酸等必需氨基酸含量并不高。将含o2突变基因的高赖氨酸玉米导入到甜玉米自交系,通过分子标记辅助选择创制高赖氨酸甜玉米材料,对于提高甜玉米营养价值具有较好的遗传育种价值。研究发现,自交系多黄29、丹3130、9046 等材料与CA335杂交的后代全为o2/o2隐性纯合个体[13],而它们与CA339 用phi057 标记无多态性。本研究SSR标记phi057 发现,受体亲本与供体亲本均有多态性。有研究利用山东 2548 和齐205 作为供体、11份玉米自交系作为受体,未能构建o2近等基因系[14],这说明亲本间有无多态性应值得考究。本研究拟利用HP3 构建o2近等基因系。在利用phi057 构建近等基因系时,必须检测供体与受体亲本之间的多态性,选择存在多态性的两个亲本杂交才能成功构建材料。本研究发现,phi057 标记不仅在供体和受体之间存在多态性,而且利用phi057 标记能够成功地检测将来源于供体的o2基因导入受体系。普通玉米胚乳蛋白质中由醇溶蛋白组成,且赖氨酸含量仅70%,o2突变体能显著增加非醇溶蛋白含量,从而极大提高籽粒中色氨酸和赖氨酸的含量[15-17]。但o2突变基因在不同玉米遗传背景中的作用具有很大差异,α-醇溶蛋白、赖氨酸含量变化幅度差异极大[18-21]。分子标记辅助选择虽然能够准确地筛选导入纯合o2/o2基因型的植株,但是转育后不同材料间的赖氨酸含量增加幅度变化较大,这给选育高赖氨酸玉米增加了难度[22-23]。
本研究通过SSR 分子标记phi057 筛选鉴定o2突变基因转入甜糯玉米在其子代中的传递,把o2基因导入到甜糯玉米自交系中,以期创制双隐性o2/sh2-NILs 甜玉米近等基因系,建立一套在甜玉米中导入o2的分子标记辅助育种方法。通过此方法向不同遗传背景的甜糯玉米导入o2,选取赖氨酸含量提高较大、表型透光程度差异明显的o2/sh2或o2/wx-NILs,作为后代育种的基本材料。
本研究仅开展了2 代筛选鉴定,材料还没有稳定,基因尚处于回复和纯合过程,需要继续开展选育和鉴定研究。而且成功构建o2近等基因系后还需要检测玉米赖氨酸含量,以验证导入o2基因对提高甜糯玉米赖氨酸营养的可行性。研究表明,o2突变后糯玉米籽粒表型同甜玉米表型变化基本一致,都是由蜡质表型变成不透明的粉质表型,可见糯玉米籽粒表型的变化与普通o2突变体一致,可能还会导致高赖氨酸糯玉米不易储存,易遭病虫害侵食,但该论点在本试验中未得到证实[24-25]。
4 结论
本研究以1 份优质蛋白玉米材料HP3 为供体,将o2基因转入9 份甜玉米和1 份糯玉米自交系材料,SSR 标记phi057 在供体和受体自交系o2基因中呈现良好的多态性,在回交和自交后代中能够检测到供体的o2基因成功导入甜糯玉米受体自交系。供体亲本籽粒背面凹陷且皱缩,在投射光下籽粒不透明;甜玉米外观干瘪皱缩,糯玉米籽粒饱满且有光泽,且甜糯玉米透光性好;但o2基因转入后,F1代甜质玉米表现出硬质、皱缩不同类型的籽粒分离状态,BC1代则明显表现出透光性降低,与供体亲本特点相吻合。在回交和自交后代中通过籽粒表型与分子标记辅助选择相结合的方法,初步创制了10 组优质甜/糯玉米早代群体系,研究建立了一个快速、有效的分子标记辅助选择改良鲜食玉米品质的方法。

