探索白细胞介素-1受体拮抗剂对大鼠角膜移植术后Treg的影响
李 兰,曹 倩,李 勇,李云川,邹 莹,龙俊君,刘浩文,何柳余
(昆明市第一人民医院眼科,云南昆明 650000)
角膜移植术是目前角膜盲患者复明的唯一方式[1],即使在局部和全身免疫抑制治疗的前提下,患者的角膜移植术失败率仍可能超过50%[2]。介导角膜移植术排斥反应的细胞和分子机制还不十分清楚。大量研究提示,炎性因子介导的炎性反应是角膜移植术排斥反应发生的基础,其中白细胞介素-lβ(interleukin-1β,IL-1β)是关键因子[3-4]。CD4+CD25+Foxp3+调节性T淋巴细胞(regulatory T cells,Treg)为参与眼前房相关免疫偏离的重要细胞[5],近年来成为研究热点。目前研究表明炎性微环境下多聚泛素化作用可导致Foxp3蛋白降解,Treg免疫抑制功能受损[6]。为了解角膜移植术术后白细胞介素-1受体拮抗剂(interleukin-1 receptor antagonist,IL-1ra,美国Selleck公司)对IL-1β、Treg及排斥反应的影响,本文建立心脏死亡供体(donation after cardiac death,DCD)大鼠角膜移植术模型后,受体SD大鼠玻璃体腔注射IL-1ra,观察角膜移植术情况并检测SD大鼠全血、淋巴结中IL-1β、Treg水平,旨在为角膜移植术排斥反应的防治提供一定的实验依据。
1 材料与方法
1.1 材料
SD大鼠,体重220~250 g,8~10周龄,购于湖南斯莱克景达实验动物有限公司,饲料由江苏美迪森生物医药有限公司提供,清洁级适应性饲养1周后进行实验。实验程序经过昆明市第一人民医院医学伦理委员会动物实验伦理审查批准通过(批准号:YLS2020-119)。
1.2 方法
1.2.1供体准备
取12只SD大鼠,使用5 mL注射器抽取5 mL空气于大鼠左侧肋骨角偏左上方心脏方向处进针,回抽见血液确定穿刺部位位于心腔,注射5 mL空气处死大鼠,建立心脏死亡模型。5%~10%聚维酮碘消毒右眼结膜囊5 min,生理盐水冲洗结膜囊。沿角膜缘360°剪下全层角膜供体,4.25 mm环钻制作角膜植片置于Optisol保护液中备用。
1.2.2受体准备
共24只SD大鼠,采用硬币法分为磷酸盐缓冲液(PBS)组与IL-1ra组,各12只。采用10%水合氯醛按照3 mL/kg行大鼠腹腔麻醉后以盐酸奥布卡因滴眼液滴右眼,4.0 mm环钻制作好植床。
1.2.3角膜移植术
取DCD大鼠角膜植片,分别在受体大鼠内行穿透性角膜移植术,将供体角膜植片置于受体植床上,使用12-0国产显微缝线进行间断缝合8针,线节不埋藏,前房内注入空气约0.1 mL形成前房。术毕,按照实验分组,PBS组玻璃体腔注射PBS 1 IU,IL-1ra组玻璃体膜注射IL-1ra 1 IU,结膜囊内点妥布霉素眼膏,6-0缝线缝合眼睑中部防止术后大鼠抓挠眼部引起感染,术后24 h剪开眼睑缝线,点妥布霉素眼膏,1次/天,连续使用1周。
1.2.4观察指标
(1)角膜移植术排斥反应情况评分:术后用体视镜每周观察并拍照记录术眼角膜水肿、角膜混浊、新生血管情况,由同一医生进行角膜移植术排斥反应评分,3项评分之和为排斥指数 (rejection index,RI),当RI≥6,确定为排斥[7]。(2)分别于术后1、3、5周处死每组大鼠各4只,取外周血、淋巴结,ELISA法检测IL-1β表达水平,流式细胞术检测Treg数量。
1.3 统计学处理
2 结 果
2.1 大鼠全血和淋巴结中IL-1β水平比较
术后1、3、5周,两组全血、淋巴结IL-1β水平逐渐降低,Treg数量均逐渐升高,组内不同时间点两两比较差异有统计学意义(P<0.05)。术后1、3、5周,IL-1ra组大鼠全血、淋巴结中IL-1β水平均明显低于PBS组大鼠,差异有统计学意义(P<0.05)。见表1、2。

表1 大鼠角膜移植术后全血IL-1β水平比较

表2 大鼠角膜移植术后淋巴结中IL-1β水平比较

续表2 大鼠角膜移植术后淋巴结中IL-1β水平比较
2.2 大鼠全血和淋巴结Treg数量比较
术后1、3、5周,两组全血、淋巴结Treg数量逐渐升高,组内不同时间点两两比较差异有统计学意义(P<0.05)。见表3、4。术后1周PBS组全血Treg数量与IL-1ra组比较,差异无统计学意义(P=0.090),见表3,图1A。术后3、5周,IL-1ra组全血Treg数量高于PBS组,差异有统计学意义(P<0.05)。术后1、3、5周,IL-1ra组淋巴结Treg数量均高于PBS组,差异有统计学意义(P<0.05),见表4,图1B。

表3 大鼠角膜移植术后全血Treg数量比较

A:全血;B:淋巴结。

表4 大鼠角膜移植术后淋巴结Tregs数量比较
2.3 角膜移植术排斥情况评分比较
术后1、3、5周,两组RI逐渐增加;术后1周,IL-1ra组与PBS组大鼠RI比较,差异无统计学意义(P=0.337 5);术后3、5周,IL-1ra组大鼠RI均低于PBS组大鼠,差异有统计学意义(P<0.05),见图2、表5。

图2 体视显微镜观察移植角膜移植术排斥反应情况(6.5×)
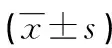
表5 大鼠角膜移植术术后RI比较
3 讨 论
角膜移植术术后角膜植片的透明性主要通过3种方法来维持:(1)抑制角膜异体免疫应答;(2)诱导免疫耐受;(3)清除存在于移植物-宿主处的可溶性细胞因子和膜结合蛋白或阻断免疫效应物[8-9]。近年来,研究者致力于通过增加外源性Treg的数量来抑制角膜移植术术后排斥反应,延长角膜植片的存活时间。研究表明,角膜移植术后的微环境是一种炎性环境,肿瘤坏死因子-α(TNF-α)中和性抗体及天冬氨酸特异性胱氨酸蛋白酶-8(caspase-8)抑制剂可有效延缓角膜移植术排斥反应的发生,开拓了角膜移植术免疫排斥防治的新思路[10-11]。本实验在DCD大鼠角膜移植术术毕于受体大鼠玻璃体腔内注射IL-1ra,并检测到术后全血及淋巴结中Treg数量增加。
眼前节免疫赦免机制在角膜移植术术后受到破坏,有大量炎性细胞浸润于角膜植片及房水中。以往的实验研究也发现,角膜移植术术后眼前房内有大量巨噬细胞聚集,并可见巨噬细胞黏附于角膜内皮[11]。巨噬细胞可产生TNF、IL-6等多种炎性细胞因子,是角膜移植术术后早期浸润的炎性细胞,这表明角膜移植术术后的微环境是一种炎性环境。本实验中发现PBS组角膜移植术术后全血、淋巴结中IL-1β水平较IL-1ra组明显升高;IL-1ra组术后1、3、5周全血和淋巴结中IL-1β水平均明显下降,且术后5周IL-1β水平降至最低,表明IL-1ra可明显抑制大鼠角膜移植术术后前房内炎性反应。
Treg在免疫稳态的建立与维持中起重要作用,不仅对T淋巴细胞具有抑制增殖、促进凋亡的作用,而且可以负向调控B淋巴细胞、自然杀伤细胞(NK细胞)、自然杀伤T淋巴细胞(NKT细胞)等多种免疫细胞的生物功能[12-13],是参与眼前房相关免疫偏离的重要细胞类型之一[14]。有研究表明,IL-1β刺激下Treg减少,增加了角膜移植术术后排斥反应发生的概率[15-16]。本研究中,流式细胞术检测术后1、3、5周IL-1ra组全血、淋巴结中Treg数量均升高,且术后5周升至最高,而全血检测到IL-1β水平逐渐降低,在术后5周时降至最低,说明IL-1ra抑制了炎性因子的表达,促进了Treg增殖。角膜移植术后排斥反应评分表明,随着时间延长RI增加,但IL-1ra组RI在术后3周开始较PBS组明显降低。
综上所述,大鼠角膜移植术术后玻璃体腔注射IL-1ra可降低全血、淋巴结中IL-1β水平,增加全血、淋巴结中Treg数量,减轻术后排斥反应。但IL-1ra具体是通过何种通路作用于Treg,抑制角膜移植术后排斥反应的发生,仍需要进一步实验研究。

