食品级κ-卡拉胶对机体致结肠炎风险的探讨
张慧,刘芳,杨瑞利,唐庆娟
(中国海洋大学食品科学与工程学院,食品科学与人类健康实验室,山东青岛 266000)
卡拉胶即角叉菜胶(Carrageenan),是从石花菜、鹿角菜、麒麟菜等红藻中萃取的天然多糖类植物胶体[1]。因其具有良好的凝胶、增稠及蛋白反应性等理化性质,常在医药和食品等行业被用作乳化剂、增稠剂、稳定剂等。例如在医药行业中,卡拉胶可被用于鱼肝油乳化剂以及缓释胶囊等的制作[2];在食品行业中卡拉胶作为一种天然高品质的食品添加剂,被广泛应用于乳制品、果汁饮料、冰淇淋、糖制品、肉制品、白酒和啤酒等的生产[3]。此外,由于卡拉胶及其衍生物具有很多生理活性如抗凝血、抗病毒、免疫调节等,也常被应用于药理学和医学研究中[4-6]。
然而,近年来一些研究发现,卡拉胶具有一定的生物毒性,特别是易引发宿主肠道黏膜免疫功能的损伤,从而导致肠道炎症[7]。Tobacman等人从动物实验、细胞实验、肠道菌群实验等多个角度对卡拉胶的致炎作用及机理进行了总结,并提出美国日益增多的肠道炎症和肠癌等疾病可能与食品中添加的卡拉胶有关[8]。然而,也有研究证明,卡拉胶在宿主体内并不会引起明显的肠道炎症[9]。因此,基于诸多研究结果的不一致和不可重复,人们对于卡拉胶的食用安全性一直存在争议与质疑。
有研究人员指出,卡拉胶食用安全性存在争议,可能是由于实验过程中采用不同品质的卡拉胶,或对其特征疏于鉴定等原因导致的,又或者是在下结论时未考虑到其物理与化学性质[10,11]。因此,本研究拟采用市售食品级κ-卡拉胶作为受试物进行食用安全性探究,并首先对其特征如分子量分布及亚型进行确定,以保证实验结果的准确性。值得注意的是,无论是在食品还是医学行业,对任意一种活性物质进行安全性研究,若抛开剂量来谈毒性是不科学的。因此本研究拟将几种具有代表性的人群卡拉胶摄入量换算成小鼠有效剂量,按照0.05%、0.5%、1%、2.5%、5%的比例掺入小鼠日粮中来探究食品级κ-卡拉胶能否诱发机体结肠炎症。本研究成果将为卡拉胶生产和消费提供有效指导和科学依据,希望能够消除生产者和消费者关于卡拉胶添加的恐慌和疑虑。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
SPF级C57BL/6J雄性小鼠,6周龄,体重17~19 g,济南朋悦实验动物繁育有限公司(许可证号SCXK(鲁)2014 0007);AIN-93M标准纯化饲料(饲料代码LAD3001M)及其受试物添加饲料,南通特洛菲科技有限公司;食品级κ-卡拉胶(品牌绿力),石家庄春信生物科技有限公司(生产许可证SC20135068100171);溴化钾(KBr,光谱纯),国药集团化学试剂有限公司;便隐血(FOB)检测试剂盒(胶体金法),艾博生物医药有限公司;卡尔文ELISA试剂盒,上海艾莱萨生物科技有限公司;TLR4抗体(批号GB12186)及HRP标记山羊抗小鼠IgG(批号GB23301),武汉赛维尔生物科技有限公司;TNF-α抗体(批号abs131997),爱必信生物科技有限公司;组化试剂盒DAB显色剂(批号G1211),武汉赛维尔生物科技有限公司。
1.1.2 实验仪器设备
高效凝胶排阻色谱仪(型号ELEOS System),美国Wyatt Technology公司;傅立叶变换红外光谱仪(型号Nicolet iS10),美国Thermo Fisher Scientific公司;电动荧光显微镜(型号NIKON/Ni-E),日本尼康公司;酶标仪(型号SPARK 10M),瑞士TECAN。
1.2 实验方法
1.2.1 受试物及其特征确定
1.2.1.1 卡拉胶特征鉴定
食品级κ-卡拉胶,呈类白色粉末状。藻源:印尼、菲律宾等地麒麟菜;提取工艺:碱提醇沉法;有效物质含量为95%,纯度可达99%。
卡拉胶分子量及其分子量分布采用高效凝胶排阻色谱测定(HPSEC),配备有多角度激光散射仪和示差检测器。色谱柱为Shodex OH-PAX(柱型SB-806),流动相为0.2 M氯化钠溶液(内含0.003 M叠氮钠),流速0.5 mL/min,柱温40 ℃;将样品用流动相稀释为0.52 mg/mL并过0.2 μm滤膜,取制备好的卡拉胶溶液0.8 mL注入凝胶色谱仪。
卡拉胶亚型通过傅立叶变换红外光谱仪测定(FI-IR)。采用KBr压片法制备样品,压片压力值约14 MPa,保持1 min,待样品压成完整透明薄片即可置于红外光谱仪进行测定;背景采集后完成后开始采集样品信息。
1.2.1.2 卡拉胶剂量确定
按照FAD所推荐的人和小鼠之间的有效剂量换算公式,将几种典型人群卡拉胶摄入量换算成小鼠剂量,如正常成年人日常摄食卡拉胶量(以正常摄入奶制品、调味料及火腿等卡拉胶加工食品为主)、南弗罗里达州成年人一天最高摄食卡拉胶量(较多摄入奶油、奶酪、肉制品及奶制品等卡拉胶加工食品)、以及诱发成年人结肠炎的最低卡拉胶摄食量(实验预估剂量)等,以探究这几种典型的、具有代表性的卡拉胶剂量是否具有诱发消费者结肠炎的可能性。具体见表1。

表1 卡拉胶在人和小鼠饮食中的比例换算[12]Table 1 Conversion of carrageenan proportion in the diet of humans and mice
1.2.2 实验动物及处理
动物实验经中国海洋大学食品科学与工程学院动物伦理委员会批准后进行(编号SPXY2019042001)。将72只C57BL/6J雄性小鼠分为6组,每组12只,分别为对照组(NC),饲喂AIN-93M标准纯化饲料;不同剂量卡拉胶组(0.05% CGN、0.5% CGN、1%CGN、2.5% CGN、5% CGN),将卡拉胶掺入对照饲料中饲喂。小鼠暂养2周后进行受试物处理,6周后处死。饲养温度23~25 ℃,相对湿度40%~55%,通风良好,每日光照和黑暗各12 h,自由饮水和进食。
1.2.3 脏器指数
小鼠处死后立即分离出完整结肠,平铺于锡箔纸上测定长度,并比较统计各组小鼠结肠长度;分离免疫脏器包括脾脏和胸腺,于4位电子天平上称重,并计算统计小鼠免疫脏器指数。脏器指数计算公式如下:

1.2.4 炎症介质蛋白表达
ELISA测定小鼠结肠中炎症介质的蛋白表达。小鼠处死后取结肠约1 cm,用生理盐水将其制备成10%组织匀浆并离心取上清液,ELISA试剂盒测定上清液中髓过氧化物酶(Myeloperoxidase,MPO)酶活及前列腺素E2(Prostaglandin,PGE2)的蛋白表达量,检测时严格按照试剂盒说明书进行操作,使用酶标仪在450 nm处测定吸光值。
1.2.5 炎症因子蛋白表达
免疫组化法(IHC)测定小鼠结肠中卡拉胶受体及炎症因子的蛋白分泌量。取结肠约1 cm,立即放入4%多聚甲醛组织固定液中进行固定,以便后续制作切片。组织进行石蜡包埋并切成4 μm切片,使用Toll样受体4(Toll-like receptor,TLR4)和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)抗体进行孵育2 h,之后以HRP标记山羊抗小鼠IgG进行孵育并显色。使用电动荧光显微镜观察切片,每组随机选定3个切片,每个切片随机选取3个200×视野,采用Image Pro Plus 6.0软件分析图像,根据以下公式计算并统计各组平均积分光密度(Average Integral Optical Densities,AIOD)。AIOD计算公式如下:

1.2.6 组织病理学
将石蜡包埋组织切成4 μm切片,进行苏木精和伊红(Hematoxylin-eosin staining,HE)染色,使用电动荧光显微镜观察结肠炎症情况,包括肠壁形态,肠粘膜结构,炎症浸润情况等。采用Image J软件测定小鼠结肠隐窝深度,各组随机选定5个切片,每个切片随机选取8~10个视野,统计各组隐窝深度平均值。
1.2.7 小鼠摄入的实际卡拉胶量
实验结束后,统计各组小鼠的每日摄食量并计算每日卡拉胶摄入量,按照FDA推荐的人与小鼠有效剂量换算公式将小鼠对卡拉胶的实际摄入量换算成每日人对卡拉胶加工食品的可能消耗量,例如果冻和午餐肉。
1.3 数据处理
所有实验重复至少3次,数据均表示为Mean±SD。统计分析及作图均采用GraphPad Prism 7.0和SPSS 19.0专业软件,组间采用单因素方差分析(One-way ANOVA),Tukey检验进行差异性分析。以*p<0.05表示为差异有统计学意义。
2 结果与讨论
2.1 卡拉胶及其特征

图1 卡拉胶特征鉴定Fig.1 Identification of carrageenan characteristics
研究表明,不同亚型的卡拉胶毒性效应不同,如Bhattacharyya等[16]表明相同浓度的λ-CGN刺激肠上皮细胞后产生最高水平的IL-8,ι-次之,而κ-卡拉胶处理后产生的IL-8量最少。因此本文对购买的卡拉胶进行了亚型测定。红外光谱图像表明,在3451.20,2907.10 cm-1处有两个吸收峰峰,分别为多糖中O-H和C-H的伸缩振动(Stretching Vibration)[17,18]。而1262.32 cm-1和1069.39 cm-1处的吸收峰,表明了硫酸酯和糖苷键的存在。928.9 cm-1处的吸收峰是卡拉胶单糖组分3,6-脱水-D-半乳糖的特征峰[19]。在846.92 cm-1(3,6-内醚半乳糖C4位硫酸基的吸收峰)有明显吸收峰,而在805-810 cm-1(3,6-内醚半乳糖C2位硫酸基的吸收峰)无吸收峰,表明该样品确实为κ-卡拉胶,这与迟连利等报道的一致[20](图1a)。
食品级卡拉胶是指分子量范围在100~800/ 200~400 ku,且含有极少量小分子片段的多聚卡拉胶[8]。为了鉴定购买的卡拉胶样品是否符合食品级的技术要求,本文利用高效凝胶排阻色谱对其分子量及分布进行了测定,结果表明该样品组分分散性良好,平均分子量300.4 ku,分子量分布为200~400 ku的分子占有86%,400~800 ku的分子占有13.3%,不含有<50 ku的低分子量片段,符合食品级卡拉胶的分子量范围,与Tobacman等的描述一致[8](图1b)。
此外,根据鉴定报告显示,该样品硫酸酯含量为21%(食品级卡拉胶硫酸酯含量国标范围为15%~40%),粘度为0.16 Pa·s(食品级卡拉胶粘度范围应≥0.005 Pa·s)[8],各指标均符合食品级卡拉胶要求范围。该结论是后续毒性研究的基础。
2.2 不同剂量食品级卡拉胶对小鼠脏器指数的影响

图2 卡拉胶剂量对小鼠免疫脏器指数的影响Fig.2 The effects of carrageenan dosage on immune organs index of mice
脾脏和胸腺是哺乳动物最重要的淋巴器官,在机体免疫调节过程中发挥着重要作用。研究表明,当机体发生炎症时,脾脏和胸腺指数显著下降,标志着器官免疫功能的降低[21,22]。本文研究结果表明,0.05%~5%卡拉胶组小鼠脾脏指数分别为24.16、23.93、24.56、22.13和24.87(图2a),与对照组(23.30)相比无显著差异;各剂量组小鼠胸腺指数分别为10.36、10.88、10.25、10.65及10.37(图2b),与对照组(11.74)相比仍无显著差异。说明不同剂量卡拉胶干预小鼠后,小鼠免疫功能保持正常,这与Weiner等表明高达5%的κ-卡拉胶(分子量196~257 ku)干预90 d后对大鼠的脾脏等脏器重量无明显影响的研究结果是一致的[9]。在结肠炎症机体中,结肠往往会发生萎缩,长度缩短[23]。本文结果显示,各剂量组小鼠结肠长度(图2c)与对照组(6.67)相比无显著差异,表明小鼠结肠未发生明显萎缩。

图3 卡拉胶剂量对小鼠结肠中炎症介质蛋白表达的影响Fig.3 The effects of carrageenan dosage on the protein expression of inflammatory mediators in the colon of mice
2.3 不同剂量食品级卡拉胶对小鼠结肠中炎症介质的影响
炎症介质的释放是表征肠道炎症的重要指标之一。PGE2是典型的炎症介质,在腹泻型肠炎中起着关键作用[24]。与此同时,肠道发生炎症时,肠粘膜常伴有大量中性粒细胞浸润,而MPO作为中性粒细胞释放的酶,其酶活也可作为诊断机体肠道炎症的指标之一[25]。因此,本文对各组小鼠结肠中的PGE2释放量及MPO酶活进行了测定,以判断卡拉胶摄入是否能够诱发结肠炎症反应。结果表明,2.5%CGN组小鼠结肠中MPO酶活性(210.52,图3a)与对照组(298.62)相比下降约29.50%(p<0.01),其他剂量组(从低到高剂量分别为296.33、259.59、281.29、252.29)与对照组相比无显著差异;各剂量卡拉胶组小鼠结肠中PGE2释放量(294.76、282.38、290.93、275.27、265.76,图3b)与对照组(302.5)相比无显著差异,说明不同剂量的食品级κ-卡拉胶干预小鼠未引起结肠炎症介质的异常升高并诱发炎症。
2.4 不同剂量食品级卡拉胶对小鼠结肠中炎症因子的影响
认为卡拉胶具有肠道毒性效应的学者认为,卡拉胶会被结肠上皮细胞中的TLR4识别并结合,从而诱发下游的炎症因子释放,导致肠道炎症[26]。因此本文测定了结肠中TLR4的蛋白表达,以判断卡拉胶是否能够诱发TLR4的高表达并与之结合导致小鼠结肠炎。
如图4及表2所示,统计各组AIOD,发现除1%CGN组(8557.95)的TLR4分泌量高于对照组66.67%(5134.72,p<0.05)外,其余剂量组(Table 2)与对照组相比无显著差异。而1% CGN组小鼠结肠中TLR4异常升高可能是由于卡拉胶与一些内源性配体竞争性结合引起的,但该升高在卡拉胶单独处理时不足以诱发下游炎症反应,该现象与Wu等发现卡拉胶单独处理可介导HT-29细胞中TLR4少量分泌但无炎症反应的结果是相似的。此外,统计促炎因子TNF-α的表达,发现0.05% CGN组(5462.13)的TNF-α低于对照组(14818.13,p<0.05)约63.14%,其余各剂量卡拉胶组小鼠结肠中的TNF-α(Table 2)蛋白分泌量与对照组相比无显著差异。Wu等同样表明高分子量κ-卡拉胶单独以不同剂量处理小鼠时,未诱发小鼠结肠炎症[27]。因此,综合其他指标考虑,高达5%的食品级κ-卡拉胶掺入饲料中饲喂小鼠,小鼠无患发结肠炎的风险。
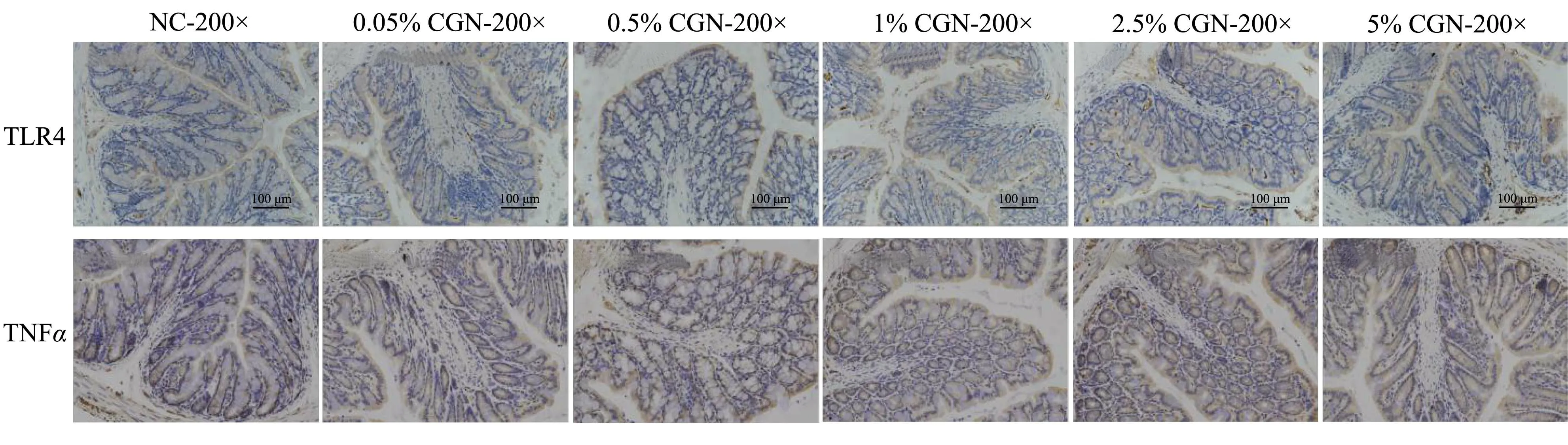
图4 各组小鼠结肠中炎症因子蛋白分泌的电镜图像Fig.4 The microscope image of the protein secretion of inflammatory factors in the colon of various groups of mice

表2 卡拉胶剂量对小鼠结肠中炎症因子分泌的影响Table 2 The effects of carrageenan dosage on the secretion of inflammatory factors in the colon of mice
2.5 不同剂量食品级卡拉胶对小鼠结肠病理学的影响


图5 卡拉胶剂量对小鼠结肠结构的影响Fig.5 The effects of carrageenan dosage on colonic structure of mice
最后本文采用4×和20×倍数显微镜对小鼠结肠进行观察,发现对照组和各剂量卡拉胶组小鼠结肠肠壁完整,厚度正常;肠粘膜结构比较完整,固有层无明显炎症浸润,隐窝完整且排列有序,杯状细胞无明显减少,排列有序致密(图5a)。且0.05%~5%卡拉胶组小鼠结肠隐窝深度(177.22、180.35、167.68、172.57、157.30)与对照组(170.92)相比无显著差异(图5b)。Weiner等也表明卡拉胶干预后大鼠肠道仍保持正常生理结构,这与本实验对结肠的病理学分析结果一致[9]。表明高达5%的食品级κ-卡拉胶以掺入饲料的方式对小鼠进行干预,小鼠不会患发结肠炎。
2.6 各组小鼠的卡拉胶实际摄入量
为了将动物实验的研究结果合理外推到人对卡拉胶摄入的安全性上,本文按照FDA推荐的人与小鼠有效剂量换算公式将小鼠对卡拉胶的实际摄入量换算成人对果冻和午餐肉的消耗量,如表3。换算结果表明,该实验设计的小鼠最大剂量-5%卡拉胶,相当于人每日需消耗3.5份及以上午餐肉,而正常人日常对卡拉胶加工食品的摄入几乎很少达到该剂量或者更高剂量。此外,食品行业常常将卡拉胶与其他食用胶复配使用来达到更好的改善产品性能的效果,而过多卡拉胶的添加往往导致食品感官的下降。因此可以合理推测,正常人群依照科学饮食习惯合理摄入卡拉胶加工食品不会有罹患结肠炎的风险,更不必过度担忧卡拉胶添加过量导致的毒性效应。
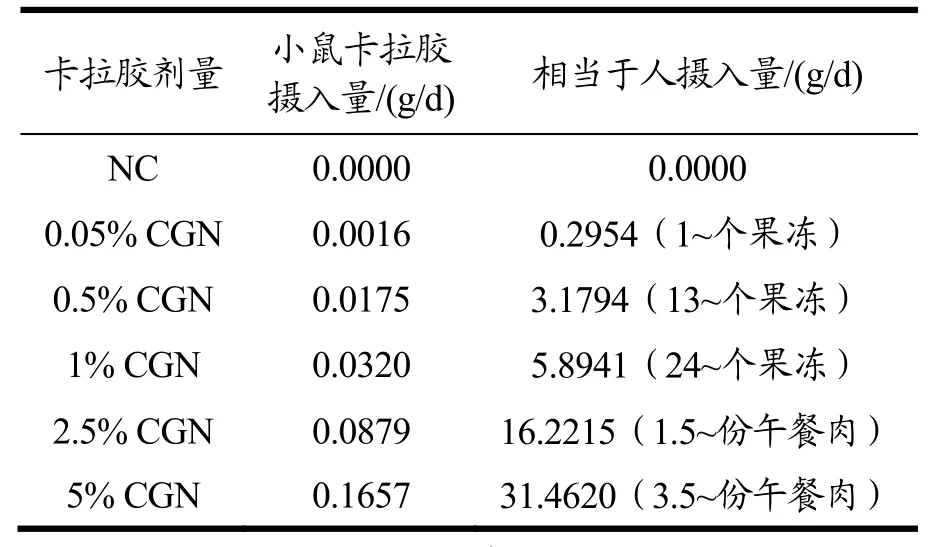
表3 各组小鼠卡拉胶实际摄入量Table 3 Actual carrageenan intake of each group
3 结论
本研究通过将0.05%~5%的市售食品级κ-卡拉胶掺入饲料中干预小鼠,来模拟并探究成年人摄食卡拉胶加工食品患发结肠炎的可能性。诸多国内外研究表明,影响卡拉胶诱发肠道毒性的因素众多,而卡拉胶特征及品质的鉴定对其毒性判断的影响是首当其冲的。因此越来越多的学者和研究人员呼吁,在实验时要考虑卡拉胶的纯度、分子量分布及亚型等自身特征,以便得到更准确的结论,防止引起公众和消费者的疑虑和恐慌。基于此观点,本文首先对购买的卡拉胶样品进行了亚型和分子量测定。红外色谱表明该样品确为κ-型卡拉胶;凝胶排阻色谱显示该样品平均分子量300.4 ku,且不含有<50 ku的小分子片段。这些鉴定结果说明,所购样品较好符合食品级κ-卡拉胶的技术要求,而该要求是本文后续研究开展的重要基础。接下来,为了探究此市售食品级卡拉胶的肠道毒性,本研究分别将不同剂量的卡拉胶样品掺入饲料中饲喂小鼠6周,处死后检测结肠炎症相关指标。结果表明,各剂量组小鼠的免疫脏器指数、结肠长度及微观结构、结肠中PGE2释放量与对照组相比均无显著差异(p>0.05),说明0.05%~5%卡拉胶未对小鼠免疫脏器及结肠造成明显损伤。0.05%及2.5%卡拉胶干预小鼠后,其结肠中TNF-α蛋白表达量或MPO酶活与对照组相比分别有所下降(63.14%,p<0.05;29.50%,p<0.01),其余剂量组TNF-α表达量及MPO酶活与对照组相比均无显著差异;而TNF-α释放及MPO酶活的下降是否表明卡拉胶具有一定的肠道保健作用,还需后续实验进一步探究。此外,研究发现1% CGN组小鼠结肠上皮细胞受体-TLR4的蛋白表达高于对照组(p<0.05),这可能是由于卡拉胶竞争性结合TLR4引起的,而综合其他指标发现,TLR4升高不足以诱发小鼠结肠炎症。综上所述,可得出结论:高达5%的食品级κ-卡拉胶掺入饲料中饲喂小鼠不会诱发其结肠炎症。除此之外,根据人与小鼠对活性物质的有效剂量差异,本研究发现一般人群对卡拉胶加工食品的摄入几乎达不到实验设计的最高剂量,因此合理推测正常人群依照科学饮食习惯合理摄入卡拉胶加工食品不会有罹患结肠炎的风险。本研究有望为消费者及卡拉胶产业提供科学依据与有效指导。

