瑶药材广东石豆兰生药学研究
白燕远,李金月,李洪梨,李耀燕,闫国跃,张 曼,李 彤
(广西中医药大学 瑶医药学院,广西 南宁 530001)
瑶药材广东石豆兰为兰科植物广东石豆兰(BulbophyllumkwangtungenseSchltr.)的干燥假鳞茎或全草。广东石豆兰又名单叶岩珠、岩枣,分布于浙江、江西、福建、湖北、湖南、广东、广西、四川等地,通常生于海拔约800m的山坡林下岩石上[1]。可全草入药。最近广西瑶药标准第二卷的编写前准备工作正在进行中,广东石上虾是瑶药标准第二卷的收录品种之一,笔者围绕标准编制的内容,对广东石豆兰进行相关研究。从生药学角度对广东石豆兰进行了研究,现报道如下。
1 材料与方法
1.1 研究材料
本研究共收集样品8批,详细信息见表1,经广西中医药大学韦松基教授和广西中医药研究院黄云峰副研究员鉴定为兰科植物广东石豆兰BulbophyllumkwangtungenseSchltr.。完成样品收集后,将8批样品进行粉碎处理,并统一过40目筛,备用。

表1 广东石豆兰样品信息
1.2 研究方法
本研究采用文献查阅和实验研究相结合的方法。
1.2.1 药理作用 广东石豆兰水提物的止咳作用(浓氨水喷雾引咳法)研究。取50只小鼠,随机分为空白对照组,模型对照组,阳性药止咳片(1.2 g·kg-1)组,石上虾水提物高、中、低剂量(7.5、5.0、2.5 g生药·kg-1,相当于人日用剂量的30倍、20倍、10倍)组,每组10只。各给药组小鼠按20 mL·kg-1体重灌胃給予相应药物,空白对照组和模型对照组灌胃给予等体积蒸馏水,连续7天,每天1次。第7天末次给药1 h后,将小鼠置于2L玻璃钟罩内,超声雾化喷入30%氨水10 s引咳,记录小鼠咳嗽潜伏期(从喷入浓氨水到产生咳嗽的时间为咳嗽潜伏期)及3 min内咳嗽(小鼠出现腹肌收缩、缩胸,张大嘴为咳嗽)次数。
1.2.2 毒理学实验 选取18~22 g小鼠60只,分为3组,每组20只,雌雄各半。禁食不禁水12 h,每天灌胃给药3次,给药间隔4 h,给药体积均为40.0 mL/kg。其中空白对照组给予等体积蒸馏水,石上虾水提物组给予最大耐受浓度药液(1.84 g生药/mL)。给药后即刻及其后14天内,观察记录小鼠出现的中毒症状及死亡情况。观察期结束时,处死全部存活小鼠进行肉眼尸检,以观察内脏的病变。
1.2.3 鉴别 性状鉴别:肉眼观察广东石豆兰并描述相关性状。显微鉴别:制作广东石豆兰假鳞茎、叶和茎的横切面切片以及粉末片,在显微镜下观察并拍图,然后描述相关特征。
薄层色谱:取本品粉末1 g,加甲醇溶液10 mL,超声处理60 min,过滤,残渣加甲醇1 mL使溶解,作为供试液。取对照药材1 g,同法制成对照药材溶液。按照薄层色谱法(《中国药典》2015版四部通则 0502)试验,分别吸取广东石豆兰、对照药材各1~5 μL,分别点于同一硅胶G薄层板上,以石油醚(60~90 ℃)-乙酸乙酯(6∶4)为展开剂,上行展开,展至8 cm,取出,晾干,喷以10%硫酸乙醇溶液,105 ℃加热至斑点显色清晰。同时进行耐用性实验考察:采用点状点样,①对不同预制板(青岛海洋化工厂,批号:20181221,10 cm×15 cm,批号:20191209,10 cm×20 cm;青岛硕远硅胶科技有限公司,批号:20191011,10 cm×10 cm)的展开效果进行考察;②对不同展开温度:12 ℃、25 ℃进行考察;③对不同相对湿度(RH):46%、88%进行考察。
1.2.4 测定 水分测定:按照水分测定法(《中国药典》2015版四部通则 0832第二法)对本品8批样品进行水分测定。灰分测定:按照灰分测定法(《中国药典》2015版四部通则2302总灰分测定法和酸不溶性灰分测定法)对本品8批样品进行总灰分和酸不溶性灰分测定。浸出物测定:分别用水、30%乙醇、50%乙醇、70%乙醇、无水乙醇为溶剂(以GDSDL~1为供试品),照浸出物测定法(《中国药典》2015版四部通则2201)进行预试测定,结果发现热水提取效果最佳,最终确定以水为溶剂,按照水溶性浸出物测定法(《中国药典》2015版四部通则 2201)项下的热浸法,对本品8批样品进行浸出物测定。
2 结果
2.1 化学成分
研究表明,广东石豆兰全草含芪类化合物、多苯酚类、三萜类、甾类及糖苷类等化合物[2]。
2.2 药理作用
实验结果表明:与空白对照组比较,止咳片和广东石豆兰水提物高剂量(7.5 g药材·kg-1)均能减少浓氨水导致小鼠咳嗽潜伏期和咳嗽次数,差异具有统计学意义(P<0.01,P<0.05);广东石豆兰水提物中,低剂量对浓氨水导致小鼠咳嗽潜伏期和咳嗽次数影响不大(P>0.05)。结果见表2。
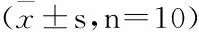
表2 广东石豆兰水提物止咳作用
2.3 毒理学实验
急性毒性试验结果表明,一天给予3次广东石豆兰水提物后,连续观察14天,小鼠状态良好,无死亡情况发生。解剖小鼠,肉眼观察小鼠的脑、心、肝、脾、肺、肾等主要脏器,未发现明显异常。计算空白对照组小鼠体重增长33.5%,计算广东石豆兰水提物组小鼠体重增长率为36.69%;广东石豆兰水提物的最大耐受量为220.80 g生药·kg-1,相当于人用量(0.25 g生药·kg-1)的883倍,说明小鼠在220.80 g生药·kg-1剂量下灌胃给药,未出现急性毒性反应。
2.4 鉴别
2.4.1 性状鉴别 根茎纤细,直径1~1.5 mm,每隔1.4~2.5 cm生一假鳞茎,卵状矩圆形,类圆锥形,长0.8~1.5 cm,直径4~8 mm,表面具细总棱纹,近根茎的一侧具一较宽的凹槽,基部不收缩成柄状,顶端生叶1枚,矩圆形,长1.6~2.7 cm,宽7~11 mm,顶端微凹,基部近无柄。气微,味甘、淡[3]。见图1。

图1 广东石豆兰药材
2.4.2 显微鉴别 假鳞茎横切面:表皮细胞1层,外有较厚蜡质层,形状较小,不规则。基本薄壁组织细胞含草酸钙簇晶,较小,直径8~13 μm,棱角钝;未见草酸钙针晶;外围的维管束外侧有帽状纤维束;中部维管束较大,其内外侧均有纤维束[3]。见图2。
叶横切面:上、下表皮均有较厚的蜡质层,上、下表皮细胞各1列。表皮内均具有1~2层薄壁细胞,叶肉未分化,细胞形状相似,类圆形,细胞排列紧密,胞内多见草酸钙簇晶。外韧维管束间断成排列于叶肉中,外层具石细胞群。偶见下陷气孔[3]。见图3。

1.表皮;2.皮层;3.初生组织;4.草酸钙簇晶;5.纤维束;6.维管束

1.下表皮蜡质层;2.下陷气孔;3.下表皮;4.维管束;5.石细胞群;6.皮层薄壁细胞;7.叶肉;8.上表皮
茎横切面:表皮细胞外有较厚的角质层,表皮细胞1层,形状较小,不规则。皮层较宽,由多层不规则薄壁细胞组成,中间为多个维管束均匀分散分布形成的维管柱[3]。见图4。

1.表皮;2.皮层;3.初生组织;4.维管束
2.4.3 薄层色谱 供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,见图5。耐用性实验结果均表明本法的耐用性良好。

1.GDSDL-1;2.GDSDL-2;3.GDSDL-3;4.GDSDL-4;5.GDSDL-5;6.GDSDL-6;7.GDSDL-7;8.GDSDL-8(对照药材);A.紫色斑点;B.红色斑点;C.红黄色斑点;D.红色斑点
2.5 测定
2.5.1 水分测定 据最高值、最低值及平均值,将本品水分限度拟定为不得过9.5%。结果见表3。

表3 广东石豆兰样品水分测定结果 (%)
2.5.2 灰分测定 总灰分测定结果见表4,据最高值、最低值及平均值,将本品总灰分限度拟定为不得过6.0%。酸不溶性灰分测定结果见表5,据最高值、最低值及平均值,将本品酸不溶性灰分限度拟定为不得过1.3%。

表4 广东石豆兰样品总灰分测定结果 (%)

表5 广东石豆兰样品酸不溶性灰分测定结果 (%)
2.5.3 浸出物测定 结果见表6,据最高值、最低值及平均值,将本品浸出物限度拟定为不得少于20%。

表6 广东石豆兰样品浸出物测定结果 (%)
3 结论
本研究分析了广东石豆兰的生药学研究资料,包括化学成分、药理作用、毒理学、性状鉴别、显微鉴别、薄层色谱鉴别、水分测定、灰分测定及浸出物测定,可为该药材的进一步研究提供参考。

