miR-222 靶向BBC-3基因对肝癌细胞增殖凋亡的调控研究
孙景武 刘志春 党存曙 刘 彬 邢恩涛
微小RNA是1类长度为22nt大小的小分子非编码RNA,其主要是通过与靶基因的mRNA 3'端完全或不完全互补结合而调控基因的表达,进而对细胞的增殖、分化以及凋亡产生影响[1-2]。miR-22是1种较常见的致癌miRNA,其在细胞内的表达会影响多种肿瘤细胞的增殖、凋亡以及侵袭能力[3-4]。
BBC-3基因即p53上调凋亡调控因子(p53 up-regulated mod-ulator of apoptosis,PUMA),是1种促凋亡基因[5],因p53因子可以迅速诱导其产生强大的促凋亡作用而得名。BBC-3作为p53的下游靶基因,在p53依赖和非依赖途径凋亡过程中均发挥重要的作用。有研究表明,BBC-3与肝癌、直肠癌、口腔癌以及乳腺癌等多种恶性肿瘤的发生发展有密切关系[6-9]。
前期利用生物信息学和荧光素酶报告研究表明,miR-222可以与3'UTR基因位点直接结合而共同调节BBC-3基因的表达,而促进细胞发生凋亡[10]。Zhang等[11]的研究报告表明,miR-222联合基因转染乳腺癌、胶质母细胞瘤以及肺癌后BBC-3基因的表达升高,促进肿瘤细胞凋亡。本研究通过miR-222转染进入HepG细胞后,BBC-3基因表达水平的变化,并检测HepG细胞的增殖及凋亡能力,从而为肝癌基因新的治疗方式提供依据。
1 材料与方法
1.1 材料与试剂
miR-222与miR-222 inhibitor均由上海生物工程技术有限公司合成;HepG2肝癌细胞系购自中国科学院上海细胞库;胎牛血清(fetal bovine serum,FBS)、RPMI 1640培养基、胰酶均购自Sigma公司:LipofectamineTMRNAiMAX转染试剂与Trizol均购自美国Invitrogen公司;细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、Western-blot电泳液和转膜液、MTT均购自宝生物工程(大连)有限公司;BBC-3抗体、抗兔IgG二抗均购自艾美捷科技有限公司;FITC和PI的细胞凋亡试剂盒购自Thermo Fisher公司。
1.2 合成的引物序列
miR-222引物序列:F:5'-ACACTCCAGCTGGGAGCTACATCTGGCTACTG-3',R:5'-CTCAACTGGTGTCGTGGA-3';内参U6引物序列:F:5'-CTCGCTTCGGCAGCACA-3',R:5'-AACGCTTCACGAATTTGCGT-3';BBC-3引物序列:F: 5'-CAGGAAAGGCTGTTGTGCTG-3',R:5-AGTGGTCACGTTTGGCTCAT-3';内参片段18S引物序列为:F:5'-CCTGGATACCGCAGCTAGGA-3',R:5 '-GCGGCAATACGAATGCCCC-3'。
1.3 细胞培养与转染
HepG2细胞培养于RPMI 1640培养基(含10%FBS、100 U/ml青霉素、100 U/ml链霉素)中,置于37 ℃、5%CO2培养箱中,每24 h换液1次。细胞生长铺满瓶底约80%时,加入0.25%胰蛋白酶和0.05%EDTA进行消化。取对数生长期的细胞,以每孔1×105个的密度接种于6孔板上,在CO2培养箱中培养过夜。待细胞生长至60%~80%时,吸去完全培养基,用PBS重新2遍,在每孔加入1 ml无抗生素和血清的opti-MEM培养基。吸取10 μl 20 μmol/l的miR-222和miR-222 inhibitor溶解于opti-MEM培养基中,混匀静置;将5 μl LipfectamineTM RNAiMAX加入500 μl opti-MEM培养基中,混匀静置。5 min后将上述两种溶液混合,静置20 min,分别加入各孔中,放入CO2培养箱中,4~6 h后,加入转染培养基,每孔加入2 ml含血清的完全培养基。
1.4 RT-PCR检测细胞中基因表达
转染24 h后收集培养的细胞,加入Trizol试剂并提取细胞总RNA,按照试剂盒说明书合成cDNA。miR-222反应体系为:cDNA 5.0 μl;上游引物0.5 μl;下游引物0.5 μl;2×SYBR Green PCR Master Mix 10 μl;加超纯水Total 20 μl。
反应条件:95 ℃变性5 min,95 ℃ 45 s、60 ℃退火15 s、72 ℃延伸32 s,40个循环,72 ℃ 10 min。BBC-3反应体系及反应条件同miR-222。
1.5 Western blot检测细胞BBC-3蛋白的表达
转染48 h后,分别提取三组细胞的总蛋白,测定蛋白浓度,经SDS-PAGE后转移到PVDF膜,用5%脱脂奶粉室温封闭1 h,加入稀释好的BBC-3待检蛋白和内参GAPDH一抗,4 ℃过夜,TBST洗涤3次,每次5 min,加入二抗在室温孵育1 h,TBST洗涤3次,每次5 min,ECL试剂盒显影,凝胶成像系统拍照,表达强度以目的蛋白与内参蛋白的灰度值之比表示。
1.6 MTT法检测细胞增殖
取处于对数生长期的细胞,以5×103个/孔接种在96孔板上,三组均设置3个复孔。空载体对照组用含10%FBS的RPMI 1640溶液进行培养,转染组分别把miR-222与miR-222 inhibitor转入细胞内,操作同1.3,在转染后的24、48、72 h三组细胞均加入5 mg/ml的MTT溶液,37 ℃ CO2放置4 h,吸去上清液,每孔加入100 μl DMSO溶液,震荡溶解紫色晶体,在490 nm波长的酶标仪测定吸光度值,检测三组细胞的生殖情况。
1.7 流式细胞仪检测细胞周期及细胞凋亡率
转染48h后,每组收集1~5×105个细胞,PBS清洗并用70%乙醇固定,过夜,离心收集细胞,PBS洗涤1次,加入500 μl的50 μg/ml的PI、0.2%Triton X-100的PBS以及100 μg/ml 的RNase A,4 ℃避光孵育30 min,利用流式细胞仪检测各组细胞周期;按上述同样方法收集洗涤的细胞,无需乙醇进行固定,加入AnnexinV-FITC,室温避光孵育15 min,以1 500 r/min离心5 min,去除上清,用预冷的缓冲液将细胞重悬,加入PI,利用流式细胞仪测定各组细胞凋亡率。
1.8 统计学处理
应用SPSS 22.0统计软件进行数据处理,两组间均数比较采用t检验,两组间率的比较采用四格表资料的χ2检验结果,P<0.05认为有差异统计学意义。
2 结果
2.1 荧光倒置显微镜下观察转染效率
空载体转染组、miR-222转染组和miR-222 inhibitor转染组转染24 h后,荧光倒置显微镜下观察各组细胞中红色荧光,miR-222转染组和miR-222 inhibitor转染组的均成功进行转染,而空白对照组荧光较少。
2.2 转染后miR-222的表达
转染48 h后,RT-PCR检测空载体、miR-222 inhibitor和miR-222转染组中miR-222 RNA相对样品初始模板量的表达水平分别为(460.09±45.77)、(429.34±36.78)和(1.00±0.08),miR-222转染组细胞miR-222表达明显下调,与空载体和miR-222 inhibitor转染组相比具有差异统计学意义(P<0.01):而miR-222 inhibitor转染组与空白对照组相比,miR-222表达水平差异无统计学意义(P>0.05)。见图1。

图1 RT-PCR检测转染后miR-222的表达情况
2.3 转染后BBC-3蛋白的表达水平
Western blot检测结果表明,miR-222转染组细胞BBC-3蛋白的表达水平与空载体转染组和miR-222 inhibitor转染组相比表达显著增加。利用软件AlphaView计算空载体转染组、miR-222 inhibitor转染组、miR-222转染组的BBC-3蛋白与内参GAPDH蛋白的灰度值之比,分别为(1.29±0.13)、(1.32±0.09)和(1.85±0.15),miR-222转染组与空载体和miR-222 inhibitor转染组转染相比BBC-3基因表达明显增加,具有差异统计学意义(P<0.01),表明miR-222基因转染上调BBC-3基因表达,见图2和图3。

图2 转染后BBC-3蛋白的表达情况

图3 不同转染组BBC-3蛋白与内参灰度值之比
2.4 转染对肝癌HepG2细胞增殖的影响
MTT法检测细胞增殖结果表明,24 h、48 h、72 h时miR-222转染组吸光度值均小于空载体转染组和miR-222 inhibitor转染组,miR-222转染组细胞增殖能力明显低于空载体转染组和miR-222 inhibitor转染组(P<0.05),表明下调miRNA-222水平可抑制肝癌HepG2细胞增殖,见表1。
2.5 转染后细胞凋亡率的变化
三组细胞的凋亡率分别为2.65%、2.72%和13.58%,miR-222转染组与空载体转染组和miR-222 inhibitor转染组相比较细胞凋亡率增加,差异有统计学意义(P<0.01)。
3 讨论
BBC-3是新发现的具有强大促凋亡作用的Bcl-2蛋白家族中的一员,作为p53的靶基因,是p53诱导凋亡途径中的关键介导者。研究结果表明,无论是由射线、缺氧、药物、DNA损伤等引起的内源性p53表达上调还是p53外源性转染,其引发的促细胞凋亡作用均是通过上调BBC-3基因表达介导的,BBC-3突变或缺失可导致细胞凋亡率降低[12-13],说明BBC-3是凋亡通路的关键基因。近年来相继有学者研究发现,BBC-3在许多恶性肿瘤的发生、发展及治疗过程中均有强大的促凋亡作用。肿瘤是异常基因表达的结果,miRNA表型实验表明许多miRNAs在多种肿瘤中异常表达,主要通过靶分子识别、癌基因或抑癌基因、突变或含有miRNAs染色体片段缺失3种机制参与癌症发生。特定的miRNAs表达改变可启动和促进肿瘤发生,部分组织中miRNAs可能扮演着癌基因或者抑癌基因的角色[14-16]。MiR-222是常见的致癌miRNA之一,其表达上调与多种肿瘤细胞的增殖、侵袭、凋亡能力有关。有学者研究发现,肝细胞生长因子受体可转录活化c-Jun,从而上调miR-221/222表达,上调的miR-221/222作用于PTEN和TIMP3,拮抗TNF相关凋亡诱导配体(TRAIL)引起的凋亡.增强肝癌细胞的恶性生物学特性[17]。Pineau等[18]在对人体肝癌组织及肝癌细胞的研究中进一步证实了上述观点,此外还发现miR-221/222可以通过下调p27Kipl表达增强肝癌细胞的增殖能力。
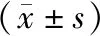
表1 MTT检测不同转染时间细胞增殖情况
注:miR-222转染组与空载体转染组比较:*为P<0.05;miR-222转染组与miR-222 inhibitor转染组比较:△为P<0.05。
利用生物信息学软件分析肝癌组织中与BBC-3基因密切相关的miRNAs时发现,sIANAmT、miRanda、miRwalk、RNAhybrid、PITA、Targetscan等八大靶基因预测数据库均显示miR-222与BBC-3基因高度相关。肝癌中有关miR-222与BBC-3的关系尚无明确报道.但其在某些肿瘤中已有相关研究。Zhang等研究发现,神经胶质瘤组织中miR-221/222含量降低可诱导BBC-3基因表达,促进细胞凋亡,显著抑制异种移植瘤的生长,表明miR-221/222与BBC-3间存在相反关系,miR-221/222通过靶向调节BBC-3表达直接促进神经胶质瘤细胞凋亡,可作为潜在的治疗神经胶质瘤的靶点。在对人类上皮癌细胞的研究中进一步发现,miR-221/222含量降低可抑制乳腺癌、肺癌等上皮癌细胞增殖.诱导线粒体介导的凋亡。
近年来,效果还有一定差距,可能与miR-222对肝癌细胞抑制作用的具体机制及其有其他作用靶点等有关,有待进一步研究。随着研究的不断深入。miR-222基因转染靶向调控BBC-3基因表达促进细胞凋亡有望为临床治疗肝癌提供实验依据。在恶性肿瘤发生、发展中的作用受到越来越多的关注,但其在口腔癌中的研究却明显滞后,miR-222靶向调节BBC-3基因表达促进细胞凋亡的具体机制还有待证实。本研究通过miR-222基因转染抑制细胞内miR-222表达,敲低内源性miR-222表达量。RT-PCR结果表明,下调miR-222可诱导促凋亡基因BBC-3表达增加,两者间存在反向关系,Western blot在蛋白水平上进一步证实了该观点。MTT细胞增殖实验结果显示,miR-222表达量降低,HepG2细胞增殖速度明显下降,在肝癌中miR-222发挥着促癌作用。通过流式细胞仪分析细胞周期和凋亡率得知,miR-222转染组较其他两组而言G1期细胞数明显增多,细胞凋亡率显著增高,证明miR-222表达降低可影响HepG2细胞周期,促进细胞凋亡,进而发挥抗癌作用。结果与Zhang等在人类上皮细胞癌中的研究结果相吻合。但该实验中,实验组细胞凋亡率为13.58%,虽然较对照组细胞凋亡率明显增高,差异有统计学意义,但是距离肿瘤的理想治疗效果还有一定差距,可能与miR-222对肝癌细胞抑制作用的具体机制及其有其他作用靶点等有关,有待进一步研究。随着研究的不断深入。miR-222基因转染靶向调控BBC-3基因表达促进细胞凋亡有望为临床治疗肝癌提供实验依据。

