经内镜放射状切开术在治疗结直肠吻合口良性狭窄中的临床应用
詹磊磊,刘宇虎,陈桂权
(广东省东莞市人民医院 消化内科,广东 东莞 523000)
吻合口良性狭窄是结、直肠术后较为常见的并发症,尤其以下段直肠吻合口狭窄居多,发生率约为5.8%~22.0%[1-2]。造成吻合口良性狭窄的原因较多,如手术方式不当、吻合口感染和缺血低氧等,以及随着吻合器的广泛应用,均可增加吻合口良性狭窄的发生率[3-4]。目前,内镜下球囊扩张术(endoscopic balloon dilatation,EBD)被认为是治疗吻合口良性狭窄的首选方法[5],操作简单、安全,近期疗效明显,但远期复发率较高,约为18.0%~20.0%,往往需接受多次扩张或改行其他治疗[6]。近年来,有学者尝试将内镜下电切术(endoscopic electrocautery incision,EECI)或电切联合EBD应用于吻合口狭窄治疗[7]。本研究将采用前瞻性的方法,探讨经内镜下放射状切开术在治疗结直肠吻合口良性狭窄中的有效性和安全性。
1 资料与方法
1.1 一般资料
纳入2015年1月-2016年12月在本院确诊为结直肠术后并吻合口狭窄的患者46例。其中,男28例,女18例,年龄(50.2±7.3)岁,肠道梗阻评分为(6.1±2.8)分。吻合口狭窄病因中,结直肠癌术后37例(80.4%),痔上黏膜环切术(procedure for prolapse and hemorrhoids,PPH)后3例(6.5%),结肠外伤2例(4.3%),其他原因4例(8.7%)。缝合方法中,吻合器吻合26例(56.5%),手缝吻合9例(19.6%),术式不详11例(23.9%)。狭窄位置中,右半结肠4例(8.7%),左半结肠42例(91.3%)。狭窄直径(D)≤2 mm为12例(26.1%),2<D≤5 mm为15例(32.6%),5<D≤10 mm为19例(41.3%)。狭窄既往干预治疗,EBD 16例(34.8%),手指扩肛3例(6.5%),自膨胀金属支架扩张6例(13.0%)。
入组标准:①肠道梗阻症状单项评分为13分或积分≥13分者;②结直肠术后吻合口明显狭窄,内镜无法通过;③所有患者吻合口均多点活检(≥4块,四象限至少各1块),病理提示良性病变。排除标准:①合并严重心血管系统、呼吸系统、凝血障碍和严重贫血等肠镜检查及治疗禁忌证;②合并吻合口瘘;③合并恶性肿瘤;④炎症性肠病(inflammatory bowel disease,IBD)术后并狭窄;⑤患者不接受内镜下放射状切开治疗。所有患者术前均告知内镜下放射状切开术的优势及风险,并详细告知其他替代治疗方案(外科手术、球囊扩张术和支架置入术),患者均签订了肠镜检查治疗知情同意书,本研究通过了医院医学伦理委员会同意。
1.2 研究方法
1.2.1 研究设备及药物操作设备采用Olympus CV-260SL主机、Olympus CF-H260AI肠镜、KD-611L IT刀(Olympus)和VIO 200 D+APC2内镜工作站(德国爱博ERBE),注水设备采用OFP(Olympus),注气设备采用CUR(Olympus),二氧化碳CO2气泵、图像采集及编辑系统采用Neusoft PACS/RIS东软系统。药物采用复方聚乙二醇电解质散(舒泰清,舒泰神北京生物制药股份有限公司),使用咪达唑仑注射液5.0 mg(北京费森尤斯卡比公司)、盐酸哌替啶注射液100.0 mg(东北制药集团公司沈阳第一制药厂)和盐酸屈他维林注射液40.0 mg(杭州赛诺菲安万特民生制药有限公司)。
1.2.2 内镜下放射状切开术①术前准备:半流质饮食3 d,流质饮食1 d,检查前禁食10 h、禁饮4 h,检查前8 h服用复方聚乙二醇(舒泰清12包溶于2 000 ml水中,1 h内服完)完成肠道准备;治疗前患者均静推咪达唑仑2.5~5.0 mg+哌替啶30.0~60.0 mg(QD)基础麻醉,肌注屈他维林40 mg(QD)解痉,肠镜注气采用CO2气泵;②内镜下放射状切开术:内镜直视下对狭窄的范围、程度进行评估,或经活检孔道插入冲水管,注入水溶性造影剂泛影葡胺,数字减影血管造影(digital subtraction angiography,DSA)透视下对其进行评估;然后在内镜视野下将前端绝缘的IT刀插入狭窄区域,采用电凝电切双峰电流,对狭窄区域行放射状切开,一般行3~6个径向切开,所需切割的长度和深度均由内镜医生自主评估(附图),操作均为同一高年资内镜医生完成;③术后患者禁食补液1或2 d,逐渐开始行无渣、少渣饮食,观察有无发热、腹痛和便血等症状,出院后患者均随访1年。
1.2.3 相关评价指标肠道梗阻量化指标[4]:①不同表现打分:游离气体13分;弥漫性腹膜炎13分;肠蠕动消失13分;肠蠕动减弱3分;呕吐4分;局限性腹膜炎3分;气过水声3分;持续性绞痛3分;血性呕吐物或血便5分;②X线分期:液平面≤3 cm为1分;液平面宽≥3 cm、气柱偏低3分;液平面窄、气柱高耸、呈阶梯状排列5分;③白细胞计数(white blood cell,WBC)>11×109/L 3分;④血钾≤3 mmol/L 3分。单项评分为13分或积分≥13分者,提示有绞窄性肠梗阻可能,有手术指征。积分<13分者可先行非手术治疗,经过进一步检查治疗明确梗阻部位及性质,再决定治疗方法。
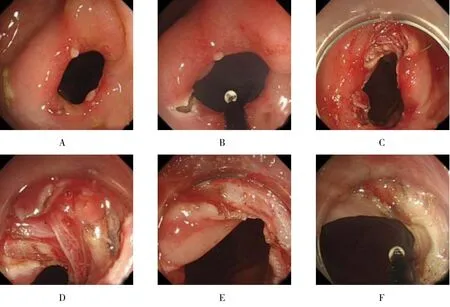
附图 内镜下所示Attached fig.Imaging of endoscopy
1.3 统计学方法
应用SPSS 19.0软件包进行统计分析,正态分布计量资料采用均数±标准差(±s)表示,计数资料采用百分比(%)表示,计量资料比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 经内镜下放射状切开术的有效性和安全性评估
46例结直肠吻合口良性狭窄患者经内镜下放射状切开术治疗成功45例(97.8%),治疗失败1例患者改外科手术;操作时间为12~36 min,平均18 min,术后患者肠道梗阻评分较入院时明显降低,差异有统计学意义[(1.1±0.5)vs(6.3±2.8)分,P<0.05],所有患者肠道梗阻症状均得到明显缓解。45例治疗成功的患者,术中、术后均未出现穿孔、感染及出血、腹痛等并发症(出血:指需要输血HB<60 g/L;疼痛:指需要止痛药物干预,主诉疼痛分级法(verbal rating scales,VRS)疼痛评分≥Ⅱ度)。
2.2 随访
45例患者出院后均随访1年,包括门诊及内镜随访,失联4例,完成随访共41例(91.1%),随访期间所有患者均未出现肠道狭窄症状及吻合口复发。
3 讨论
结肠或直肠切除的患者中,部分患者可发生良性吻合口狭窄[1-2],并且随着吻合器的广泛使用,狭窄发生率呈上升趋势[3-4]。造成狭窄的原因很多,组织的炎症与纤维化是最终的结局,当广泛纤维化时,会破坏正常的解剖平面,使外科干预变的困难,大多数观点建议尽可能的延后再次手术[6-8]。早期内镜干预可打破纤维化的恶性循环和持续的狭窄,提高患者的生活质量[9],目前EBD被认为是首选的治疗方法[5],多项研究表明[5-6,9-10]此方法的安全性和有效性。然而,因瘘口等某些原因导致狭窄组织广泛纤维化缺乏弹性,或者由于狭窄位于偏心位等情况,导致EBD首次治疗后吻合口狭窄复发率高,往往需要多次扩张或改行其他治疗[6],并且球囊扩张中不受控制的拉伸将导致结肠穿孔,这也是其潜在的治疗风险。内镜下放射状切开术可在预先确定的狭窄部位进行可控的黏膜切开,尤其针对严重狭窄、扩张无效的患者优势明显。国外JAIN等[9]在一项Mata分析中提出,经内镜下放射状切开术无论是单独还是与其他形式(如球囊扩张、类固醇注射或氩气凝固)联合使用,都是治疗肠道吻合口良性狭窄的有效方案,此技术在国内已部分开展,但尚未见到具体报道。本研究将采用前瞻性的方法探讨经内镜下放射状切开术在治疗结直肠吻合口良性狭窄中的有效性和安全性。
大多数的研究[4-8]都将吻合口狭窄定义为内镜无法通过。因内镜直径大小不同,狭窄的定义存在一些差异,也有少部分研究使用放射技术,如钡灌肠、CT扫描来定义狭窄[9]。一般来说,直径<10 mm的狭窄会出现梗阻性症状,与狭窄程度呈正相关,笔者将吻合口直径≤10 mm定义为狭窄,并剔除炎症性肠病,主要考虑狭窄复发与病变本身特点有较大相关性;患者术前均予基础麻醉,肠镜注气采用CO2,本研究团队已做过CO2的安全性报道[11]。本研究共纳入46例患者,治疗成功45例,治疗成功率为97.8%,治疗失败1例,考虑原因为吻合口狭窄范围过大,增加内镜下放射状切开治疗的风险与难度,故转外科手术,术后患者梗阻症状缓解,术后3个月复查肠镜未见狭窄。而治疗成功的45例患者术中、术后均未出现穿孔、感染及严重的出血、腹痛等并发症,仅5例患者出现轻微便血,常规予止血和解痉等治疗,未予输血、内镜干预,均可缓解。45例患者经内镜放射状切开治疗后,排便困难、腹胀和腹痛等肠道梗阻症状均得到明显缓解,这和BRANDIMARTE等[12]和OSERA等[13]报道是相似的。值得注意的是,46例患者中25例患者之前已经接受过≥1次的其他治疗,如EBD、手指扩肛和支架置入等。所有患者随访1年均未出现肠道梗阻症状及吻合口狭窄,说明此方法对治疗结肠吻合口良性狭窄具有一定的优势,对于是否可做为治疗吻合口狭窄的首选方法,还需要多中心、大样本的研究,并且还需与其他治疗方法做对照研究。

