臭氧在醋酸溶液中溶解及稳定性研究
詹琪琪,阎 杰,周国豪
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.仲恺农业工程学院化学化工学院,广东 广州 510225)
【研究意义】臭氧是当前公认的强氧化剂,它具有高效的消毒灭菌能力[1],无二次污染,完全符合当今社会绿色环保无污染的发展潮流。因此,无论在国内还是国外,臭氧都被广泛地应用在水处理、食品加工、医疗、运输、储存、农业等各个领域。但是,臭氧不能贮存,极不稳定[2],在常温常压下会缓慢分解成氧气。研究臭氧的溶解特性,提高其溶解度具有非常重要的意义,能为更好地开发利用臭氧技术起到一定的铺垫作用。【前人研究进展】关于臭氧稳定性的相关报道,国外有Tomiyasu等[3]、Taube等[4],国内有王华然等[5]研究了臭氧在水中的溶解特性及影响因素,发现水温升高导致臭氧溶解度下降,发生器的气体流量和水中色度会对臭氧在水中的溶解度产生影响。为了解决臭氧在水中的稳定性问题,许伟坚[6]选择聚丙烯酰胺水溶胶来溶解臭氧,结果显示,2.0 g/L聚丙烯酰胺臭氧水溶胶所得的初始臭氧浓度及半衰期数据最理想,但溶胶在使用中不方便,其残留物对环境带来不良影响,而聚丙烯酰胺分子量大,易被氧化和降解,且单体丙烯酰胺对人体不利。有文献认为OH-是臭氧分解的催化剂[7],添加醋酸[8]和柠檬酸可以降低溶液中OH-的浓度,从而抑制臭氧分解,对比试验显示醋酸的效果优于柠檬酸。方敏等[9]试验证实,醋酸、柠檬酸可以大大提高臭氧的稳定性,但酸性过强会加速臭氧分解。最近有研究发现,增强臭氧的碱性反而可以提高臭氧的稳定性,能有效地减少臭氧的分解[10]。而王华然等[5]的试验却表明,pH值对臭氧在水中的溶解无显著影响。
【本研究切入点】 那么,酸度对臭氧在水中的溶解度及稳定性到底有何影响,酸的类型、浓度、温度及水质对其是否会有影响,类似问题未见系统报道。【拟解决的关键问题】本研究针对醋酸浓度、温度、水质等对臭氧在醋酸溶液中的溶解度以及稳定性进行试验,探索醋酸浓度、温度、配制醋酸溶液的水质、通入臭氧后的放置时间、处理时间等因素对臭氧在醋酸溶液中的浓度的影响,找出影响臭氧在醋酸溶液中溶解度的因素,并得出臭氧在醋酸溶液中溶解度最高的最佳条件,以期为臭氧技术在食品领域中深入开发利用奠定实践基础。
1 材料与方法
1.1 试验材料
试剂:碘化钾、冰醋酸、浓硫酸、硫代硫酸钠、可溶性淀粉、重铬酸钾均为分析纯,去离子水、超纯水均为实验室自制(无特别说明,试验中用水均为去离子水)。
仪器:鼓风恒温干燥箱,上海迅能电热设备有限公司;臭氧发生器,臭氧产生量5 g/h,广州佳环电器科技有限公司;傅里叶变换红外光谱仪,美国PE公司;电冰箱、电加热炉、电子天平、搅拌水浴锅。
1.2 试验方法
操作方法:(1)配制0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1 mol/L共10个不同浓度的醋酸溶液,在25℃条件下,分别通入臭氧处理10 min,取样测定每个样品中的臭氧浓度。
(2)分别用自来水、去离子水和超纯水配制醋酸浓度为0.6 mol/L的醋酸溶液,在25℃条件下,通入臭氧处理10 min,取样测定每个样品中的臭氧浓度。
(3)配制浓度为0.6 mol/L的醋酸溶液,在25℃条件下,通入臭氧处理10 min,分别放置30、60、90、120、150、180 min,在每个放置时间后取样测定样品中臭氧浓度。与此同时,让臭氧通入去离子水作对照,在一样的温度、臭氧处理时间以及通气之后放置相同时间段测定样品中的臭氧浓度。
(4)配制4份浓度为0.6 mol/L的醋酸溶液,在25℃条件下,其中1份通入臭氧处理10 min之后放置3 h,1份通入臭氧20 min之后放置3 h,1份通入臭氧处理10 min未放置,1份不做处理,分别用红外光谱分析醋酸的结构。
(5)配制浓度为0.6 mol/L的醋酸溶液,通入臭氧处理10 min,分别在5、20、30、40、50℃条件下取样测定样品中的臭氧浓度。
(6)配制浓度为0.6 mol/L的醋酸溶液,在温度25℃的条件下,分别通入臭氧处理10、20、30、40、50、60、70 min,在每个时间段取样测定样品中的臭氧浓度。
臭氧浓度测定参照文献[11],采用碘量法测定。如无特别说明,均在臭氧处理后立刻测定。
红外分析采用KBr压片,用红外光谱分析醋酸的结构,扫描波长450~4 000 cm-1。
2 结果与分析
2.1 水中添加剂的选择
由于O2的两个氧原子共用1对电子,是直线型,因此属于非极性分子。而臭氧结构中的中心氧原子供给的2个电子部分为两边的配位氧原子所有,即发生了离域,致使中心氧原子显得正一些,两边氧原子显得负一些。因此臭氧分子中的键矩不等于零,键有极性。而且其分子结构又不对称,因此臭氧分子有偶极矩而显极性。水属于极性分子,根据相似相溶原理,臭氧应易溶于水,但事实上臭氧在水中溶解度并不高,且稳定性也不好。有文献报道了一种大幅度提高臭氧在水中溶解度和稳定性的方法[12],就是在水中加入含氧有机化合物,这种方法简单、方便、成本低。臭氧氧化性很强,电对O3/O2的标准电极电势为1.24 V,一些具有还原性的有机化合物在水溶液中易于被臭氧氧化,基于这一点,再结合溶解性考虑,添加低分子有机酸应为优先选择。从偶极矩上看,醋酸为5.60,甲酸为6.07,水为6.17[13-14],臭氧为0.53~0.55[15],醋酸与臭氧的差异比甲酸小,而且醋酸无毒无害广泛用于食品领域。因此本研究选择醋酸作为溶剂。
2.2 醋酸浓度对臭氧稳定性的影响
从图1可以看出,在相同的试验条件下,醋酸浓度0.1~0.6 mol/L范围内,随着醋酸浓度增大,溶液中臭氧浓度增大;当醋酸浓度大于0.6 mol/L时,随着醋酸浓度增大,溶液中的臭氧浓度逐渐减小。方敏等[9]在研究臭氧在不同pH下的分解速率时发现,臭氧分解速率与pH呈不规则的“U”型,pH在3~4时,分解速率最低,当pH大于4,随着pH增大,分解速率不断增加;当pH小于3,随着pH减小,分解速率也不断增加。代欣欣等[16]在研究水中臭氧溶解特性时发现OH-在臭氧分解反应中起着重要的催化作用。醋酸浓度增大时,溶液中的OH-减少,OH-的催化作用减弱,因此臭氧的分解减慢,稳定性提高,溶解度增大[17]。本试验获得高浓度臭氧的最适醋酸浓度为0.6 mol/L。

图1 不同醋酸浓度下臭氧浓度的变化Fig. 1 Change of ozone concentrations under different acetic acid concentration
2.3 水质对臭氧稳定性的影响
从图2可以看出,在相同的试验条件下,不同水质配制的醋酸溶液中,臭氧的溶解度依次为超纯水>去离子水>自来水。许荣年等[18]在研究臭氧对水质的影响时,发现良好的过滤装置能使饮用水通过滤膜阻止细菌、霉菌、藻类的通过,还可去除杂质及部分有机物而变得澄清,使后期臭氧处理消耗更少的臭氧量,说明水越纯净,其含有的离子、杂质和矿物质等物质越少,臭氧在水中的分解速率则越慢,稳定性就越强,溶解度越大。方敏等[9]在研究臭氧水稳定性时,也证实了臭氧在水溶液中的稳定性与水质有关。孙广明等[19]在研究臭氧特性及对水质的净化作用时,通过实验证明了臭氧在不同类型水中的分解速度有所不同,即水的纯度高,臭氧分解慢,臭氧水稳定性就好;反之,水质差,臭氧分解快,臭氧水就不稳定。
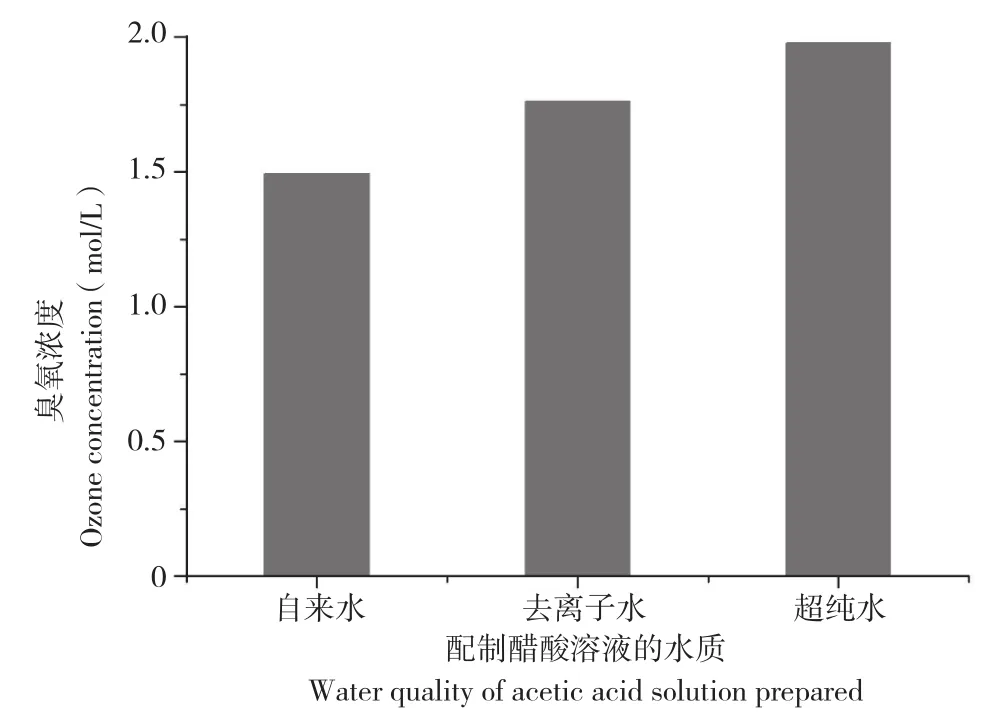
图2 不同水质下臭氧浓度的变化Fig. 2 Changes of ozone concentrations under different water quality
2.4 放置时间对臭氧稳定性的影响
从图3可以看出,在相同的试验条件下,随着放置时间的增加,醋酸溶液中的臭氧浓度急剧下降,当放置时间延长时,溶解的臭氧会有一部分挥发到空气中,还有部分分解成氧气,导致溶解度下降;在相同时间下,醋酸溶液中的臭氧浓度比去离子水中高,这表明臭氧在醋酸溶液溶液中比在水中更稳定,加入少量醋酸利于臭氧贮存。从图4可以看出,臭氧处理后放置3 h的醋酸有较为尖锐的吸收峰,其谱峰3 468 cm-1、3 437 cm-1、3 467 cm-1归属于O-H引起的伸缩振动,谱峰 1 643 cm-1、1 638 cm-1、1 640 cm-1归属于C=C引起的伸缩振动,谱峰685 cm-1、676 cm-1归属于C-O引起的伸缩振动。而臭氧刚处理完的醋酸以及未处理的醋酸的峰值不同,说明生成的O-H键和C-O导致吸收峰移动,从而造成它们的峰值有所偏移。
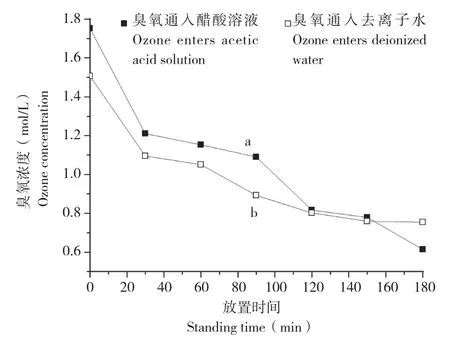
图3 不同放置时间下臭氧浓度的变化Fig. 3 Changes of ozone concentrations at different standing time
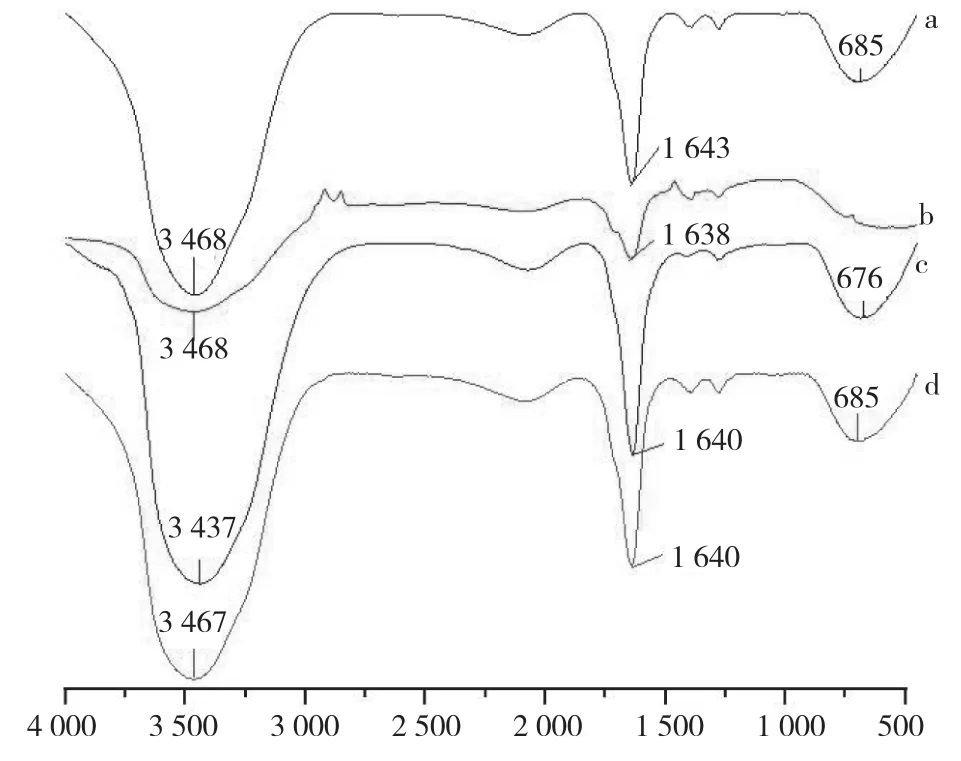
图4 经臭氧处理醋酸的红外图谱Fig. 4 Infrared map of acetic acid treated by ozone
2.5 温度对臭氧稳定性的影响
图5显示,随着温度上升,醋酸溶液中的臭氧浓度迅速减少。张晖等[20]在研究水中臭氧分解动力学时,发现温度的升高必然加速臭氧的自分解,臭氧在水中的分解实质上是通过一系列的中间过程,最后生成氧气的化学反应,水温升高,该化学反应就加快。方敏等[9]也同样证实了水温越低,臭氧分解越慢,反之,水温升高,臭氧分解加快。这些报道与本试验结果一致,因此适当降低温度,有利于获得高浓度的臭氧溶液。
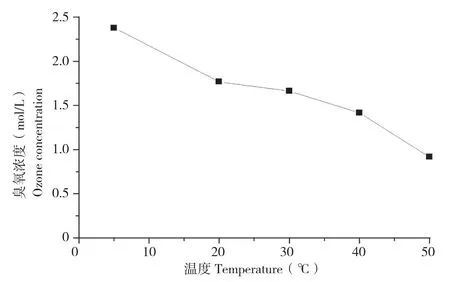
图5 不同反应温度下臭氧浓度的变化Fig. 5 Changes of ozone concentrations at different reaction temperatures
2.6 通入臭氧气体时间对臭氧稳定性的影响
从臭氧处理后未放置立刻测定的结果(图6)可以看出,在相同的试验条件下,随着通入臭氧时间延长,醋酸溶液中的臭氧浓度增加,但是当通气时间达到一定程度时,溶液中的臭氧浓度就慢慢地饱和,渐渐趋于平衡。通气时间长,臭氧慢慢溶解在水中,水中溶解臭氧容量不断增大,因此水中臭氧浓度也逐渐增大;当臭氧的溶解度达到平衡,则不再继续溶解于水中,呈现平稳的状态。醋酸溶液经臭氧处理20 min且放置3 h之后,取样测定,结果溶液中醋酸浓度仍为0.6 mol/L。且该样品的红外图谱(图4)与未处理的醋酸溶液无明显差异,这说明本试验条件下,醋酸没有分解,结构无明显变化。
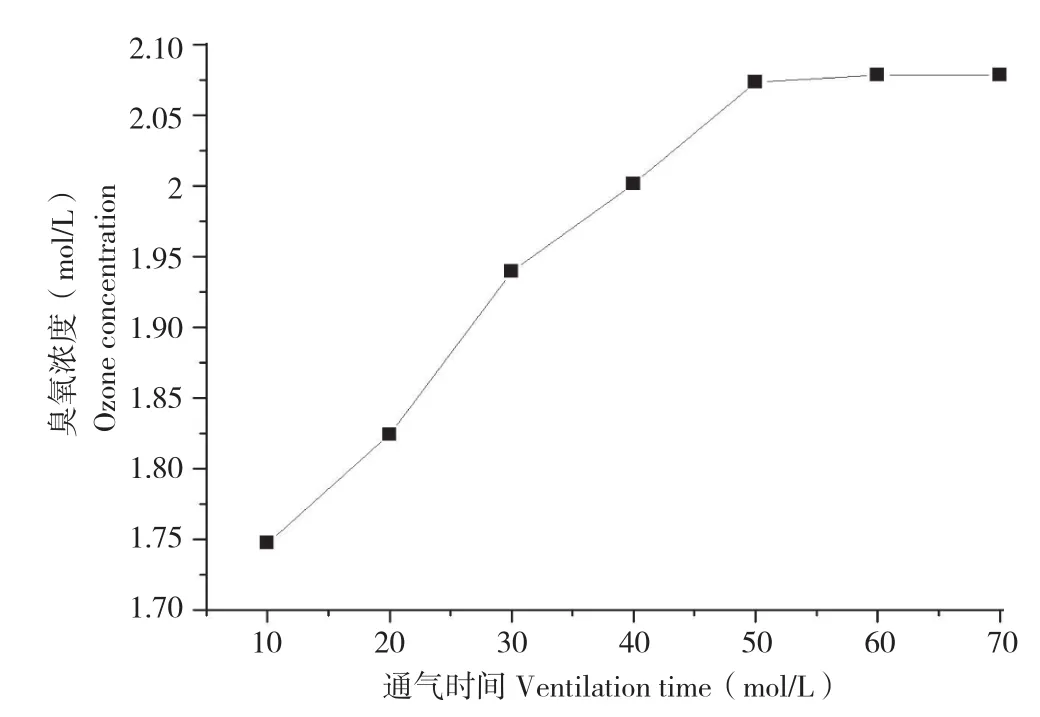
图6 不同通气时间臭氧浓度的变化Fig. 6 Changes of ozone concentrations at different ventilation time
3 讨论
方敏等[9]与单于[10]、王华然等[5]对臭氧稳定性的试验结论不同。方敏等[9]做了pH对臭氧分解速率的影响,根据他们的试验结果进行分析,可以看出当溶液pH在3~4时,臭氧分解速率最低。他们的试验同时显示,在水中加入少量的醋酸或柠檬酸可以提高臭氧的稳定性,当醋酸浓度为100 mg/kg时,臭氧的半衰期为299 min。经笔者理论计算,此时溶液的pH值为4.38。本论文的试验显示,醋酸浓度0.6 mol/L对提高臭氧浓度最佳,过高、过低均不好,经理论计算,此时醋酸溶液的pH值为2.49。可见,本试验结果与方敏等的试验结论类似。综合方敏等[9]及本试验结果可以看出,不同pH值对臭氧在水中的稳定性影响很大,最佳的pH值在2.5-4.4范围的可能性最大,这有待于进一步试验。
孙广明等[19]试验显示水纯度高对臭氧在水中的稳定性有利,而本文的试验却显示水中加入醋酸,这尽管降低了水的纯度,但却可以大大提高臭氧稳定性,但是,用于配制醋酸溶液的水纯度越高,越利于臭氧在溶液中稳定存在。由于试验条件限制,本试验选择了超纯水、去离子水与自来水进行比较,结果显示水纯度高好,但该结论仅限于水中已有的污染物,这种代表性并不强,完全可能存在某种物质(尤其是其他有机酸),加入水中之后,更能提高臭氧的稳定性,这方面的工作也有待进一步开展。
本试验表明,水中加入不超过0.6 mol/L醋酸,可以大大提高臭氧的稳定性,且温度低一点好。这对于食品、医药等需要用臭氧进行杂菌消毒的领域有很好的指导作用。在实际需要用到臭氧水时,只要环境许可,在溶液中加入少量醋酸,预期可以提高臭氧的杂菌消毒效果或者延长其作用时间。
4 结论
通过醋酸浓度、臭氧处理时间、温度、放置时间、水质等因素对臭氧溶解度的影响试验,得出以下结论:醋酸浓度、通气时间、温度、放置时间、水质这5个因素都对臭氧在醋酸溶液中的溶解度具有显著影响。试验表明,当醋酸浓度为0.6 mol/L、温度低于5℃、臭氧处理60 min左右时,臭氧的溶解度最好,可以达到2.37 mg/L;且水质越纯时,臭氧溶解度越大。因此选用高纯水配制浓度为0.6 mol/L的醋酸溶液,在低温环境下通入臭氧,对获得高浓度臭氧水溶液更有利。

