药食同源药膳产品参山固体饮料中药复方的提取工艺研究
王亚敏 , 谢梦洲 ,3,张超文 ,陈光宇 ,瞿昊宇 ,宋毓涛 ,朱建平
(1.湖南中医药大学,湖南长沙 410208;2.湖南省药食同源功能性食品工程技术研究中心,湖南长沙 410208;3.抗肿瘤中药创制技术湖南省工程研究中心,湖南长沙 410007)
汤剂的形式既符合中国传统的健康饮食方式,又是中医传统有效服药剂型,特别是对于补益类中药来说,汤剂热服使热气推行更有利于发挥补益作用,参山固体饮料是将药食同源中药和药食两用真菌有机结合,既能以巧妙的配比充分发挥中药复方与菌汤独特鲜美风味,又能通过中药提取工艺优化和菌汤熬煮工艺的优化充分发挥中药复方与药食用真菌的功效,参山固体饮料在选方配伍上以健脾益肾法为依据,以减轻肿瘤患者因癌性疲乏症状为目标,选药均为药食同源药材,以人参大补元气、补脾养胃,山药益气养阴、补脾肺肾为君,茯苓利水渗湿、健脾安神,枸杞子、桑葚补益肝肾、滋阴生津为臣,共奏健脾利湿、补肾养阴之效,玫瑰花疏肝解郁、活血行气,再与既能健脾益气、又鲜香浓郁的药食两用真菌配合,使中药复方提取物和食用菌提取物在功效和风味上相辅相成,既能固护患者胃气、调补气血,也能增进患者食欲,提高患者对药膳类产品的接受度。由于中药复方中人参、桑葚、玫瑰花的醇溶性成分人参皂苷、白藜芦醇、黄酮和水溶性成分多糖等皆有抗肿瘤、增加免疫力的活性[1-2],而茯苓、枸杞子、山药的活性成分主要为多糖类属于水溶性成分[3-4],研究采用先醇提人参、桑葚、玫瑰花,醇提药渣与茯苓、枸杞子、山药一并水提,可以最大程度地提取中药中的有效活性成分,以达到提高功效的目的。主要研究了参山固体饮料的提取工艺,获得最优提取参数,以期为中试和工业化生产提供依据。
1 仪器与材料
1.1 仪器
Ultimate 3000型高效液相色谱系统,包括G1316A型四元梯度泵、G1313A型标准型自动进样器、G1316A型恒温箱、G1314A型紫外检测器、Agilent Chemstation色谱工作站,赛默飞世尔科技(中国)有限公司产品;UV9100B型紫外可见分光光度计,北京莱伯泰科仪器股份有限公司产品;YP-B5001型电子天平,上海光正医源仪器有限公司产品;RHP-400型高速多功能粉碎机,浙江永康市荣浩工业有限公司产品;SHH.W21型电子三用水箱,北京中兴伟业仪器有限公司产品;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司产品;YJD20型老药师常温煎药机,长沙市卓成医疗器械有限公司产品;RE-200013型旋转蒸发仪,巩义市予华仪器有限责任公司产品。
1.2 药材及试剂
人参(人工种植)、桑葚、玫瑰花(重瓣红玫瑰)、枸杞子、茯苓、山药等药材,购于老百姓大药房,经湖南中医药大学药学院周日宝教授鉴定符合2015版《中国药典》一部项下有关规定;人参皂苷Rg1对照品(批号:110703-200726) 购自中国食品药品检定研究院,供含量测定用;人参皂苷Rb1对照品(批号:110704-200921),购自中国食品药品检定研究院,供含量测定用;人参皂苷Re对照品(批号:110702-200925),购自中国食品药品检定研究院,供含量测定用;无水葡萄糖对照品(批号:110833-201506),购自中国食品药品检定研究院,供含量测定用;甲醇、乙腈为色谱纯;水为重蒸馏水;其他HPLC用试剂皆为色谱纯;5%苯酚、浓硫酸、乙醚、无水乙醇等比色用试剂皆为国产分析纯试剂。
2 结果与分析
2.1 苯酚-硫酸比色法测定参山固体饮料水提液中多糖的含量
2.1.1 对照品溶液制备
取无水葡萄糖对照品约0.025 g,精密称定,置250 mL量瓶中,加适量水溶解,稀释至刻度,摇匀,制得质量浓度为0.100 4 mg/mL的葡萄糖标准溶液。
2.1.2 参山固体饮料水提液供试品溶液的制备[5-6]
精密移取各工艺条件下制得的醇提样品液(相当于生药量0.5 g),加乙醚100 mL加热回流1 h,静置,放冷,小心弃去乙醚液,残渣置水浴上挥尽乙醚。加入80%乙醇100 mL,加热回流1 h,趁热滤过,滤渣与滤器用80%乙醇30 mL分次洗涤,滤渣连同滤纸置烧瓶中,加水150 mL,加热回流2 h。趁热滤过,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至250 mL量瓶中,用水稀释至刻度,摇匀,得供试品1;吸取2 mL供试品1置10 mL试管中,加水至刻度线,得供试品2。精密吸取1 mL供试品2,加入1 mL蒸馏水,5%的苯酚1 mL,5 mL浓硫酸,摇匀,室温置10 min,于40℃水浴加热15min,冷却至室温,在最大吸收波长处测定吸光度A。
2.1.3 最大吸收波长的选择
精密吸取葡萄糖对照品溶液和参山固体饮料中药复方水提样品溶液1 mL,按照2.1.2项下方法于波长400~600 nm处分别进行全波长扫描,结果对照液和供试液最大吸收波长皆在490 nm,故选择490 nm为测定波长。
2.1.4 标准曲线的绘制
精密吸取无水葡萄糖对照品溶液0,0.2,0.4,0.6,0.8,1.0 mL,分别置于10 mL具塞试管中并加蒸馏水补至2.0 mL,各再精密加入5%苯酚溶液1 mL,摇匀,迅速加入5 mL浓硫酸,摇匀,于室温下放置10 min,置40℃水浴加热15 min,取出,迅速冷却至室温,以相应试剂为空白,于波长490 nm的最大吸收波长处测定吸光度。以吸光度对无水葡萄糖溶液浓度进行线性回归,得线性方程:Y=0.017 176+0.043 539X,R=0.992 9。
2.1.5 方法学考查
仪器精密度RSD为1.96%,供试品溶液在6 h内吸光度稳定,测定应在6 h内完成。重复性试验RSD为4.831%,加样回收率试验结果表明,参山固体饮料部分药材的醇提样品液中多糖平均回收率为102.3%,RSD为2.218%。
2.2 HPLC法测定参山固体饮料醇提液中人参皂苷Rg1,Re,Rb1的含量
2.2.1 色谱条件[7-8]
Ultimate 3000型色谱柱;固定相为C18烷基键合硅胶;流动相为水-乙腈;运行时间30min;检测波长203 nm;柱温30℃;按人参皂苷Rg1,Re,Rb1分别计算理论塔板数>4 000,分离度>1.5。
2.2.2 人参皂苷Rg1,Re,Rb1对照品溶液的配制
称取人参皂苷Rg1,人参皂苷Rb1,人参皂苷Re对照品各10 mg,分别精密称定为0.010 3,0.010 1,0.010 4 g,各置于10 mL容量瓶中,加入甲醇定容至刻度,充分摇匀,制得人参皂苷Rg1,人参皂苷Rb1,人参皂苷Re对照品溶液。
2.2.3 供试品溶液的制备
精密移取参山固体饮料部分药材的醇提各样品液适量,过0.22μm微孔滤膜至进样小瓶中,即制得部分药材醇提供试品溶液。
2.2.4 阴性对照品溶液的制备
按处方比例称取除去人参的其他药材,依照醇提液的制备工艺和供试品溶液的处理方法制备阴性对照品溶液。
2.2.5 人参皂苷Rg1,Re,Rb1标准曲线的制备及线性范围
取1.03 mg/mL的人参皂苷Rg1,1.01 mg/mL的人参皂苷Rb1,1.04 mg/mL的人参皂苷Re对照品溶液分别依次稀释成 100,90,80,70,60,50,40,30,20,10μg/mL的质量浓度,按2.2.1项下色谱分离条件进样10μL,测定峰面积积分值,以峰面积积分值为纵坐标Y,分别以人参皂苷Rg1质量浓度、人参皂苷Rb1质量浓度、人参皂苷Re质量浓度X为横坐标绘制标准曲线,结果表明,人参皂苷Rg1线性回归方程为Y=0.802 8X+0.146 3,R2=0.999 4;人参皂苷Rb1线性回归方程为Y=0.795 4X+0.276 3,R2=0.999 7;人参皂苷Re线性回归方程为Y=0.387 1X+0.159 3,R2=0.999 2,即人参皂苷Rg1,人参皂苷Rb1,人参皂苷Re对照品溶液质量浓度在10~100μg/mL范围内线性关系良好。
2.2.6 分离条件的考查
精密吸取对照品溶液10μL,供试品溶液、阴性对照品溶液各20μL,分别注入高效液相色谱仪,按照2.2.1项下色谱条件进样分析,结果可知,供试品色谱中,在与对照品色谱相应的位置上有一相同的色谱峰,而阴性对照液未见干扰。
对照品(由左到右依次为人参皂苷Re,人参皂苷Rg1,人参皂苷Rb1)见图1,参山固体饮料部分中药醇提样品供试液见图2,阴性对照品溶液见图3。
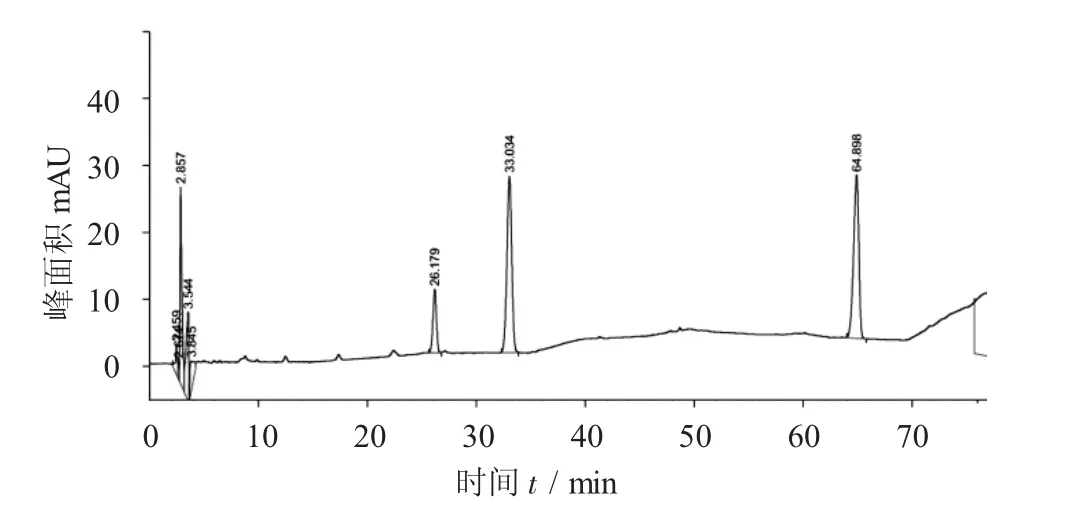
图1 对照品(由左到右依次为人参皂苷Re,人参皂苷Rg1,人参皂苷Rb1)
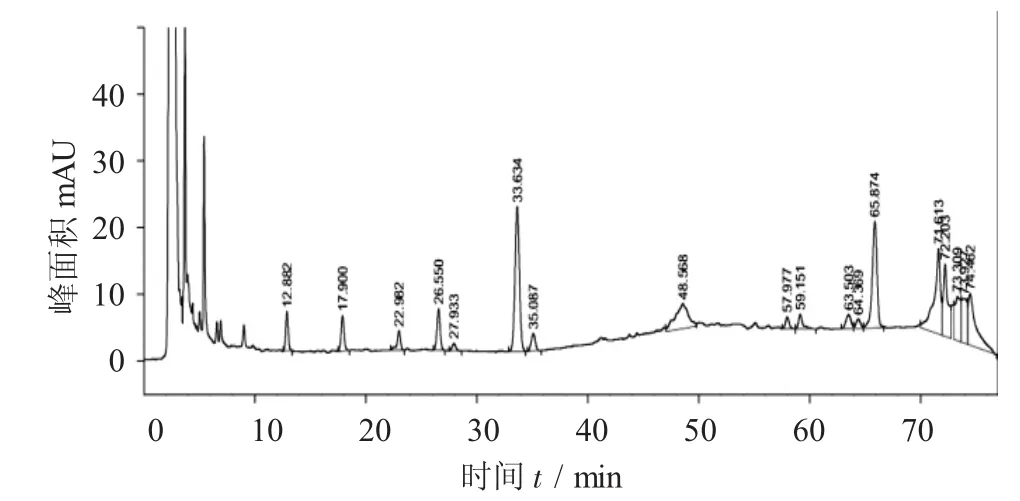
图2 参山固体饮料部分中药醇提样品供试液

图3 阴性对照品溶液
2.2.7 方法学考查
人参皂苷Rg1,人参皂苷Rb1,人参皂苷Re的仪器精密度RSD分别为1.012%,1.089%,1.062%;供试品溶液在48 h内稳定,测定应在48 h内完成;重复性试验RSD分别为1.871%,1.764%,1.683%;加样回收率试验结果表明,参山固体饮料部分药材的醇提样品液中人参皂苷Rg1,人参皂苷Rb1,人参皂苷Re平均回收率分别为100.2%,100.6%,98.87%;RSD分别为0.86%,0.62%,0.66%。
参山固体饮料部分中药醇提次数的考查见表1,参山固体饮料部分中药醇提正交试验因素与水平设计见表2,参山固体饮料部分中药醇提正交设计试验见表3。
2.3 参山固体饮料醇提工艺条件研究
2.3.1 参山固体饮料部分中药醇提基本方法
将人参、桑葚、玫瑰花,加一定浓度一定药材倍量的乙醇,浸泡一定时间,回流一定时间,同法回流2次或3次,过滤合并滤液,浓缩并定容至一定体积。
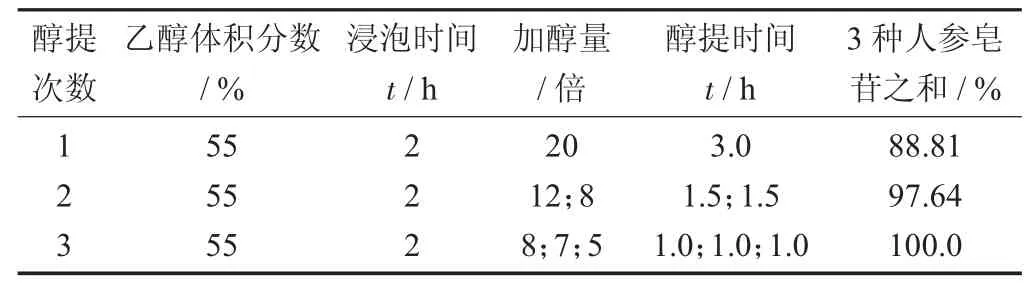
表1 参山固体饮料部分中药醇提次数的考查
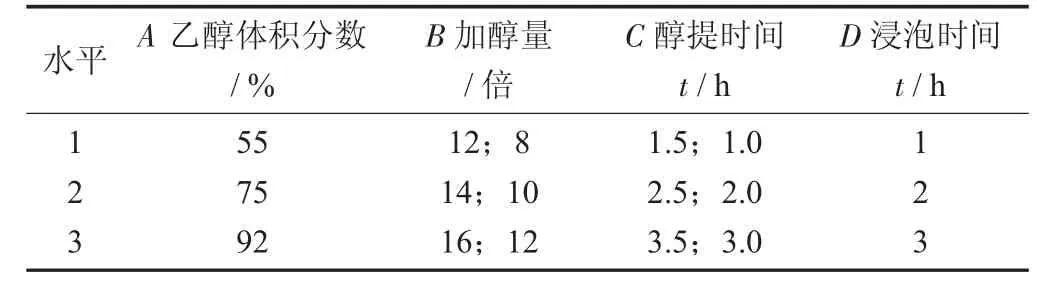
表2 参山固体饮料部分中药醇提正交设计试验因素与水平设计
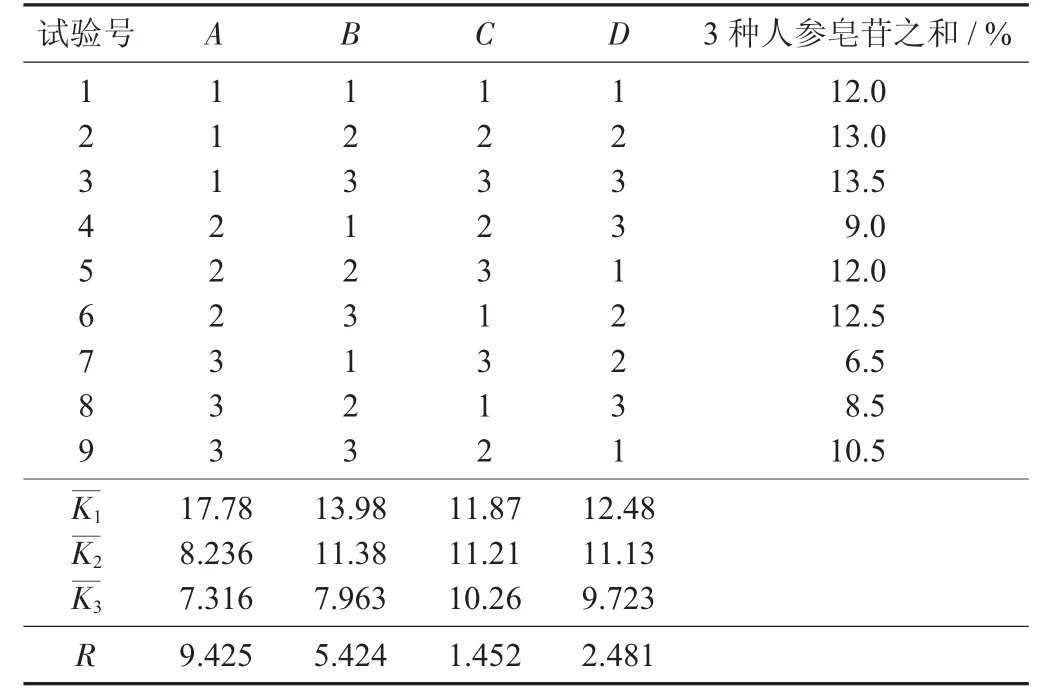
表3 参山固体饮料部分中药醇提正交设计试验
2.3.2 参山固体饮料部分中药醇提次数的考查
取人参、桑葚、玫瑰花3份,每份100 g,按表1设计方案中的参数分别回流法醇提,制备3份醇提液,于50℃下减压浓缩并定容至100 mL,按2.2.3分别处理成供试液,每份按2.2.1项下色谱条件分别进样10μL,测定3种人参皂苷含量。
参山固体饮料部分中药醇提正交设计试验因素间方差分析见表4。
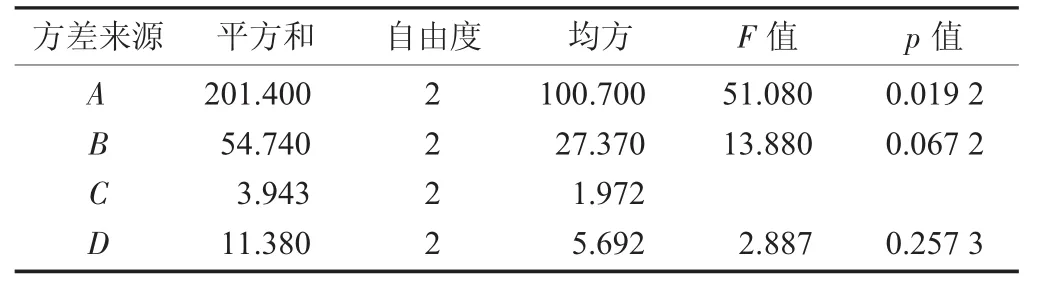
表4 参山固体饮料部分中药醇提正交设计试验因素间方差分析
由表4可知,醇提2次3种人参皂苷之和提取量占醇提3次的95%以上,故醇提2次为佳。
2.3.3 参山固体饮料部分中药醇提正交设计试验及结果分析
在单因素试验的基础上,选取乙醇体积分数(%)、加醇量(倍)、醇提时间(h)、浸泡时间为考查因素,以3种人参皂苷之和百分比(%)为评价指标值,选用四因素三水平的L9(34)正交试验设计试验法进行醇回流提取2次,考查各因素不同水平对3种人参皂苷含量的影响,对试验数据进行极差和方差分析,筛选最优醇提工艺参数,由于以人参皂苷含量为主要指标,参考文献[8]中对人参皂苷的提取因素及水平,设计试验。
参山固体饮料部分中药醇提正交设计试验水平间方差分析见表5。
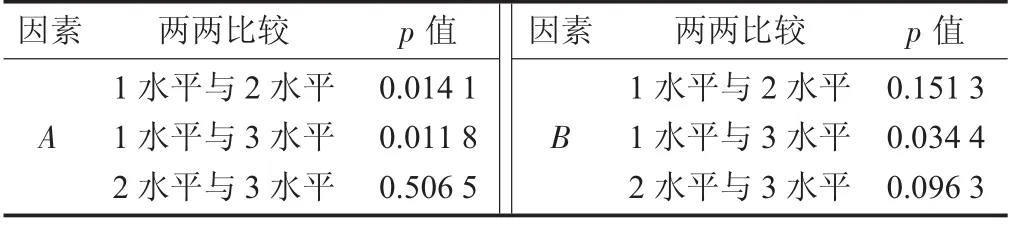
表5 参山固体饮料部分中药醇提正交设计试验水平间方差分析
由极差R值可知,4个因素对参山固体饮料醇提液中3种人参皂苷含量影响大小顺序为乙醇体积分数(A) > 加醇量 (B) > 浸泡时间 (D) > 醇提时间(C);A因素及水平(除2水平与3水平外) 皆有统计学意义,B因素1水平与3水平有统计学意义,C因素和D因素及水平间皆无统计学意义,从表7,表8和经济成本角度考虑,参山固体饮料醇提最佳提取工艺条件为A1B1C1D1,即乙醇体积分数55%,浸泡 1 h,加醇量为生药量的12倍和8倍,醇回流提取1.5 h和1.0 h,由于该醇提条件系第1列试验号,所以不必验证。
2.4 茯苓、枸杞子、山药与醇提药渣一并水提工艺条件研究
2.4.1 参山固体饮料中药水提基本方法
将茯苓、枸杞子、山药加一定量水浸泡2 h,加入醇提药渣一并水提回流2次或3次,每次水提回流一定时间,过滤,合并滤液,浓缩至一定体积。
2.4.2 参山固体饮料中药复方水提次数考查
取茯苓、枸杞子、山药3份,每份100 g,分别浸泡,加入醇提药渣,按表6设计方案中的参数分别水提,制备3份水提液,于50℃下减压浓缩至100 mL,按2.1.2分别处理成供试液,每份按2.1项下测定多糖含量。
参山固体饮料中药复方水提次数考查设计见表6。
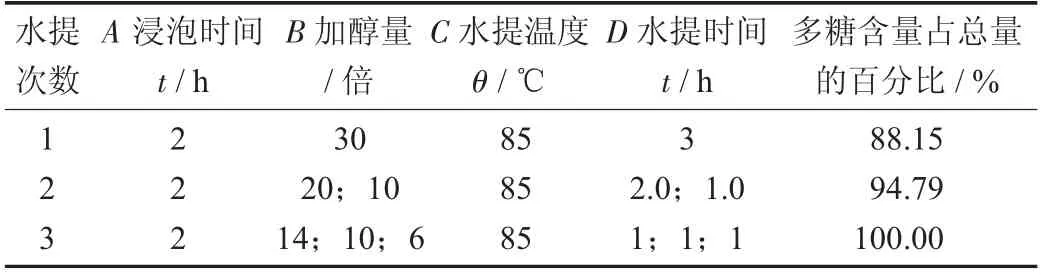
表6 参山固体饮料中药复方水提次数考查设计
由表6可知,水提2次多糖提取量占水提3次的94%以上,故水提2次为佳。
2.4.3 参山固体饮料中药复方水提正交设计试验及结果分析
选取水提温度(℃)、加水量(倍)、水提时间(h) 为考查因素,以多糖含量(%) 为评价指标值,选用三因素三水平的L9(34)正交试验设计试验法进行水回流提取2次,考查各因素不同水平对多糖含量的影响,对试验数据进行极差和方差分析,筛选最优水提工艺参数。
茯苓、枸杞、山药与醇提药渣一并水提因素与水平设计见表7,茯苓、枸杞、山药与醇提药渣一并水提正交试验见表8,茯苓、枸杞、山药与醇提药渣一并水提方差分析见表9。

表7 茯苓、枸杞、山药与醇提药渣一并水提因素与水平设计
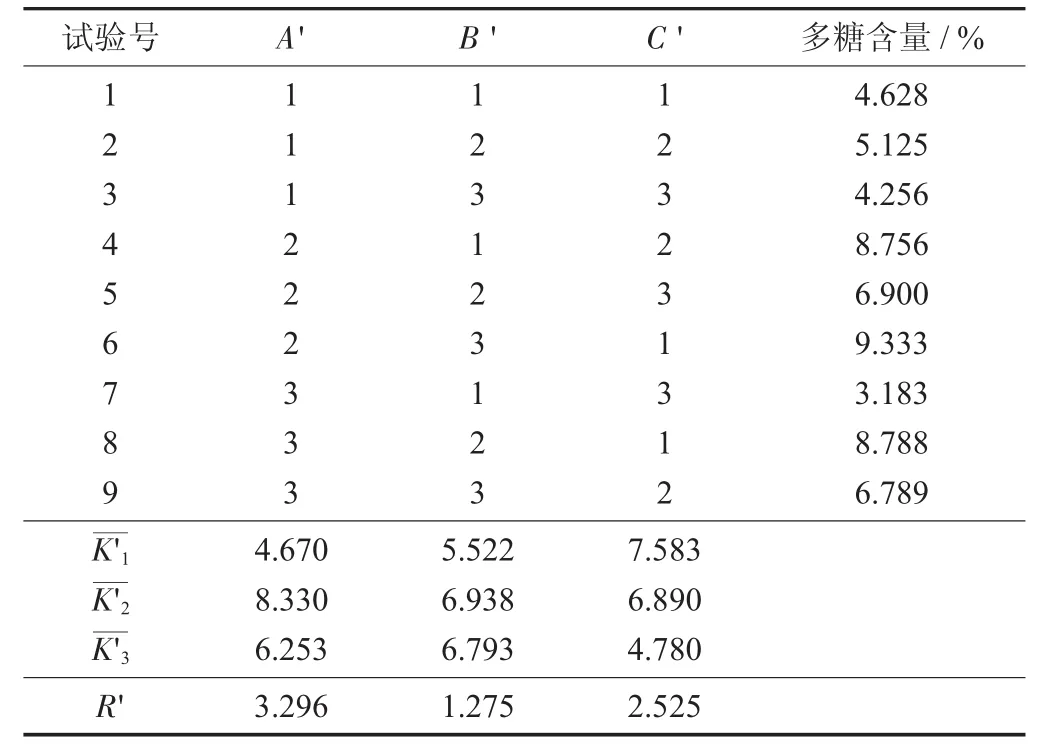
表8 茯苓、枸杞、山药与醇提药渣一并水提正交试验
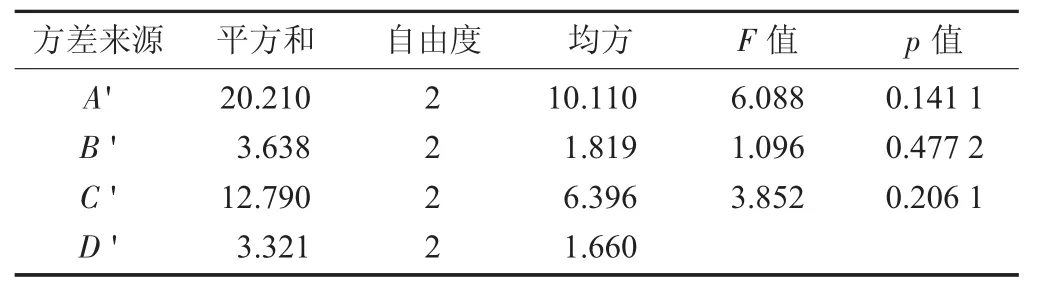
表9 茯苓、枸杞、山药与醇提药渣一并水提方差分析
由极差R'值可知,3个因素对茯苓、枸杞、山药与醇提药渣一并水提药液中多糖含量的影响顺序为水提温度(A')>水提时间(C')>加水量(B');A'、B'、C'三因素及水平间皆无统计学意义,从经济学角度考虑,茯苓、枸杞、山药与醇提药渣一并水提最佳工艺条件为A'3B'1C'1,即水提温度100℃,加水量为生药量的15倍和10倍,水提时间1.5 h和1.0 h。
2.4.4 茯苓、枸杞、山药与醇提药渣一并水提工艺的验证试验
取茯苓、枸杞、山药与醇提药渣(人参、桑葚、玫瑰花)混合,按水提最优工艺参数为水提2次,水提温度100℃,浸泡2.0 h,加水量为生药量的15倍的10倍,水提时间1.5 h和1.0 h,平行试验3次。
水提验证结果见表10。

表10 水提验证结果
由表10可知,多糖含量高于正交设计试验安排表中的任何一列数据,表明水提工艺科学、合理、稳定、可行,可重复。
3 结论
(1)参山固体饮料由药材和食材组成,中药复方提取液浓缩后再喷雾干燥成粉和菌汤喷雾干燥所得粉按比例混和,组方和工艺均兼顾口感和功效,是典型的具有中医药膳特色的现代产品剂型,对药材提取这部分工艺及参数进行了试验研究,为后续部分的喷雾干燥制成中药干浸膏粉和菌汤粉工艺研究奠定基础和提供依据,具有实用意义和应用价值。
(2)乙醇体积分数、加醇量、浸提时间对药材中人参皂苷的提取量影响显著。从理论上讲提取次数越多越好,提取次数太多,时间周期长,效率低,溶剂量多也给浓缩带来不便。经过多次反复研究,得出最优醇提工艺参数为醇提2次,浸泡时间1.0 h,乙醇体积分数55%,加乙醇量为药材量的12倍和8倍,醇回流时间1.5 h和1.0 h;最优水提工艺参数为水提2次,浸泡时间2 h,水提温度100℃,加水量为药材量的15倍和10倍,水提时间1.5 h和1.0 h。
(3)采用醇提方法主要提取人参、桑葚、玫瑰花中的人参皂苷,水提方法主要提取茯苓、枸杞、山药多糖,成本较低、操作简便、提取条件易于控制、且提取效率较高,在工业化大生产中具有广泛的应用前景。
(4) 采用苯酚-硫酸法测定水提液中多糖的含量误差较大,是导致正交设计试验结果无统计意义的主要原因,应增加多糖测定的重复次数,以重复试验的误差作为误差来源,另外参考课题组的其他多糖提取正交试验推测多糖在提取温度85℃时即可充分提取,在100℃提取温度下提取时间过长反而会破坏多糖活性,故也可能导致各因素水平差异不显著。

