10葡萄源丝状真菌分离鉴定及其致病力分析
黄津津, 姚 婷, 王友升
(北京工商大学北京食品营养与人类健康高精尖创新中心,北京 100048)
葡萄属浆果类果实,营养价值高,深受消费者喜爱,但其在采摘、运输和贮藏过程中易受微生物侵染而发生腐烂,严重影响葡萄品质[1]。采摘后的葡萄腐烂损失高达总产量的20%以上[2]。据报道,灰霉使果实腐烂,造成鲜食葡萄毁灭性的病变[3-4];另外,灰霉是以分生孢子和菌核存在被害部位,再侵染花穗,在多雨阴湿的花期,该病害极易侵染葡萄植株[5-7]。茎点霉侵染叶柄、叶片和果实,使葡萄果实出现淡褐色斑点,导致果实呈水浸状软化腐烂,是引起葡萄黑腐病的主要病原菌。果生炭疽菌主要危害接近成熟的果粒,造成果实腐烂变软,失水干缩脱落,也可危害叶片[3]。目前,对引起葡萄采后病害的其他病原菌微生物,尤其是葡萄源对其他果实的致病性,国内外鲜有报道。
利用不同物种间rDNA ITS区序列构建进化树,可确定微生物属内种间的亲缘关系[8],研究从采后贮藏期间发病的葡萄及葡萄叶上分离到10株丝状真菌,结合形态学观察和真菌rDNA ITS区序列分析结果,确定病原菌种属地位,并在4种不同果实上进行接种实验,分析不同病原菌的致病力,发现引起葡萄、圣女果、苹果和梨果实采后病害的新病原微生物,可对真菌种间关系及病害防治研究提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
丝状真菌814#、815#和880#分离于采后贮藏过程中自然发病的葡萄果实,菌株 794#、797#、798#、811#、902#、903#和 1397#分离于葡萄叶。
1.1.2 培养基
马铃薯培养基(potato dextrose agar)和麦芽浸粉培养基(malt extract agar)的配制参考文献[9]。
1.1.3 主要试剂
十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸钠(EDTA),购自Amresco公司;DNA分子质量标准2×Taq PCR MasterMix.、MarkerⅦ,购自天根生化科技(北京)有限公司;PCR引物 ITS-4(5'-TCCTCCGCTTATTGATATGC-3')和ITS-5(5'-GGAAGTAAAAGTCGTAACAAGG-3'),由Invitrogen公司合成。
1.2 仪器与设备
MG96+型PCR仪,杭州朗基科学仪器有限公司;Axio Image A1型显微镜,德国Zeiss公司;A2型生物安全柜,美国Thermo公司。
1.3 实验方法
1.3.1 病原菌的分离、纯化及回接
按照参考文献[10]的方法进行。通过组织分离法对病害葡萄中的微生物进行分离,将发病的叶子和果实经过体积分数75%的乙醇处理后,取发病叶子和果实病、健交界处组织,将叶子发病一面放于PDA固体培养基上,25℃培养3 d。取菌落外沿菌块,分别用三点转接到PDA和ME固体培养基平板上,25℃培养。挑选健康无损伤的葡萄叶子和葡萄果实,用75%乙醇将表面消毒,用无菌接种针刺孔,取纯化后的菌块接种至伤口处,分别在叶子的正反面及果实的刺伤处接种菌块,观察果实接种处是否出现相应病症,并在病斑处再次分离该病原菌,比较分离到的病原菌与接种病原菌的菌落形态。
1.3.2 病原菌形态学鉴定
纯化得到生长于PDA培养基上的菌落,从菌落外沿取菌块,分别转接到PDA和ME培养基上,25℃培养14 d,于7、14 d观察菌落形态、色泽等。对培养期间长出的孢子进行显微观察[11],将插片培养的盖玻片置于乳酸苯酚棉蓝染色液中,观察菌落产生分生孢子及分生孢子梗的形状、色泽,分生孢子隔膜等性状,查阅相关文献进行对比,初步确定病原菌的种属。
1.3.3 病原菌分子生物学鉴定
基因组DNA的提取及ITS区PCR扩增与序列测定采用改良后SDS-氯化苄法提取待鉴定菌株的基因组DNA[12]。以真菌rDNA ITS区的通用引物ITS4和ITS5作为PCR扩增引物,通过PCR扩增出ITS区。 25μL 2×Taq PCR Master Mix、ITS4和 ITS5两条正反向引物各4μL、5μL基因组模板、12μL ddH2O,将体系混匀。在PCR仪中94℃,3 min预变性;94℃,30 s变性;51℃,30 s退火;72℃,45 s延伸;72℃,10 min再延伸;30个循环。PCR产物由生工生物工程(上海)股份有限公司进行基因测序,将结果在NCBI上进行序列比对,在Genebank中查找同源序列,将10株真菌rDNA ITS区序列与同源序列进行系统发育分析,并且构建系统发育进化树。
1.3.4 病原菌在其他果实上的致病力分析
挑选健康无损伤的果实,用去离子水冲洗,自然晾干后用75%乙醇将表面消毒,无菌接种针刺孔,取纯化后的菌块接种至伤口处,观察果实接种处是否出现相应病症,并在病斑处再次分离病原菌,比较分离得到的病原菌与接种病原菌的菌落形态。
2 结果与分析
2.1 葡萄源丝状真菌的分离与回接结果
采自不同品种的葡萄和葡萄叶发病症状如图1,在PDA培养基上对其进行病原菌分离。由图1a1~j1可知,分别从自然发病的葡萄和葡萄叶子的发病部位分离得到丝状真菌 814#、815#、880#和794#、797#、798#、811#、902#、903#、1397#。 其中,将分离得到的菌株纯化后回接到葡萄和葡萄叶伤口处,在接种部位均出现相应病症(图1a2~j2),并能从该病害部位再次分离得到相应病原菌。
2.2 葡萄源丝状真菌的形态观察结果
2.2.1 菌落形态

图1 10株丝状真菌分离与回接病症Fig.1 Isolation and reinoculated symptoms of ten strains
观察菌株的菌落形态发现,10株丝状真菌在25℃条件下生长均较旺盛(见图2、图3)。在培养7 d后,814#、815#菌株的菌丝均铺满PDA和ME平板,菌落形态一致,表面光滑,质地紧密,边缘规则,菌丝较短(图 2 a1、a2、b1、b2);菌株 880#在 PDA 培养基上菌丝较短,呈现青色,而在ME培养基上菌落呈现白色,菌落边缘整齐(图2 c1、c2);菌株794#在PDA培养基上菌丝生长较快,产生大量孢子,且在2种培养基上均产生同心轮纹(图2 d1、d2);菌株797#、902#、903#在PDA培养基上产生大量粉色孢子,菌落呈圆形,边缘整齐,可见同心轮纹(图2 e1、e2、h1、h2、i1、i2);菌株 798#在 PDA 培养基上菌丝较短,菌落边缘呈现白色,中间颜色为青色(图2 f1、f2);菌株811#在ME培养基上菌丝生长较快,菌丝上出现晶莹水滴,在PDA培养基上菌丝较光滑(图2 g1、g2);菌株1397#在PDA和ME培养基上均生长较快,菌丝在PDA培养基上呈现白色,在ME培养基上呈现淡黄色,且较疏松(图2 j1、j2)。培养14d后,814#、815#菌落产生色素,在PDA培养基上呈黑色,在ME培养基上呈灰色(图 3 a1、a2、b1、b2);880#在 2 种培养基上菌落颜色加深,表面出现凸起(图3 c1、c2);菌株794#在PDA培养基上菌丝呈现黑色,孢子铺满平板,在ME培养基上呈现褐色,生出大量孢子,2种培养基上菌丝形状相似,但PDA培养基的菌落直径较小(图 3 d1、d2);菌株 797#、902#、903#菌落颜色加深,菌丝呈无色、短小的茸毛状(图 3 e1、e2、h1、h2、i1、i2);菌株798#在 PDA 和 ME上菌落颜色加深,表面出现凸起(图3 f1、f2);菌株811#在PDA培养基上菌落边缘粗糙,菌落颜色变深,在ME培养基上菌落铺满平板且有菌核生成(图3 g1、g2);菌株1397#生长旺盛,铺满平板,白色菌丝颜色稍有加深(图3 j1、j2)。
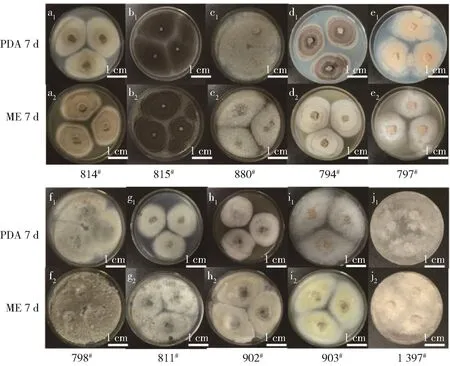
图2 10株丝状真菌培养7 d的菌落形态Fig.2 Colony morphology of ten strains after 7 d culture
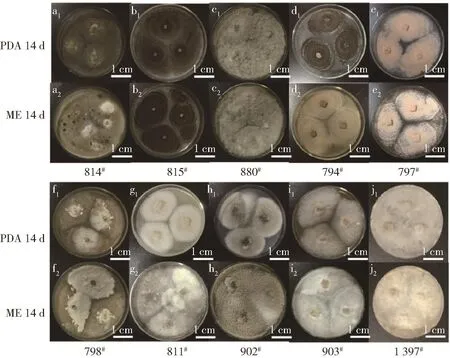
图3 10株丝状真菌培养14 d的菌落形态Fig.3 Colony morphology of ten strains after 14 d culture
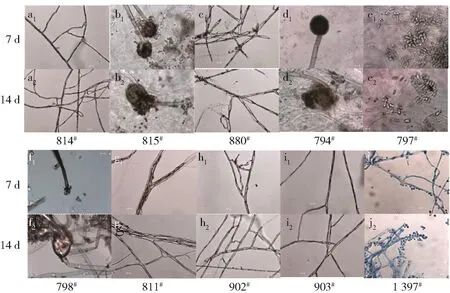
图4 10株丝状真菌的显微形态观察Fig.4 Microscopic morphology of ten strains
2.2.2 菌丝形态
不同菌株的菌丝形态如图4。由图4可知,菌株814#的菌丝呈无色至浅褐色,分生孢子着生,呈圆形或椭圆形,褐色的具有孔口的单腔分生孢子器上,分生孢子单生,直径在10μm左右(图4 a1、a2);菌株815#和794#的分生孢子梗初期无色,随着培养时间延长变成褐色,分生孢子顶端开始为黑色圆形,直径在40μm左右,后期孢子囊破裂,大量分生孢子产出,此时孢子囊呈现褐色,分生孢子为圆形,直径在5 μm 左右(图4 b1、b2、d1、d2);菌株880#在7 d 时并未产生孢子,菌丝呈浅褐色,有较多分支(图4c1、c2);菌株797#的分生孢子梗初期无色,有分支,孢子呈现椭圆体,分生孢子为双细胞,有分隔,直径约15 μm(图4 e1、e2);菌株798#的分生孢子梗呈深褐色,分支较多,梗基部脚孢直或者弯曲,有孢囊,分生孢子椭圆形或圆形,淡褐色(图4f1、f2);菌株811#的分生孢子梗呈无色至深褐色,分支较多,未产生分生孢子(图4g1、g2);菌株902#的分生孢子梗呈无色至墨绿色,分支较多,分生孢子单生,褐色,数量较少,倒棍棒形或椭圆形,直径约30μm,有多个纵横隔膜,有长喙(图4h1、h2);菌株903#未产生孢子,菌丝浅褐色,有较少分支(图4i1、i2);菌株1397#菌丝呈无色至浅绿色,分生孢子着生,呈圆形,直径在8μm左右(图 4j1、j2)[11-13]。
2.3 葡萄源丝状真菌基因组DNA的提取和PCR扩增验证
从葡萄及葡萄叶中分离的10株丝状真菌的基因组DNA PCR扩增后的电泳条带结果如图5,条带清晰,目的片段均在600 bp左右,与实验设计相符。
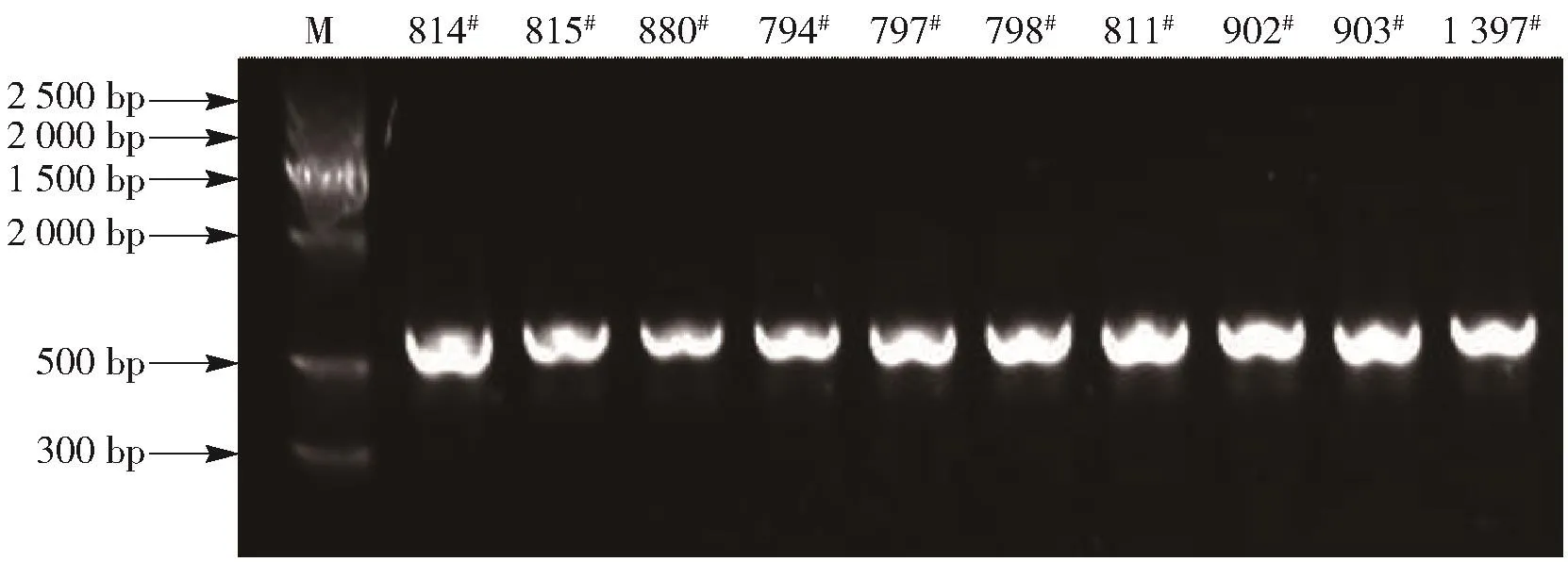
图5 10株丝状真菌的ITS区rDNA电泳检测图谱Fig.5 Agarose gel electrophoresis results of ITSrDNA sequence of ten strains
从葡萄及葡萄叶中分离的10株丝状真菌的ITS区rDNA基因PCR扩增片段的序列在NCBI上比对得到同源序列,利用MEGA6软件构建的系统进化树如图6。可以看出,10株丝状真菌中,菌株814#与茎点霉Phoma sp.(KM979918.1)在同一分枝上,且通过Bootstraps的验证表明它们具有较高的置信度,支持率可达95%(图6a)。菌株815#与刺孢曲霉Aspergillus aculeatus(FJ629320.1)在同一分枝上,且通过Bootstraps的验证表明它们具有较高的置信度,支持率可达100%(图6b)。菌株880#与灰葡萄孢Botrytis cinerea(KM016533.1)在同一分枝上(图6c)。菌株794#与日本曲霉Aspergillusjaponicus(FJ878653.1)在同一分枝上,且通过Bootstraps的验证表明它们具有较高的置信度,支持率可达100%(图6d)。菌株797#与粉红单端孢Trichothecium roseum(KT359587.1)在同一分枝上,且通过Bootstraps的验证表明,它们具有较高的置信度,支持率可达100%(图6e)。菌株798#与大蒜盲种葡萄孢Botrytis porri(AJ716292.1)在同一分枝上,通过Bootstraps的验证表明,它们具有较高的置信度,支持率可达96%(图6f)。菌株811#与果生炭疽菌 Colletotrichum fructicola(KC566789.1)在同一分枝上,通过Bootstraps的验证表明,它们具有较高的置信度,支持率可达100%(图6g)。菌株902#与链格孢菌Alternaria eichhorniae(KC146356.1)在同一分枝上,通过Bootstraps的验证表明,它们具有较高的置信度,支持率可达100%(图6h)。菌株903#与芬芳镰孢菌Fusarium redolens(KX610323.1)在同一分枝上,通过 Bootstraps的验证表明,它们具有较高的置信度,支持率可达100%(图6i)。菌株1397#与脉孢菌Neurospora terricola(FR774522.1)在同一分枝上,通过 Bootstraps的验证表明,它们具有较高的置信度,支持率可达99%(图6j)。
结合形态特征(图2、图4)与《真菌鉴定手册》中相应霉菌描述比较,本研究中分离到的菌株814#、815#、880#、794#、797#、798#、811#、902#、903#和1397#依次确定为茎点霉 Phoma sp.(KM979918.1)、刺孢曲霉 Aspergillus aculeatus(FJ629320.1)、灰 葡 萄 孢 Botrytis cinerea(KM016533.1)、日本曲霉 Aspergillus japonicus(FJ878653.1)、粉红单端孢 Trichothecium roseum(KT359587.1)、大蒜盲种葡萄孢 Botrytis porri(AJ716292.1)、果生炭疽菌 Colletotrichum fructicola(KC566789.1)、链格孢菌 Alternaria eichhorniae(KC146356.1)、芬芳镰孢菌 Fusarium redolens(KX610323.1)和脉孢菌 Neurospora terricola(FR774522.1)。
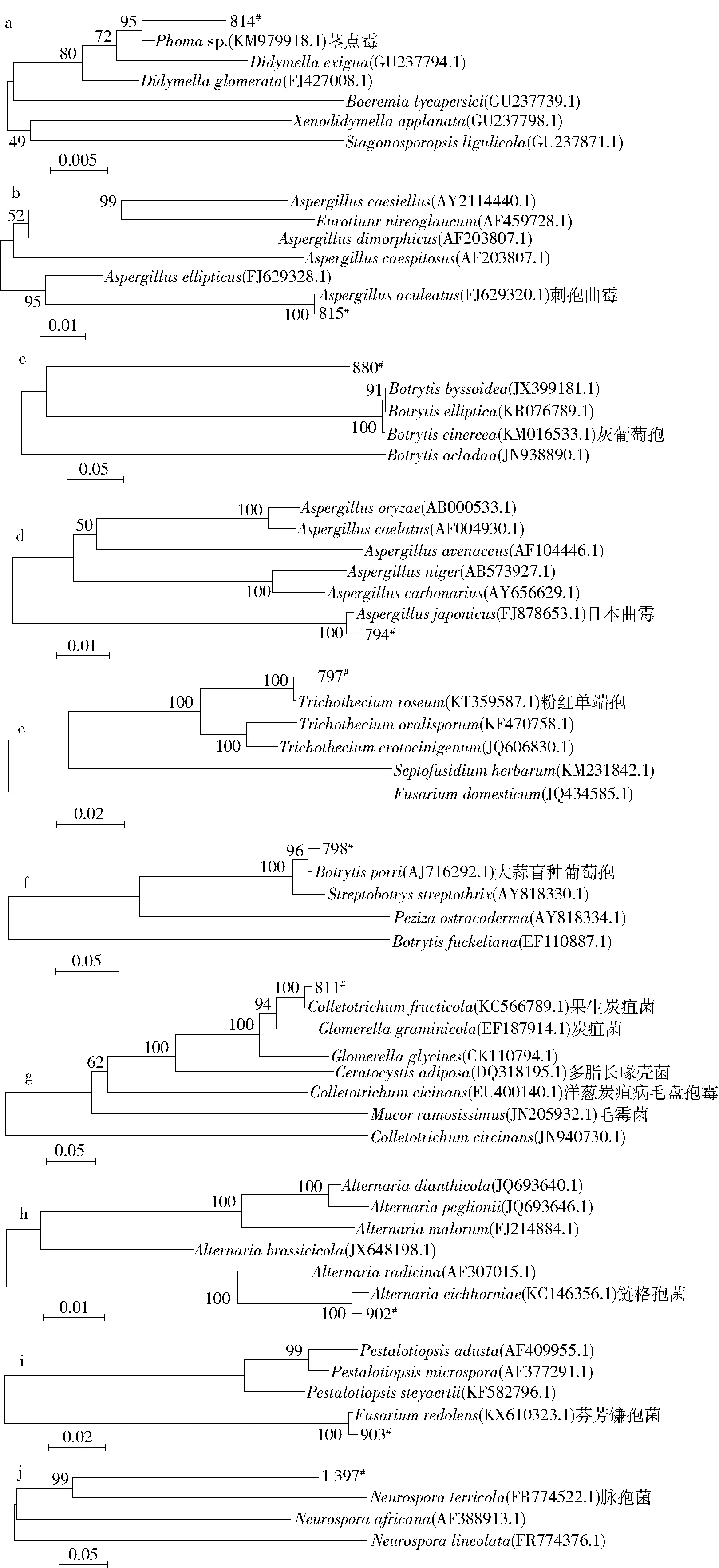
图6 以ITS区rDNA基因序列为分子标记的10株丝状真菌菌株系统进化分析Fig.6 Phylogentic tree of ten strains based on ITSrDNA sequence
2.4 葡萄源病原菌对不同果实致病力的比较
将菌株 814#、815#、880#、794#、797#、798#、811#、902#、903#和1397#接种到4种果实上,观察发病情况(见图7)。在25℃保持一定湿度的条件下,接种菌株814#的2种浆果果实均发病,且随着培养时间的增加,病斑直径逐渐扩大,6 d后,葡萄的病斑直径达1 cm,但此病原菌并未引起苹果和梨发病(图7a1~a4)。接种菌株815#、794#的2种浆果果实在第6天出现腐烂,果实表面产生孢子,在苹果和梨上出现褐变,果实大面积腐烂,由此可知,从葡萄和葡萄叶上分离得到的菌株815#、794#同样可以使其他水果发病(图7b1~b4,d1~d4)。将菌株880#回接到4种果实上,2种浆果果实在2 d后发病,病原菌在果实表面铺展开来,随着培养时间的增加,病斑直径逐渐扩大,在第6天几乎覆盖整个果实,产生孢子,并使苹果和梨发生褐变(图7 c1~c4)。接种菌株797#的果实病原菌生长缓慢,培养6 d后的病斑直径只有0.5 cm左右,相同条件下致病力较弱(图 e1~e4)。接种菌株798#的4种果实在第2天就出现明显的发病症状,病原菌在果实表面铺展开来,随着培养时间的增加,病原菌直径逐渐扩大,培养6 d后,病原菌几乎覆盖整个果实,并在2种浆果果实上产生孢子,在苹果和梨上出现褐腐且病斑直径较大(图7f1~f4)。接种菌株811#的果实第6天在2种浆果上均出现白色菌丝,刺伤周围的组织出现松软变烂,而在苹果和梨上发病较慢,苹果出现褐变,梨表面出现深黑色褐变,由此可知,811#可以使其发病,但致病力相对较弱(图7g1~g4)。接种菌株902#的2种浆果果实在第2天出现发病症状,病原菌在果实表面铺展开来,随着培养时间的增加,病原菌直径逐渐扩大,第6天时,病斑直径达1 cm,菌落由无色变为黑灰色,苹果和梨上均出现褐变(图7h1~h4)。接种菌株903#的果实在第2天出现发病症状,随着培养时间的增加,病原菌直径逐渐扩大,培养6 d后,病斑直径达1 cm,苹果上的病斑直径较梨小,梨上出现明显的白色菌丝(图7i1~i4)。接种菌株1397#的葡萄、苹果和梨均未发病,圣女果有明显发病症状,在接种6 d后,病斑直径可达1 cm左右,菌丝呈现橙黄色(图7j1~j4)。

图7 10株丝状真菌回接不同果实在25℃时的病症Fig.7 Symptoms of reinululated fruits of ten strains at 25℃
3 讨 论
本文从葡萄果实上分离到3株丝状真菌,分别为茎点霉(Phoma sp.)、刺孢曲霉(A.aculeatus)、灰葡萄孢(B.cinerea),其中 Phoma sp.、B.cinerea与Serra等[14]和Hamid等[15]报道相一致;从葡萄叶上分离到7株丝状真菌,分别为日本曲霉(A.japonicas)、粉红单端孢(T.roseum)、大蒜盲种葡萄孢(B.porri)、果生炭疽菌(C.fructicola)、链格孢菌(A.eichhorniae)、芬芳镰孢菌(F.redolens)、脉孢菌(N.terricola)。T.roseum在国内外均有报道,它不仅是弱寄生真菌,还是菌寄生真菌。C.fructicola对果实可造成严重危害,还可引起葡萄花穗的腐烂,1981年美国首次对该菌进行了报道[16]。
将10株丝状真菌分别接种到葡萄、圣女果、苹果和梨上,其中T.roseum可使4种果实均发病[17],但未见其能使梨发病的报道;B.cinerea可使4种果实均发病,但未见其能使圣女果和梨发病的报道[18];C.fructicola可使4种果实均发病[19],但未见其能使葡萄和圣女果发病的报道;A.eichhorniae、F.redolens可以使4种果实均发病,但未见其能使葡萄、圣女果和梨发病的报道;且 A.japonicas、A.aculeatus、C.fructicola、A.eichhorniae、F.redolens和N.terricola在国内外均未见在葡萄上发病的报道,目前关于A.japonicas和A.aculeatus侵染苹果的报道较少,而本研究发现A.japonicus对苹果致病力较强,A.aculeatus致病力较弱。
4 结 论
1)从葡萄果实上分离到3株丝状真菌,分别为茎点霉(Phoma sp.)、刺孢曲霉(A.aculeatus)、灰葡萄孢(B.cinerea)。从葡萄叶上分离到7株丝状真菌,分别为日本曲霉(A.japonicas)、粉红单端孢(T.roseum)、大蒜盲种葡萄孢(B.porri)、果生炭疽菌(C.fructicola)、链格孢菌(A.eichhorniae)、芬芳镰孢菌(F.redolens)、脉孢菌(N.terricola)。
2)文章分离到的日本曲霉(A.japonicas)、刺孢曲霉(A.aculeatus)、果生炭疽菌(C.fructicola)、链格孢菌(A.eichhorniae)、芬芳镰孢菌(F.redolens)和脉孢菌(N.terricola)目前未见从葡萄分离得到的相关报道,为新发现菌株。
3) 丝状真菌 B.cinerea、A.japonicus、A.aculeatus、T.roseum、B.porri、C.fructicola、A.eichhorniae、F.redolens均可使葡萄、圣女果、苹果和梨4种果实发病,其中 B.cinerea、A.japonicus、B.porri和 F.redolens致病力较强,而Phoma sp.和N.terricola只能使葡萄和圣女果发病。

