细胞焦亡及炎性小体在大鼠术后认知功能障碍中的作用
罗声臻,盛福庭,徐建立,莫春凤
0 引言
术后认知功能障碍(POCD)是麻醉和手术后出现的一种中枢神经系统并发症,其临床症状主要包括认知能力降低、理解水平下降、记忆减退等[1]。有研究证实,POCD重要机制与Aβ刺激胶质细胞产生炎症因子和细胞因子有关[2],但具体机制不详。细胞焦亡是由多种病原体或非感染因素刺激导致的一种固有免疫反应,是宿主细胞发生的一种依赖半胱氨酸天冬氨酸蛋白酶1(caspase-1)的程序性死亡[3]。有研究表明,Aβ聚集可以激活炎性小体并充当caspase-1激活的平台,对后续细胞炎症因子的分泌和细胞焦亡起促进作用[4-5]。然而,细胞焦亡及炎性小体在POCD中的作用鲜有研究。因此,本研究旨在探讨细胞焦亡及炎性小体在大鼠术后认知功能障碍中的作用。
1 材料与方法
1.1 动物选择与分组 选取24只清洁级雄性SD大鼠,体重260~290 g,4月龄,购自广东省动物实验基地。动物房内饲养7 d,室温设置为25 ℃,湿度设定为40%,不控制饮水量,常规饮食。随机分成4组,每组6只,分别为NS组、POCD 2W组、POCD 4W组和POCD 6W组。
采用海马区注射Aβ1-40法制备大鼠POCD模型[6],腹腔内注射浓度为10%的水合氯醛350 mg/kg进行麻醉,将大鼠良好地固定于大鼠脑立体定向仪上(深圳瑞沃德生命科技有限公司),定位双侧海马CA1区,然后钻开颅骨,露出硬脑膜,微量进样器(上海激光医学仪器厂)从脑表面定位点处垂直进针,依次将Aβ1-40(使用前,用无菌生理盐水对Aβ1-40进行稀释处理,获得5 μg/μL Aβ1-40,37 ℃温度下孵育7 d,促其呈寡聚态)2 μL注入POCD 2W组、POCD 4W组和POCD 6W组大鼠的双侧海马,注射时长为5 min,留针5 min,确保Aβ1-40完全浸润局部组织。NS组大鼠于相同位点注射等量的生理盐水进行对照。局部消毒处理后缝合皮肤,待缝合完毕,腹腔注射庆大霉素2万U,避免感染,常规饲养。
1.2 水迷宫行为学测定大鼠认知功能 各组大鼠于术前5 d开始行Morris水迷宫(中国医学科学院药物研究所)行为学实验训练,每天训练4次,共持续5 d。通过池壁上的4个等距离点将水池平分成4个象限,在Ⅳ象限中心位置安放平台,其直径为15 cm,高度为33 cm,没入水下1 cm。将大鼠从上述4个象限面向池壁放入水池,一直持续到其成功探寻到隐没于水下的平台,运用any-Maze动物行为学自动摄像分析系统,对大鼠的游泳速度、逃避潜伏期、上台前路程以及搜索策略进行详细而全面的记录,如果90 s内未成功发现平台,通过合理的方式引导其登上平台,暂时休息30 s,并将其逃避潜伏期记作为90 s。分别于术后2周和4周对POCD 2W组和POCD 4W组大鼠行Morris水迷宫行为学测试,于术后6周对NS组和POCD 6W组大鼠行Morris水迷宫行为学测试。分别于术后2、4、6周行水迷宫行为学测试后处死各组大鼠。
1.3 吖啶橙/溴乙锭(AO/EB)荧光比色测定海马内细胞焦亡情况 水迷宫行为学测试完成后断头处死大鼠,迅速分离脑组织于pH 7.4的人工脑积液中分离海马组织,使用0.25%胰酶200 μL进行剪碎消化混匀,4 ℃ 1 000 r/min离心10.5 min,取其沉淀加入50 μL AO/EB染色剂(编号KFS250,北京百奥莱博科技有限公司)后混匀并反应1 min,用人工脑积液稀释至200 μL,使用荧光读板机(型号Gemini EM,Molecular Devices公司,美国)测定样本管和空白对照管的OD值。
1.4 Western bolt法测定海马内caspase-1和ASC蛋白表达 应用RIPA裂解液(Thermo公司,美国)提取海马组织蛋白,BCA法测定蛋白浓度,加入1/4体积的5×蛋白上样缓冲液,混匀后96 ℃水浴变性10 min,经聚丙烯酰胺凝胶电泳,湿转法电转移至聚偏氟乙烯膜上,置于TBS-T配5%脱脂牛奶中室温封闭1 h,分别加入兔抗caspase-1抗体(Abcam公司,英国)、兔抗ASC抗体(Abcam公司,英国)及兔抗β-actin抗体(Abcam公司,英国),4 ℃孵育过夜;TBS溶液洗膜后,加入辣根过氧化酶标记的IgG山羊抗兔二抗(Abcam公司,英国),室温孵育1 h;TBS-T洗膜5 min,化学发光剂ECL显影、曝光,凝胶成像分析系统成像。通过Scion Image软件检测caspase-1和ASC目的条带,并将其和内参照β-actin条带的灰度值进行对比,其比值作为caspase-1和ASC的相对表达量。
1.5 ELISA法测定IL-1β和IL-10的含量 采用匀浆器进行组织研磨,冰浴下进行超声波粉碎并制成匀浆,4 ℃离心处理后取上清液。严格参照ELISA测定试剂盒提供的说明书完成对海马内IL-1β、IL-18含量的测定。经MK3酶标仪读取吸光度OD值,对应标准曲线得出IL-1β和IL-18的含量。
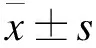
2 结果
2.1 各组大鼠水迷宫行为学结果比较 与NS组相比,POCD 2W组大鼠上台前路程和逃避潜伏期变化差异均无统计学意义(P>0.05),而POCD 4W组和POCD 6W组大鼠上台前路程和逃避潜伏期均延长(P<0.05);三组大鼠游泳速度比较差异无统计学意义(P>0.05)。见表1。
2.2 各组大鼠海马内炎性小体相关标记物变化比较 与NS组相比,POCD 2W组大鼠海马内ASC、IL-1β和IL-18变化差异均无统计学意义(P>0.05)。与NS组和POCD 2W相比,POCD 4W组和POCD 6W组大鼠海马内ASC、IL-1β和IL-18表达显著增强(P<0.05)。见表2。

表1 各组大鼠水迷宫行为学结果比较(n=6)
注:与NS组比较,*P<0.05

表2 各组大鼠海马内炎性小体相关标记物变化比较(n=6)
注:与NS组比较,*P<0.05;与POCD 2W组比较,#P<0.05
2.3 各组大鼠海马内细胞焦亡相关标记物变化比较 与NS组相比,POCD 2W组和POCD 4W组大鼠海马内caspase-1表达和AO/EB染色OD值变化差异无统计学意义(P>0.05),与NS组、POCD 2W组和POCD 4W组相比,POCD 6W组大鼠海马内caspase-1表达增强,OD值升高(P<0.05)。见表3。

表3 各组大鼠海马内细胞焦亡相关标记物变化比较(n=6)
注:与NS组比较,*P<0.05;与POCD 2W组比较,#P<0.05;与POCD 4W组比较,△P<0.05
3 讨论
Aβ沉积是各种原因诱发POCD的共同途径,亦是POCD形成和发展的关键因素,过量的Aβ沉积所诱发的神经毒性和认知障碍与其脑内沉积的Aβ含量呈正相关。大鼠双侧海马注射Aβ1-40可使海马神经元线粒体肿胀、畸形,嵴断裂、溶解,突触小泡体积变小、结构缺失、数量明显减少,并导致严重的记忆减退和认知障碍[6]。因此,本研究采用既往研究的方法制备大鼠POCD模型,大鼠认知行为学的改变提示海马区注射Aβ1-40后可导致大鼠发生POCD。
细胞焦亡作为一种新型的炎性相关的细胞死亡方式参与多种神经系统疾病的免疫应答[7]。神经元在不同的刺激条件下激活caspase-1,参与促炎因子IL-1β和IL-18的释放,发生细胞焦亡[8]。有研究表明,细胞焦亡参与中枢神经系统退行性病变疾病的进展,如阿尔茨海默病、帕金森病、运动神经元病等[9]。POCD的病理特征为突触的缺失、神经元死亡,以及细胞外神经炎性斑内Aβ的沉积,而细胞外增加的Aβ水平可通过多种可能的机制包括氧化应激、兴奋性中毒、能量消耗、炎症和细胞凋亡等引起神经元死亡[10]。最近研究发现,Aβ可以激活由NLRP1介导的细胞焦亡,引起神经元缺失及局部炎症反应[11]。Aβ能直接激活胶质细胞分泌和释放TNF-α、IL-1β、IL-6、集落刺激因子、环氧化酶2、前列腺素等炎性趋化因子[12],另外,七氟醚还可以通过诱导Aβ的聚集与沉积造成老年大鼠空间学习和记忆能力的损伤[13]。Aβ可干扰神经膜功能并可引起K+从神经元流出,而低K+浓度是NLRP1炎性体的有效活化剂,活化的NLRP1炎性小体参与细胞焦亡导致的神经毒性,从而加重神经退行性病变,引起进行性认知障碍[14]。本研究观察到Aβ注射6周后大鼠行为学方面出现明确的认知功能障碍,此时海马内焦亡调节通路上caspase-1表达增加效应促炎因子IL-1和IL-18成熟,提示细胞焦亡的发生与POCD的发生发展密切相关。
炎症小体是存在于细胞质中的一种具有广泛活性的轮状结构体,能激活caspase-1,后者进一步促进促炎细胞因子IL-1β、IL-18切割和成熟,并且可以促使细胞发生焦亡[15]。细胞焦亡是一种高度依赖于caspase-1激活的炎症性死亡方式,促进细胞焦亡的两个必要条件是炎症小体的活化和促炎因子IL-1β和IL-18的剪切成熟[16],本研究结果表明,POCD组ASC和caspase-1表达显著升高,提示炎症小体形成后,IL-1β和IL-18的表达合成也增加,伴随促炎因子成熟,导致细胞焦亡,阻断细胞焦亡通路中任何一种物质的活化均可影响神经退行性脑损害的进展,从而发现一种POCD潜在治疗靶点。本研究结果表明,POCD大鼠4周时海马内炎性小体即已形成,但此时细胞焦亡并不明显,在4~6周期间,炎性小体介导下的细胞焦亡现象逐渐趋于明显,提示POCD后4~6周可能为炎性小体促进细胞焦亡的关键期,因此,推测早期干扰炎性小体的形成可有效调控远期细胞焦亡。
综上所述,大鼠术后认知功能障碍形成的部分机制可能与海马内炎性小体激活后所致的细胞焦亡有关。
参考文献:
[1] Feng PP,Deng P,Liu LH,et al.Electroacupuncture alleviates postoperative cognitive dysfunction in aged rats by inhibiting hippocampal neuroinflammation activated via microglia/TLRs pathway[J] .Evid Based Complement Alternat Med,2017,2017:6421260.
[2] Hu N,Wang C,Zheng Y,et al.The role of the Wnt/β-catenin-Annexin A1 pathway in the process of sevoflurane-induced cognitive dysfunction[J] .J Neurochem,2016,137(2):240-252.
[3] Shen W,Lu K,Wang J,et al.Activation of mTOR signaling leads to orthopedic surgery-induced cognitive decline in mice through β-amyloid accumulation and tau phosphorylation[J] .Mol Med Rep,2016,14(4):3925-3934.
[4] Hu Y,Shi S,Liu X,et al.Effects of heart bypass surgery on plasma Aβ40 and Aβ42 levels in infants and young children[J] .Medicine (Baltimore),2016,95(6):e2684.
[5] Wei C,Luo T,Zou S,et al.Differentially expressed lncRNAs and miRNAs with associated ceRNA networks in aged mice with postoperative cognitive dysfunction[J] .Oncotarget,2017,8(34):55901-55914.
[6] Zhao B,Pan Y,Wang Z,et al.Hyperbaric oxygen pretreatment improves cognition and reduces hippocampal damage via p38 mitogen-activated protein kinase in a rat model[J] .Yonsei Med J,2017,58(1):131-138.
[7] Kesavardhana S,Kanneganti TD.Mechanisms governing inflammasome activation,assembly and pyroptosis induction[J] .Int Immunol,2017,29(5):201-210.
[8] Palacios-Macapagal D,Connor J,Mustelin T,et al.Cutting edge:eosinophils undergo caspase-1-mediated pyroptosis in response to necrotic liver cells[J] .J Immunol,2017,199(3):847-853.
[9] Xu D,Liu Z,Wang S,et al.Astrocytes regulate the expression of Sp1R3 on oligodendrocyte progenitor cells through Cx47 and promote their proliferation[J] .Biochem Biophys Res Commun,2017,490(3):670-675.
[10] Sun S,Sun D,Yang L,et al.Dose-dependent effects of intravenous methoxamine infusion during hip-joint replacement surgery on postoperative cognitive dysfunction and blood TNF-α level in elderly patients:a randomized controlled trial[J] .BMC Anesthesiol,2017,17(1):75.
[11] Xun C,Mamat M,Guo H,et al.Tocotrienol alleviates inflammation and oxidative stress in a rat model of spinal cord injury via suppression of transforming growth factor-β[J] .Exp Ther Med,2017,14(1):431-438.
[12] Jean YY,Baleriola J,Fà M,et al.Stereotaxic infusion of oligomeric amyloid-beta into the mouse hippocampus[J] .J Vis Exp,2015,(100):e52805.
[13] Zhang Y,Li D,Luo J,et al.Pharmacological postconditioning with sevoflurane activates PI3K/AKT signaling and attenuates cardiopulmonary bypass-induced lung injury in dog[J] .Life Sci,2017,173:68-72.
[14] Martin L,Gombert A,Chen J,et al.The β-d-endoglucuronidase heparanase is a danger molecule that drives systemic inflammation and correlates with clinical course after open and endovascular thoracoabdominal aortic aneurysm repair:lessons learnt from mice and men[J] .Front Immunol,2017,8:681.
[15] Hughes FM,Vivar NP,Kennis JG,et al.Inflammasomes are important mediators of cyclophosphamide-induced bladder inflammation[J] .Am J Physiol Renal Physiol,2014,306(3):F299-F308.
[16] Thurston TL,Matthews SA,Jennings E,et al.Growth inhibition of cytosolic Salmonella by caspase-1 and caspase-11 precedes host cell death[J] .Nat Commun,2016,7:13292.

