PiCCO指导下的液体复苏对合并心肌损伤感染性休克患者预后的影响
钱志贤,宋 佳,周娟娣,龚仕金,明自强,刘丹平,叶 斌,宋飞珍
心肌损伤是严重脓毒症和感染性休克最常见的并发症之一[1]。合并心肌损伤感染性休克患者的液体复苏更加复杂,更需要动态评估患者的血流动力学状态、心功能及肺水的变化。脉搏指示剂连续心排血量(pulse indicator continuous cadiac output,PiCCO)是一种将热稀释技术和脉搏轮廓分析技术结合起来的微创血流动力学监测方法,能通过床旁监测获得多项反映患者容量、肺水及心功能参数。已经有多项研究表明[2~4],PiCCO在重症患者的液体复苏、液体管理、利尿剂应用、治疗效果的评价等方面具有重要作用。本研究应用PiCCO监测指导合并心肌损伤的感染性休克患者早期液体复苏,探讨其对患者预后的影响。
1 资料和方法
1.1 一般资料:选取2014年4月至2016年4月收治于本院ICU的感染性休克患者60例,其中男33例,女27例,年龄26~94岁,平均(69.43±13.84)岁。入选标准:年龄≥18岁;符合2012严重脓毒症与感染性休克治疗国际指南(SSC 2012)[5]中感染性休克的诊断标准;存在下列任何一项心肌损伤的证据:血清肌钙蛋白I(troponin I,TnI)>0.1μg/L,血清B型脑钠肽(brain natriuretic peptide,BNP)>100ng/L。排除标准:年龄<18岁、孕妇、恶性肿瘤等终末期疾病者、严重肝功能衰竭、慢性肾脏病、急性冠状动脉综合征、慢性心力衰竭等基础心脏疾病。本研究符合医学伦理标准,并通过医院伦理委员会批准,所有治疗及监测获得签署知情同意书。
1.2 方法:
1.2.1 本研究为前瞻性队列研究,入选后对所有患者进行抗休克治疗(液体复苏、血管活性药物、抗菌药物、机械通气等),所有患者经颈内静脉或锁骨下静脉置入上腔静脉导管(ARROW导管,美国ARROW公司)进行中心静脉压(central venous pressure,CVP)测定,并抽取中心静脉血标本进行血气分析检查(IL GEM3000,美国GEM公司)。PiCCO组经股动脉放置PiCCO导管,连接监护仪(德国PULSION公司)进行血流动力学监测。
1.2.2 干预方法:入选患者根据数字表法随机分成两组:PiCCO组和对照组各30例。PiCCO组根据胸腔内血容积指数(intrathoracic blood volume index,ITBVI)及心指数(cardiacindex,CI)指导液体复苏,使ITBVI达到850~1000ml/m2且CI≥2.5L/min·m2;如ITBVI>1000ml/m2但CI仍<2.5L/min·m2或左心收缩指数(dPmax)降低,则使用多巴酚丁胺或米力农调节心功能;根据体循环阻力指数(systemic vascularresistance index,SVRI)调节去甲肾上腺素(NE)剂量以平稳维持平均动脉压(mean arterial pressure,MAP)≥65mmHg;根据血管外肺水指数(extravascular lung water index,EVLWI)指导液体的选择及利尿剂的应用;如中心静脉血氧饱和度(central venous oxygen saturation,ScvO2)<70%且红细胞压积(hematocrit,HCT)<30%,则输注红细胞使HCT≥30%。
对照组按照SSC 2012给予早期目标导向治疗(earlygoal_directed therapy,EDGT)集束化方案复苏[5]。对存在低血压或高乳酸血症患者30分钟内给予1000ml晶体液或者500ml胶体液,直到CVP≥8mmHg;如MAP<65mmHg,使用NE维持MAP≥65mmHg;如ScvO2<70%且HCT<30%,则输注红细胞使HCT≥30%。6h液体复苏治疗目标为:CVP:8~12mmHg;MAP≥65mmHg;ScvO2≥70%;尿量≥0.5ml/kg·h。
1.2.3 数据采集和记录:所有入选患者在诊断为感染性休克时及复苏后第6h、24h、48h、72h记录以下数据:TnI、BNP、MAP、CVP、ScvO2、白细胞计数(WBC)、C反应蛋白(CRP)、动脉血乳酸;复苏液体量、尿量、液体正平衡量。
本研究主要终点为28d病死率。次要终点为第3d序贯器官衰竭(sequential organ failure assessment,SOFA)评分,存活不满3d者记录死亡当天SOFA评分;机械通气时间;住ICU时间。
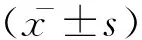
2 结果
2.1 两组患者一般临床资料比较:两组患者年龄、性别、急性生理学与慢性健康状况Ⅱ(Acute Physiology and ChronicHealth Evaluation II,APACHEⅡ)评分等一般临床资料差异均无统计学意义(P>0.05),见表1。

表1 两组合并心肌损伤感染性休克患者的一般临床资料比较
2.2 两组患者液体复苏前后血流动力学参数、氧代谢参数及心功能参数比较:PiCCO组在复苏第24h、48h和72h的BNP均低于对照组,差异有统计学意义(均P<0.05)。PiCCO组在复苏第48h及72h的CVP低于对照组,差异有统计学意义(均P<0.05)。

表2 两组合并心肌损伤感染性休克患者复苏前后各项指标比较
注:与PiCCO组同一时间点比较*P<0.05
2.3 两组患者复苏液体量、尿量及液体正平衡量比较:PiCCO组在复苏第24h、48h及72h的复苏液体量和液体正平衡量均少于对照组,差异具有统计学意义(均P<0.05),见表3。

表3 两组合并心肌损伤感染性休克患者复苏前后液体量及尿量比较[M(P25,P75)]
注:与PiCCO组同一时间点比较*P<0.05
2.4 两组患者的终点比较:PiCCO组第3d SOFA评分、机械通气时间、住ICU时间均低于对照组,差异有统计学意义(均P<0.05)。两组28d病死率差异无统计学意义(P>0.05),生存曲线比较差异无统计学意义(log_rank=0.67,P>0.05),见表4。

表4 两组合并心肌损伤感染性休克患者终点比较
注:与对照组比较*P<0.05
3 讨论
脓毒症是由宿主对感染的反应失调引起的危及生命的器官功能障碍,感染性休克是脓毒症的一种,伴随着组织低灌注的发生,具有很高的发病率及死亡率[6]。心脏是感染性休克最常见的受累器官[7],有研究表明[8,9],无基础心脏疾病的感染性休克患者左心收缩功能减退非常常见,且发生率随时间增加而增加,感染性休克第1天发生率约40%,第3天约60%,而一旦合并心肌损伤可加重疾病的严重程度,多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的发生率及死亡风险也将大大增加。尽管目前缺乏统一的诊断标准,但多项研究[10~12]表明脓毒症相关的心肌损伤有以下3个特点:左右心室的急性扩张、左室射血分数(left ventricular ejection fraction,LVEF)下降、心功能在7~10天后恢复正常。
早期识别脓毒症相关的心肌损伤,对制定合适的治疗方案是至关重要的。多项研究表明[13,14],TnI能反映脓毒症心肌损伤程度,且其升高预示着更高的疾病严重程度以及不良的临床预后。BNP作为一种具有利尿、扩血管、抑制肾素和醛固酮的释放等作用的神经内分泌激素,最初被用于充血性心力衰竭的诊断和危险分层。在脓毒症和感染性休克患者中的研究[15,16]也表明,BNP在脓毒症和感染性休克患者中普遍升高,且升高水平与脓毒症心肌损伤的发生密切相关。由于肌钙蛋白和BNP水平变化与脓毒症心肌损伤的程度有良好相关性,故本研究将其作为脓毒症心肌损伤的诊断指标。
除了控制感染源和应用合适的抗生素以外,感染性休克治疗的关键环节是及时充足的液体复苏和血流动力学支持[17]。需要根据不同患者制定个体化的液体策略,此时连续动态的容量评估以及心血管功能的监测显得非常重要。PiCCO技术能获得一系列反映前负荷、心功能、后负荷及肺水的参数。热稀释技术测得的全心舒张末容积指数(global enddiastolic volume index,GEDVI)和ITBVI两个容量指标被认为是敏感、可重复,且不受呼吸运动和心肌顺应性影响的反映心脏前负荷的指标[18~20]。EVLWI作为定量评估肺水肿的指标,被认为与感染性休克患者临床预后密切相关[21]。本研究中两组患者复苏6h后的乳酸水平均有明显下降,且ScvO2均达标,说明两组患者都接受了有效的早期液体复苏,组织低灌注得到改善,此时两组复苏液体量无明显差异。此外,本研究也发现PiCCO组24~72h的复苏液体量及液体正平衡量明显低于对照组。液体正平衡是感染性休克患者死亡的独立危险因素,液体正平衡越多,持续时间越久,患者预后越差[22]。特别是初步液体复苏后,判断患者是否能从进一步的液体治疗中获益应基于详细的临床检查以及更先进的血流动力学监测。PiCCO监测的容量、肺水等参数能指导“滴定式”的液体治疗,SVV能动态评估容量反应性,用更少的液体达到改善组织灌注的目标,减少液体过负荷的风险。本研究中对照组复苏后第24h~72h的BNP水平明显高于PiCCO组也说明EGDT指导的液体复苏可能导致更多容量过负荷。有研究[23]显示,容量过负荷时随着左室充盈压的升高及右心功能障碍的加重,BNP水平也随之升高。
先前有研究[24]报道,相比较传统的EGDT集束化治疗方案,PiCCO指导的改良集束化治疗能减轻感染性休克患者的疾病严重程度,更准确地指导液体复苏,减少肺水,缩短机械通气和住ICU时间,本文与之相似。但是对于合并心肌损伤的感染性休克患者,PiCCO是否能改善患者临床预后目前尚缺乏相关研究。已经有多项研究证明[25~27],CVP不是一个评估容量状态的可靠指标,亦不能预测容量反应性程度。感染性休克早期,即使达到8~12mmHg的CVP目标,患者仍可能存在容量不足或过负荷,而这两种情况都与更差的预后密切相关。
本研究也存在一些不足:首先,由于设备和技术的原因,本研究中没有使用超声心动图评估心功能,其次,本研究为小样本量研究,两组患者的主要终点未发现统计学差异,仍需设计完善的大样本量研究来证实PiCCO指导下的液体复苏对合并脓毒症心肌损伤的感染性休克患者病死率的影响。
综上所述,本研究显示,相比较传统EGDT方案,PiCCO指导下的血流动力学管理能优化合并心肌损伤感染性休克患者的液体复苏,减少液体过负荷的风险,并减轻器官功能障碍的程度,缩短机械通气时间和住ICU时间。
[1]Antonucci E, Fiaccadori E, Donadello K, et al. Myocardial depression in sepsis: From pathogenesis to clinical manifestations and treatment[J]. J Crit Care,2014,29(4):500-511.
[2]唐坎凯,温晓红,董朝晖,等.感染性休克患者PiCCO指导早期液体复苏的临床研究[J].中华急诊医学杂志,2012,21(009):1039-1041.
[3]Liu X, Ji W, Wang J, et al. Application strategy of PiCCO in septic shock patients[J]. Experimental and therapeutic medicine,2016,11(4):1335-1339.
[4]伊敏,么改琦,郭向阳.脉搏指示连续心排血量监测下脓毒性休克患者心功能变化的前瞻性研究[J].中华危重病急救医学,2015,27(1):22-27.
[5]Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit CareMed,2013,41(2):580-637.
[6]Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis_3)[J]. JAMA,2016,315(8):801-810.
[7]Vieillard_Baron A, Cecconi M. Understanding cardiac failure in sepsis[J]. Intensive care Med,2014,40(10):1560.
[8]Vieillard_Baron A, Prin S, Chergui K, et al. Hemodynamic instability in sepsis: bedside assessment by Doppler echocardiography[J]. Am J Respir Crit Care Med,2003,168(11):1270-1276.
[9]Bouhemad B, Nicolas_Robin A, Arbelot C, et al. Isolated and reversible impairment of ventricular relaxation in patients with septic shock[J]. Critical care Med,2008,36(3):766-774.
[10]Parker MM, Shelhamer JH, Bacharach SL, et al. Profound but reversible myocardial depression in patients withseptic shock[J]. Ann Intern Med,1984,100(4):483-490.
[11]Kakihana Y, Ito T, Nakahara M, et al. Sepsis_induced myocardial dysfunction: pathophysiology andmanagement[J]. J Intensive Care,2016,4(1):22.
[12]Sato R, Nasu M. A review of sepsis_induced cardiomyopathy[J]. J Intensive Care,2015,3(1):48.
[13]Landesberg G, Jaffe AS, Gilon D, et al. Troponin elevation in severe sepsis and septic shock: the role of left ventricular diastolic dysfunction and right ventricular dilatation[J]. Critical care medicine,2014,42(4):790-800.
[14]Masson S, Caironi P, Fanizza C, et al. Sequential N_terminal pro_B_Type natriuretic peptide and high_sensitivity cardiac troponin measurements during albumin replacement in patients with severe sepsis or septic shock[J]. Crit Care Med,2016,44(4):707-716.
[15]Papanikolaou J, Makris D, Mpaka M, et al. New insights into the mechanisms involved in B_type natriuretic peptide elevation and its prognostic value in septic patients[J]. Crit Care,2014,18(3):R94.
[16]Post F, Weilemann LS, Messow CM, et al. B_type natriuretic peptide as a marker for sepsis_induced myocardial depression in intensive care patients[J]. Crit Care Med,2008,36(11):3030-3037.
[17]Vincent JL, De Backer D. Circulatory shock[J]. N Engl J Med,2013,369(18):1726-1734.
[18]Compton F, Vogel M, Zidek W, et al. Changes in volumetric hemodynamic parameters induced by fluid removal on hemodialysis in critically ill patients[J]. Ther Apher Dial,2015,19(1):23-29.
[19]Kapoor PM, Bhardwaj V, Sharma A, et al. Global end_diastolic volume an emerging preload marker vis_a_vis other markers_Have we reached our goal[J]? Ann Card Anaesth,2016,19(4):699.
[20]徐永昊,刘晓青,何为群,等.胸腔内血容量指数在感染性休克患者液体管理中的应用[J].中国危重病急救医学,2011,23(8):462-466.
[21]Zhang Z, Lu B, Ni H. Prognostic value of extravascular lung water index in critically ill patients: a systematic review of the literature[J]. J Crit Care,2012,27(4):421-428.
[22]Garzotto F, Ostermann M, Martín_Langerwerf D, et al. The dose response multicentre investigation on fluid assessment (DoReMIFA) in critically ill patients[J]. Crit Care,2016,20(1):196.
[23]Celik G, Silinou E, Vo Van C, et al. PlasmaBNP, a useful marker of fluid overload in hospitalized hemodialysis patients[J]. Hemodial Int,2012,16(1):47-52.
[24]卢年芳,郑瑞强,林华,等.PiCCO指导下集束化治疗感染性休克的临床研究[J].中华危重病急救医学,2014,26(1):23-27.
[25]Marik PE, Monnet X, Teboul JL. Hemodynamic parameters to guide fluidtherapy[J]. Ann Intensive Care, 2011,1(1):1.
[26]Magder S. Understanding central venous pressure: not a preload index[J]. Curr Opin Crit Care,2015,21(5):369-375.
[27]Boyd J H, Forbes J, Nakada T, et al. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality[J]. Crit Care Med,2011,39(2):259-265.

