不同病期慢性阻塞性肺疾病趋化因子受体3和淋巴细胞亚群的表达及其影响
张志亮,李斯南,陈 昊,罗 涛,陈玉玲
(徐州医科大学附属医院呼吸内科,江苏 徐州 221002)
不同病期慢性阻塞性肺疾病趋化因子受体3和淋巴细胞亚群的表达及其影响
张志亮,李斯南,陈 昊,罗 涛,陈玉玲
(徐州医科大学附属医院呼吸内科,江苏 徐州 221002)
目的 观察急性加重期、稳定期慢性阻塞性肺疾病(COPD)患者血中的趋化因子受体3(CXCR3)及淋巴细胞亚群水平,并阐明其对COPD的影响。方法 选取徐州医科大学附属医院呼吸内科2015年1月至2016年6月先后收治的急性加重期、稳定期COPD患者以及健康体检人员各43例,将其分为急性加重期组、稳定期组及健康对照组;检测血中T细胞亚群、B淋巴细胞及CXCR3的表达水平,并进行分析比较。结果 与健康对照组比较,各病期的COPD患者血中T细胞亚群的CD3+、CD4+、CD4+/CD8+以及B淋巴细胞水平明显降低,差异均有统计学意义(P<0.05),同时,急性加重期组和稳定期组的血中T细胞亚群的趋化因子受体3(CXCR3)在CD4+、CD8+表面的表达均明显增高,且急性加重期组也高于稳定期组,差异有统计学意义(P<0.05)。结论 急性加重期的COPD患者机体的细胞免疫系统和体液系统功能失衡,淋巴细胞亚群与其趋化因子受体3对急性加重期的COPD患者的病情发生和发展可能具有重要影响。
淋巴细胞亚群;趋化因子受体3;慢性阻塞性肺疾病
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统中一种慢性进展性疾病,并以肺部不可逆的气流受限和持续的炎症性反应为特征[1]。近年来,人们一直对其发病机制进行了许多研究。目前关于淋巴细胞对COPD影响的研究相对较少。资料表明,淋巴细胞中的T细胞是COPD发病中重要的炎症细胞,其表面存在的趋化因子(chemokine)发挥了重要作用,其中CXC型趋化因子受体3(CXCR3)是与趋化因子结合的重要受体之一,广泛地存在于T淋巴细胞的表面,与淋巴细胞向炎症部位迁移密切相关[2],但也还有争议。本研究旨在观察不同病期的COPD,各淋巴细胞表面CXCR3及其亚群的表达水平,以阐明其临床意义。
1 资料与方法
1.1 一般资料 选取徐州医科大学附属医院呼吸内科呼吸内科2015年1月至2016年6月收治的43例急性加重期COPD患者、43例稳定期COPD患者以及43例健康体检人员,将其分为急性加重期组、稳定期组及健康对照组。其中急性加重期组女性18例,男性25例,年龄45~89岁,平均(65.2±4.3)岁;稳定期组女性19例,男性24例,年龄49~85岁,平均(69.3±6.5)岁;健康对照组女性21例,男性22例,年龄52~87岁,平均(67.4±3.9)岁,三组受试者的性别和年龄比较差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 COPD患者的诊断按照2013年中华医学会呼吸病学分会《慢性阻塞性肺疾病诊治指南》标准进行[3]。对COPD加重期的患者排除急性心肌梗死、哮喘急性发作、糖尿病、免疫系统及恶性肿瘤等疾病;COPD稳定期的患者是在加重期后有效地抗感染、止咳祛痰、气道通畅、病情稳定一周后者;健康对照组为我院体检中心同期、无吸烟史、无心肺等疾病的健康体检者。
1.3 仪器与试剂 采用美国Beckman流式细胞仪及其随同原装试剂。
1.4 方法
1.4.1 检测的指标 对急性加重期组、稳定期组患者以及健康对照组静脉血中CXCR3、T淋巴细胞亚群(CD3+,CD4+,CD4+/CD8+)及 B淋巴细胞表达的百分比。
1.4.2 受试者的静脉血单个核细胞(PBMNC)的提取和分离 COPD急性加重期患者于入院后次日的清晨空腹抽取4 mL静脉血置于抗凝管,用等体积的PBS缓冲液混匀后最后加入淋巴细胞分离液,以密度梯度离心法分离出单个核淋巴细胞;COPD稳定期患者于治疗后稳定一周时抽血检查,健康对照组者体检时抽血检查。
1.4.3 流式细胞仪检测T淋巴细胞亚群及B细胞的表达[4-5]将已制备的PBMNC悬液100 μL分别加入流式细胞仪专用试管甲、乙两管内。然后在甲管中加入PE(藻红蛋白)标记的抗CD4+抗体和FITC(异硫氰酸荧光素)标记的抗CD8+抗体、PerCP(多甲藻黄素-叶绿素-蛋白质复合物)标记的抗CD3+抗体、APC标记的抗CD19+抗体(B淋巴细胞特异性标记物)各5 μL;乙管中加入同型相应对照液。经混匀、室温避光30 min,固定洗涤后上机检测各细胞亚群比例。
1.4.4 流式细胞仪检测T淋巴细胞亚群表面CXCR3的表达 取已制备的PBMNC悬液100 μL分别加入流式细胞仪专用试管甲、乙两管内。然后在甲管中加入PE(藻红蛋白)标记的抗CD4+抗体和FITC(异硫氰酸荧光素)标记的抗CD8+抗体、PE-Cy5标记的抗CXCR3抗体各5 μL;乙管中加入同型相应对照液。经混匀、室温避光30 min,固定洗涤后上机检测并分析计算CXCR3表达的百分比[6]。
1.5 统计学方法 应用SPSS18.0统计学软件进行数据分析,计数资料采用百分率(%)表示,组间比较采用χ2检验,计量资料以均数±标准差(s)表示,多组间比较采用单因素方差分析,组间两两比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 三组受试者淋巴细胞各亚群表达水平比较 与健康对照组比较,稳定期组、急性加重期COPD组的血中 CD3+、CD4+、CD4+/CD8+、B细胞水平明显降低,差异具有统计学意义(P<0.05),见表1。
2.2 三组受试者CD4+CXCR3、CD8+CXCR3表达水平比较 与健康对照组比较,稳定期组、急性加重期组的外周血CD4+、CD8+T淋巴细胞表面的CXCR3表达水平均明显增高,且急性加重期组高于稳定期组,差异有统计学意义(P<0.05),见表2。
表1 三组受试者淋巴细胞各亚群表达水平比较s,%)
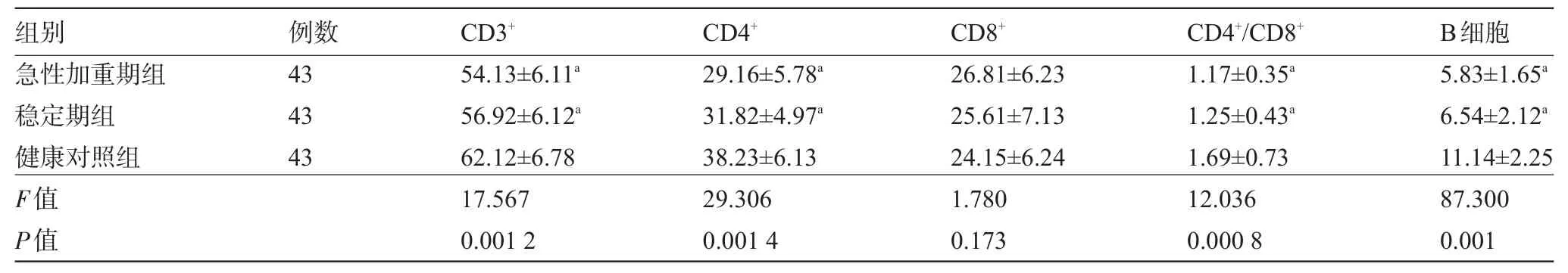
表1 三组受试者淋巴细胞各亚群表达水平比较s,%)
注:与健康对照组比较,aP<0.05。
?
表2 三组受试者CD4+CXCR3、CD8+CXCR3表达水平比较(,%)
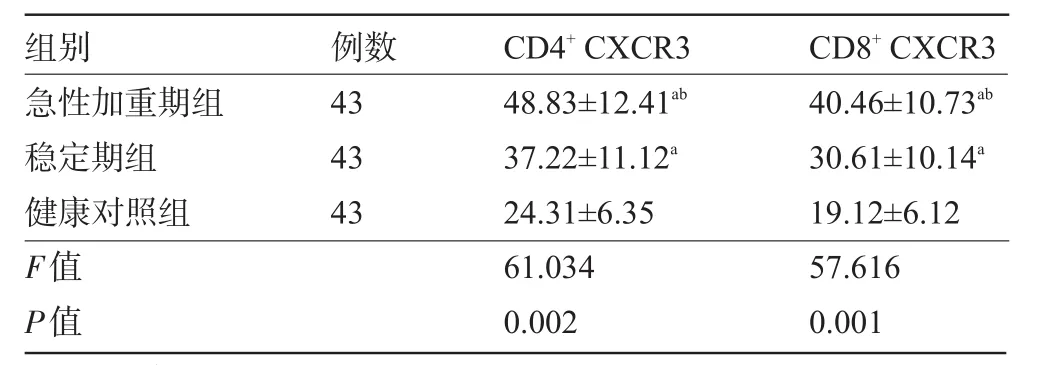
表2 三组受试者CD4+CXCR3、CD8+CXCR3表达水平比较(,%)
注:与健康对照组比较,aP<0.05;与稳定期组比较,bP<0.05。
?
3 讨论
COPD是一种常见的呼吸系统慢性炎症性疾病,可进一步发展为肺心病和呼吸衰竭,具有较高的致残率和病死率,已成为国内导致患者死亡的主要原因之一[7-8],对COPD发病机制的研究始终是这一领域的热点,但尚未完全阐明,COPD急性发作的最主要原因是由有害气体或颗粒进入呼吸道诱发急性炎症所致[9]。多数认为COPD主要与自由基、炎性细胞(如中性粒细胞、淋巴细胞)的参与有关,肺泡巨噬细胞、T淋巴细胞和中性粒细胞在COPD患者肺组织中浸润,并且与气流受限的程度呈正相关[10-11]。故笔者认为:深入研究COPD的发病机制是寻找其有效防治和改善预后的关键。
众所周知,淋巴细胞是人体免疫系统中最重要的部分,它们参与人体细胞免疫和体液免疫,不仅具有识别和排斥抗原的作用,而且对人体的免疫应答具有重要的调节能力,它们能够防御病毒和细菌的感染。此外,在呼吸道及全身炎症损伤中,T淋巴细胞亚群的免疫功能出现了异常,故被认为,T淋巴细胞是免疫系统内最重要的细胞群之一;B淋巴细胞主要参与机体的体液免疫,其数量的减少可反映体液免疫功能的低下。COPD的老年患者,由于其免疫功能下降,甚至出现明显的免疫功能异常[12]。
本研究显示,在急性加重期及稳定期的COPD患者血中T淋巴细胞各亚群CD3+、CD4+、CD4+/CD8+及B淋巴细胞的百分率与健康对照组比较明显降低,其差异具有统计学意义(P<0.05),尤其在急性加重期更为显著,在稳定期患者也尚未完全达到健康对照组水平,表明COPD患者在不同的病期均存在着持续的免疫功能的失衡,故此类患者很容易出现呼吸道反复感染。CD4+能辅助IgG、IgA、IgM合成,CD4+细胞减少导致产生淋巴因子协助B细胞产生抗体和辅助其他淋巴细胞的功能减弱。CD8+能抑制B细胞产生抗体[13-14]。T淋巴细胞各亚群CD3+、CD4+、CD4+/CD8+下降可导致单核吞噬细胞活性降低,同时还可引起B淋巴细胞分泌抗体减少而易致反复的呼吸道感染,使病程迁延。我们的研究,进一步证明了淋巴细胞的免疫反应性在COPD发病机制中确实占有重要地位。
近来的研究显示,趋化因子受体3(CXCR3)在由炎症细胞等释放后,主要在活化的T淋巴细胞等表面表达,在局部炎症、移植排异反应等发挥重要作用[15],我们的实验结果提示,急性加重期组和稳定期组的COPD患者血中 CD4+、CD8+T淋巴细胞表面的CXCR3表达百分率与对照组比较,均明显增高(P<0.05),并且急性加重期组也高于稳定期组,差异均有统计学意义(P<0.05)。故而笔者推测:在急性加重期组和稳定期的COPD患者,炎症细胞等释放的CXCR3增多,在活化的T淋巴细胞等表面表达增加,可能与多种趋化因子迅速结合,导致大量的炎症细胞聚集到炎症部位,致使肺部炎症反复发作。由此可见,CXCR3是COPD病情发生和发展的相当重要的炎症介质,参与了肺部炎症的形成和加重。本研究的重要意义在于为如何抑制CXCR3配体的生成、阻断CXCR3与其配体的结合及其结合后的活化过程,以减轻肺部的炎症反应,提供了新的思考,这也是我们要共同面对的待解课题。
[1]Curtis JL.At the Checkpoint:Lung CD8+T Cells,Respiratory Viruses,and Chronic Obstructive Pulmonary Disease[J].American journal of respiratory and critical care medicine,2016,193(6):600-602.
[2]Lee S,Matsuzaki H,Maeda M,Yamamoto S,et al.Accelerated cell cycle progression of human regulatory T cell-like cell line caused by continuous exposure to asbestos fibers[J].Int J Oncol,2017,77(10):2594-2606.
[3]中华医学会呼吸病学分会慢性阻塞性肺疾病学组,慢性阻塞性肺疾病诊治指南(2013年修订版)[S].中华内科杂志,2013,46(36):254-261.
[4] Hodge G,Jersmann H,Hai B.et al.Lymphocyte senescence in COPD is associated with decreased histone deacetylase 2 expression by pro-inflammatory lymphocytes[J].Respiratory research,2015,16:130-131.
[5]杨晓霞,高兴林,李东风,等.老年慢性阻塞性肺疾病患者外周血T细胞表达趋化因子受体3的研究[J].国际呼吸杂志,2010,30(21):1281-1284.
[6]Costa C,Rufino R,Traves SL,et al.CXCR3 and CCR5 chemokines in induced sputum from patients with COPD[J].Chest,2008,133(1):26-33.
[7] Zhou M,Wang H,Zhu J,et al.Cause-specific mortality for 240 causes in China during 1990-2013:a systematic subnational analysis for the Global Burden of Disease Study 2013[J].Lancet,2016,387(10015):251-272.
[8]郑晓燕,陈芳建,吴芬芝.COPD患者外周血淋巴细胞亚群及其表面受体CXCR3的表达及相关分析[J].中国卫生检验杂志,2015,17(15):2919-2921.
[9]Agusti A,Soriano JB.Chronic obstructive pulmonary disease as a systemic disease[J].COPD,2008,5(2):133-138.
[10]Obeidat M,Nie Y,Chen V,et al.Network-based analysis reveals novel gene signatures in peripheral blood of patients with chronic obstructive pulmonary disease[J].Respir Res,2017,18(1):72.
[11]Lee B,Ko E,Lee J,Jo Y,et al.Soluble common gamma chain exacerbates COPD progress through the regulation of inflammatory T cell response in mice[J].Int J Chron Obstruct Pulmon Dis,2017,12:817-827.
[12]王娜,张湘燕,张程,等.慢性阻塞性肺疾病患者免疫功能的变化[J].贵州医药,2011,35(7):593-595.
[13]Kubota M,Taniguchi M,Tobisawa S,et al.T-Cell/Histiocyte-Rich Large B-Cell Lymphoma Presented as T-Lymphoid Hyperplasia Involving the Central Nervous System[J].Cureus,2017,9(3):e1119.
[14]Iwata S,Tanaka Y.The importance of B cell-T cell interaction in autoimmune diseases[J].Nihon Rinsho Meneki Gakkai Kaishi,2015,38(5):398-402.
[15]Srivastava R,Khan AA,Chilukuri S,et a1.CXCL10/CXCR3-Dependent Mobilization of HSV-Specific CD8+TEM and CD8+TRM Cells within Infected Tissues Allows Efficient Protection Against Recurrent Herpes Infection and Disease[J].J Virol,2017,91(14):e00278-17.
Expression and effect of CXCR3 and lymphocyte subsets at different stages in patients with chronic obstructive
pulmonary diseases.ZHANG Zhi-liang,LI Si-nan,CHEN Hao,LUO Tao,CHEN Yu-ling.Department of Respiratory,the Affiliated Hospital of Xuzhou Medical University,Xuzhou 221002,Jiangsu,CHINA
Objective To observe the changes in the expression chemokine receptor 3(CXCR3)and lymphocyte subsets in patients with acute exacerbation and stable chronic obstructive pulmonary disease(COPD)and to elucidate their effect on COPD.Methods During January 2015 to June 2016,43 cases of acute exacerbating of COPD patients,43 stable COPD patients,and 43 healthy people in our hospital were selected as the research objects.The expression levels of T lymphocyte subsets,B lymphocytes and CXCR3 in blood were measured and analyzed.Results Compared with the control group,The levels of CD3+,CD4+,CD4+/CD8+of the T lymphocyte subsets and B lymphocyte subsets were significantly decreased in different COPD patients(P<0.05);while the expression levels of CXCR3 on the surfaces of CD4+and CD8+of the T lymphocyte subsets in peripheral blood of different COPD patients were increased significantly,and those of the acute exacerbating of COPD patients were significantly higher than the stable COPD patients(P<0.05).Conclusion The functions of the cellular immunity system and the humoral immunity system were dysbalanced apparently in patients with COPD acute exacerbating period.Lymphocyte subsets and their CXCR3 may have a significant effect on the onset and development of COPD patients with acute exacerbations.
Lymphocyte subset;CXC chemokine receptor 3(CXCR3);Chronic obstructive pulmonary disease
R563
A
1003—6350(2017)19—3208—03
10.3969/j.issn.1003-6350.2017.19.037
江苏省徐州市科技局社会发展科技计划资助项目(编号:KC14SH092)
张志亮。E-mail:zzl_xz@msn.cn
2017-01-07)

