二补助育改良方对小鼠子宫内膜胞饮突、LIF、ER和PR表达的影响
石玥 穆国华 吴丽婷 申萌萌 赵青竹 刘雁峰
二补助育改良方对小鼠子宫内膜胞饮突、LIF、ER和PR表达的影响
石玥 穆国华 吴丽婷 申萌萌 赵青竹 刘雁峰
目的 观察二补助育改良方对胚泡着床障碍模型小鼠子宫内膜胞饮突、白血病抑制因子(leukemia inhibitory factor,LIF)、雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)表达的影响。 方法 建立小鼠胚泡着床障碍模型,将50只实验动物分为5组:空白组、模型组、西药组1(补佳乐组)、西药组2(阿司匹林组)、二补助育改良方组,每组10只。造模与给药同时进行,其后处死小鼠,扫描电镜观察胞饮突的表达,并采用免疫组化HBP法检测小鼠子宫内膜LIF、ER、PR的表达量。 结果 扫描电镜下,二补助育改良方组小鼠子宫内膜表面形态较规整,大量微绒毛及丰富胞饮突表达,细胞之间的间隙明显。免疫组化结果示,二补助育改良方组小鼠子宫内膜LIF、ER、PR表达较模型组明显增加(P<0.05);LIF表达低于补佳乐组(P<0.05),ER表达优于补佳乐组(P<0.05),PR表达与补佳乐组无明显差异(P>0.05);各指标与阿司匹林组比较无明显差异(P>0.05)。 结论 二补助育改良方可能通过调节胚泡着床期子宫内膜胞饮突、LIF、ER和PR的表达,从而提高子宫内膜容受性,参与胚泡植入的黏附过程,改善着床障碍,创造良好的受孕环境,促进胚泡着床。
二补助育改良方; 子宫内膜容受性; 胞饮突; 白血病抑制因子; 雌激素受体; 孕激素受体
子宫内膜容受性,是指内膜对胚胎的接受能力,与体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的成功与否密切相关。近年来,中医药提高子宫内膜容受性的疗效逐渐得到肯定。二补助育汤是北京中医药大学东直门医院首席教授、名老中医肖承悰教授调治子宫内膜容受性低的经验方。在前期研究中[1-3],已对全方进行了相应的临床研究及实验研究,取得较好的研究结果,结果表明其能明显改善子宫内膜容受性。
方名中“二补”,是指原方以补骨脂、骨碎补为君药。鉴于目前对补骨脂的肝肾毒性存在争议,临床使用时,已将补骨脂去除以改良此方,故本课题选用二补助育改良方(去补骨脂,下称改良方)进一步研究。子宫内膜容受性的调控机制需要诸多因素的参与。其中,胞饮突,作为形态学指标,被认为是子宫内膜容受性的标志物;白血病抑制因子(leukemia inhibitory factor, LIF)目前被认为是种植着床预测的金标准;雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)与子宫内膜容受性的关系已经明确。故选用目前公认的、可视为标志性、影响子宫内膜容受性的指标——胞饮突、LIF、ER、PR,以期探讨二补助育改良方对子宫内膜容受性的影响,并阐明其对子宫内膜容受性的作用机制,为中医药提高子宫内膜容受性的作用机制提供实验依据。
1 材料与方法
1.1 实验动物
选用SPF级ICR小鼠,8~12周龄,体质量(25±2) g。由北京维通利华实验技术有限公司提供,生产许可证号:SCXK(京)2012-0001。对小鼠进行阴道涂片,检查动情周期,连续观察2个动情周期正常者。
1.2 主要药物
1.2.1 二补助育改良方 药物组成:骨碎补15 g、巴戟天15 g、桑寄生15 g、续断15 g、川牛膝15 g、鸡血藤15 g、郁金15 g。颗粒制剂购自北京中医药大学东直门医院门诊药房。
1.2.2 达必佳(醋酸曲普瑞林注射液) 规格1 mL∶0.1 mg,辉凌(德国)制药有限公司,进口药品批号H20100365;注射用尿促性素,规格:75单位,国药准字H20033108;注射用绒促性素,规格:1000单位,国药准字H44020674。以上均购自北京妇产医院药房。
1.2.3 补佳乐(戊酸雌二醇) 规格1 mg/片,DELPHARM Lille S.A.S.制药,进口药品批号:H20120368;阿司匹林肠溶片,规格100 mg/片,BayerS.p.A.制药,国药准字J20130078。以上均购自北京中医药大学东直门医院药房。
1.3 主要试剂与仪器
抗兔/鼠通用型免疫组化试剂盒REALTMEnVision+/HRP RABBIT/MOUSE,Dako Denmark A/S生产,货号K5007;摄像机PANASONIC型号MV-CP410,显微镜Olympus BH2;组化分析软件IMS细胞图像分析系统,医学图像分析软件,上海申腾信息技术有限公司。
ER(稀释比1∶300;货号ab32063;生产商Abcam,Cambridge,MA,USA);PR (稀释比1∶100;货号ab63605;生产商Abcam,Cambridge,MA,USA); LIF (稀释比1∶100;货号NBP2-27406;生产商Novus)。
1.4 方法
1.4.1 分组 实验动物共分为5组,分别为:空白组、模型组、西药组1(补佳乐组)、西药组2(阿司匹林组)、二补助育改良方组,每组10只。
1.4.2 动物模型的建立 采用GnRHa+HMG+HCG方案。造模方法:观察除空白组外的小鼠阴道涂片,从动情日开始,每日于上午9:00定时腹腔内注射达必佳40 IU/100 g体质量,连续9天,至第9天同时注射尿促性素1 U/100 g体质量促排卵,48小时后注射人绒毛膜促性腺激素10 IU/100 g体质量,造成胚泡着床障碍模型。
1.4.3 给药方法 于造模同时,空白组和模型组每日灌服生理盐水0.2 mL,二补助育改良方组每日按0.349 g/20 g的浓度灌服(相当于临床体重60 kg的成人剂量140 g/60 kg。西药组1每日灌服补佳乐0.006 mg/20 g(相当于临床体重60 kg的成人剂量2 mg/60 kg),西药组2每日灌服阿司匹林0.225 mg/20 g(相当于临床体重60 kg的成人剂量75 mg/60 kg),连续10天。
1.4.4 取材检测 于动物实验第11天,断颈处死小鼠,无菌条件下取全子宫,将其中一角子宫取0.5 cm长的管径,纵向剖开,磷酸盐PBS缓冲液充分洗涤后投入戊二醇中固定,选择内膜面平整容易观察的部位,备扫描电镜观察胞饮突表达;另一角子宫立即放在4%多聚甲醛中固定,石蜡包埋,切片,然后进行免疫组织化学染色。采用免疫组化HRP法测定小鼠子宫内膜LIF、ER、PR的表达。
1.5 统计学处理
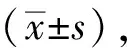
2 结果
2.1 扫描电镜观察胞饮突在各组小鼠子宫内膜的表达
空白组小鼠子宫内膜表面形态较规整,呈现胞饮突丰富表达,上皮细胞分布均勾,形态大小基本一致,之间界限清楚。模型组内膜局部有少量胞饮突表达,形态大小不一,微绒毛不明显,细胞间分界不清。西药组小鼠子宫内膜表面细胞形态不均一性,片状,褶皱,不饱满,胞饮突发育低小,可见微绒毛,细胞界限欠清。改良方组小鼠子宫内膜表面形态较规整,细胞表面有大量微绒毛及丰富的胞饮突,突起更明显,细胞之间的间隙明显,有利于细胞黏附。见下图1。
2.2 LIF、ER及PR在各组小鼠子宫内膜的表达比较
免疫组织化学分析,LIF在各组子宫内膜组织都有表达,组织定位表达的部位主要在腔上皮和腺上皮。与空白组比较,模型组小鼠子宫内膜LIF表达明显降低(P<0.05);与模型组比较,二补助育改良方组小鼠子宫内膜LIF表达明显增加(P<0.05);二补助育改良方组小鼠子宫内膜LIF表达与阿司匹林组比较无明显差异(P>0.05),却明显低于补佳乐组(P<0.05),补佳乐组与阿司匹林组无明显差异(P>0.05)。详见图2、表1。
免疫组织化学分析,ER、PR在各组小鼠子宫内膜的腺上皮、间质细胞均有表达。与空白组相比,模型组小鼠子宫内膜ER、PR表达明显降低(P<0.05);与模型组比较,二补助育改良方组小鼠子宫内膜ER、PR表达明显增加(P<0.05);二补助育改良方组小鼠子宫内膜ER表达明显高于补佳乐组(P<0.05),但PR表达与补佳乐组无明显差异(P>0.05),ER、PR表达与阿司匹林组无明显差异(P>0.05)。详见图3、图4、表1。

图1 扫描电镜观察胞饮突在各组小鼠子宫内膜的表达(×3000)

图2 显微镜观察到LIF在各组小鼠子宫内膜的表达情况(×200)

图3 显微镜观察到ER在各组小鼠子宫内膜的表达情况(×200)

图4 显微镜观察到PR在各组小鼠子宫内膜的表达情况(×200)
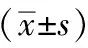
表1 各组小鼠子宫内膜LIF、ER、PR表达情况
注:与空白组比较,aP<0.05,与模型组比较,bP<0.05,与补佳乐组比较,cP<0.05,与阿司匹林组比较,dP>0.05。由于灌胃操作不当,模型组死亡1只,阿司匹林组死亡1只,二补助育改良组方死亡2只。
3 讨论
3.1 胞饮突与子宫内膜容受性的关系
子宫内膜上皮细胞由纤毛细胞和微绒毛细胞组成。在月经周期黄体期子宫内膜上皮微绒毛细胞顶部出现平滑的膜状突起,微绒毛完全消失,形状如蘑菇,称之为胞饮突。胞饮突分3个阶段:发育中、发育完全、退化,其表达数量与胚胎种植率的关系紧密,主要在分泌中、晚期的子宫内膜表面出现,2天内发育完全和退化,出现时间个体差异可达5天,与着床窗出现的时间基本一致,被认为是子宫内膜着床窗开放的超微结构标志。血供不足的子宫内膜呈现胞饮突低表达,子宫内膜容受性降低,可能是导致着床失败的原因之一[4]。
3.2 LIF与子宫内膜容受性的关系
LIF的表达在人、锯齿类动物子宫内膜上呈周期性变化。卵泡期LIF表达低下,黄体中期达高峰。LIF及其受体的表达水平与胞饮突相一致,着床期宫腔冲洗液中LIF的浓度与妊娠率呈正相关[5]。近年来LIF在胚胎着床、妊娠维持和胚胎发育中的作用越发引起海内外学者的重视[6-7]。资料表明LIF在月经周期的第19~24天,即胚胎着床期呈高水平表达[8],基因敲除实验也证明LIF是胚胎着床的必要因子。部分不明原因不孕者、反复自然流产者子宫内膜LIF表达下降,这些都提示LIF可能参与胚胎着床。Mitchel等[8]发现LIF可提高胚胎的发育率、着床率、妊娠率。Sherwin等[9]也证实了 LIF的作用位点及与胚胎的作用。因此猜测LIF可能在人类生殖活动中扮演关键角色[10-11]。
3.3 ER、PR与子宫内膜容受性的关系
雌、孕激素可通过ER、PR对子宫内膜进行调节,在月经周期的第19天,子宫内膜腺上皮的ER、PR突然消失,并且其降调与胞饮突同时发生[12]。适当浓度的孕酮水平和子宫内膜PR的表达,是子宫内膜蜕膜化的必备条件。研究发现[13],封闭PR抗体或敲除PR基因,将阻断孕酮的效应,使子宫内膜不能顺利蜕膜化,导致胚泡难以着床。据研究表明[14],受卵巢甾体激素(E2/P)的调节,雌、孕激素与其受体结合启动下游分子的合成,是子宫内膜容受性形成的主要原因,是故ER、PR被认为是评价子宫内膜容受性的标志之一。
3.4 西药对照组
肖承悰教授认为,子宫内膜容受性低的主要病机为肾气不足,胞脉不畅,故以“肾主生殖”为主要理论基础,以“补肾气、通胞脉”为治法[15],从整体上调节肾—天癸—冲任—胞宫生殖轴,在局部又促进胞脉与胞宫以及其他脏腑经络之间的联系,改善子宫内膜血循环,从而促进胚胎着床及发育。
补佳乐(戊酸雌二醇)是雌激素家族中的一种,其作用机理可能是通过间接促进子宫内膜胞饮突的形成,调节相关蛋白在子宫内膜的表达,建立子宫内膜容受性状态,从而改善胚胎着床障碍。许多补肾中药的雌激素样作用已经获得普遍认同[16-17],本课题选用补佳乐侧重于补肾作用的对照。
阿司匹林作为乙酰水杨酸类药物,具有血管舒张功能和抗凝剂的性质,是其作为IVF-ET辅助用药的原因。机制为通过抑制环氧合酶而抑制血小板活性,预防微血栓形成,降低子宫动脉血流阻力,改善局部血循环,卵巢和子宫内膜的血流灌注,从而改善子宫内膜的生长,提高胚胎植入率或妊娠率。本课题选用阿司匹林侧重于“通胞脉”作用的对照。
3.5 二补助育改良方与子宫内膜容受性的关系
前期工作是针对二补助育汤原方展开。笔者观察了肖教授治疗子宫内膜容受性低患者120例,对其中42例进行了随访,再次IVF-ET受孕率为57.1%。另外,二补助育汤可以显著改善子宫内膜容受性低患者的症状,同时增加子宫内膜厚度,并提高雌激素水平,临床效果显著[2]。实验方面,二补助育汤可能通过干细胞因子(stem cell factor,SCF)等调控因子参与胚胎植入的黏附过程,从而影响子宫内膜容受性[3]。本实验未设置梯度,前期工作证实[3],高、中剂量均可改善子宫内膜容受性,故取前期工作全方的中剂量为参照,既保证疗效,又尽可能减少药物干预。
原方以补骨脂、骨碎补为君药,鉴于目前对补骨脂的肾毒性存在争议,肖教授在临床上多已弃用,故选用二补助育改良方(去补骨脂)进一步研究。改良方承于原方,“补(补肾气)、通(通胞脉)并用”之则未改,补肾气的同时注重通胞脉。本实验结果显示,二补助育改良方能明显促进胚泡着床障碍小鼠子宫内膜胞饮突的发育,以及明显提高LIF、ER、PR的表达,并基本持平甚或优于西药组。笔者认为,二补助育改良方可能通过调节胚泡着床期子宫内膜胞饮突、LIF、ER和PR的表达,从而提高子宫内膜容受性,参与胚泡植入的黏附过程,改善着床障碍,创造良好的受孕环境,促进胚泡着床,为临床提高再次IVF-ET成功率提供了实验依据。
[1] 王铁枫,刘雁峰,郭锐利.中医药对子宫内膜容受性作用的研究进展[J].北京中医药大学学报(临床版),2010,17(4):34-36.
[2] 刘雁峰,江媚,孙天琳,等.二补助育汤对子宫内膜容受性影响的临床研究[J].世界中医药,2012,7(3):195-197.
[3] 江媚,刘雁峰,黄羚,等. 基于小鼠胚泡着床障碍模型探讨二补助育汤对子宫内膜SCF mRNA表达的影响[J]. 中华中医药杂志,2014,(5):1583-1586.
[4] 冯苗,李素春.子宫内膜着床窗期血管生成状态及胞饮突表达对胚胎着床的影响[J].中国实用妇科与产科杂志,2010,26(7):525-529.
[5] AghajanovaL,Stavreus-Evers A, NikasY,et al. Coexpression of pinopodes and leukemia inhibitory factor, as well as its receptor,in human endometrium [J]. Fertility and sterility, 2003, 79(suppl 1): 808-814.
[6] Salleh N, Giribabu N.Leukemia inhibitory factor: roles in embryo implantation and in nonhormonal contraception[J]. Scientific World Journal, 2014: 201514.
[7] Chen QJ, Sun XX, Li L, et al. Effects of ovarian stimulation on endometrial integrin beta3 and leukemia inhibitory factor expression in the peri-implantation phase[J]. Fertil&Steril,2008, 89(5 suppl): 1357-1363.
[8] Mitchell M H,Swanson R J,Oehninger S.In vivo effect of leukemia inhibitory factor(LIF) and an anti-LIF polyclonal antibody on murine embryo and fetal development followingexposure at the time of transcervical blastocyst transfer [J]. Biology of reproduction, 2002,67(2): 460-464.
[9] Sherwin J R A, Freeman T C,Stephens R J,et al. Identification of genes regulated byleukemia-inhibitory factor in the mouse uterus at the time of implantation[J]. MolecularEndocrinology,2004,18(9): 2185-2195.
[10] Chen Q,SunX,Li L,et al. Effects of ovarian stimulation on endometrial integrin (33 andleukemia inhibitory factor expression in the peri-implantation phase [J]. Fertility and sterility,2008,89(5): 1357-1363.
[11] Thomas K, Thomson A, Wood S,et al. Endometrial integrin expression in womenundergoing in vitro fertilization and the association with subsequent treatment outcome [J].Fertility and sterility, 2003, 80(3): 502-507.
[12] 王玉真,李美芝.分子标记与胚泡着床[J].国外医学:妇产科学分册,2003,30(5):293-294.
[13] Orla MC, Biserka MJ ,John PL,et al. Reproductive function of the progesterone receptor isoforms: lessons from knock—out mice. Mol Cel Endocrinol,2001,179(3):97-103.
[14] Bagehi IC,Kumar5.Stood-regulated molecular markers of implantation[J].Semin Reprod Endoerinol,1999,17(3):235-240.
[15] 肖承悰,刘雁峰,江媚. “补肾气,通胞脉”改善子宫内膜容受性[J]. 生殖与避孕,2014,(7):595-598.
[16] 王素霞,赵红丽,孙玉英. 安胎合剂对GnRHa超排卵小鼠子宫内膜容受性的影响[J]. 中华中医药学刊,2009, 27(2):344-346.
[17] AghajanovaL.Leukemia inhibitory factor and human embryo implantation[J].Ann NY ScadSci,2004,103(4):176-183.
(本文编辑: 王馨瑶)
Effect ofErbuZhuyuimproving prescription on pinopodes, LIF, ER and PR expression in mice endometrium
SHIYue,MUGuohua,WULiting,etal.
DepartmentofGgynaecology,DongzhimenHospital,BeijingUniversityofChineseMedicine,Beijing100700,China
LIUYanfeng,Email::liuyaf8888@sina.com
Objective To observe the effect ofErbuZhuyuimproving prescription on pinopodes, LIF, ER and PR expression in endometrium of mice model with dysfunctional embryo implantation. Methods 50 experimental animals were used to establish model of dysfunctional embryo implantation, and the mice were divided into five groups (10 in each group): blank group, model group, western medicine treated group 1 (progynova group), western medicine treated group 2 (aspirin group),ErbuZhuyuimproving prescription group. Pinopodes in uterine endometrium were examined by scanning electron microscopy. LIF, ER and PR expressions were detected by immunohistochemistry. Results Scanning electron microscopy showed that the endometrium ofErbuZhuyuimproving prescription group was more regular and the expression of pinopodes were abundant, and the space between the cells was obvious. Immunohistochemical results showed LIF, ER and PR expression ofErbuZhuyuimproving prescription group were obviously higher than model group (P<0.05). Compared with the progynova group, LIF level ofErbuZhuyuimproving prescription was lower (P<0.05) while ER level was higher, and PR level was no obvious difference(P>0.05), all above index ofErbuZhuyuimproving prescription was equal to the aspirin group. ConclusionErbuZhuyuimproving prescription might regulate the expression of pinopodesand, LIF, ER and PR expression of blastocyst implantation period, improve the endometrial receptivity and contribute to the adhesion of embryo implantation, and to improve and implantation dysfunction, to create a good environment to promote pregnancy and embryo implantation.
ErbuZhuyuimproving prescription; Endometrial receptivity; Pinopodes; Leukemia inhibitory factor; Estrogen receptor; Progesterone receptor
国家自然科学基金(81273789,81473721);国家中医药管理局全国名老中医肖承悰教授学术经验研究及传承工作室;2014年北京中医药大学薪火传承项目
100700 北京中医药大学东直门医院妇科[石玥(博士研究生)、穆国华(硕士研究生)、吴丽婷(硕士研究生)、申萌萌(博士研究生)、赵青竹(硕士研究生)、刘雁峰]
石玥(1988- ),女,2014级在读博士研究生,医师。研究方向:女性不孕症的中医药防治。E-mail:october5845@163.com
刘雁峰(1963- ),博士,主任医师,博士生导师。研究方向:女性不孕症及更年期综合征的中医药防治。E-mail:liuyaf8888@sina.com
R285.5
A
10.3969/j.issn.1674-1749.2017.04.010
2016-08-31)

