腹主动脉腔内修复术后II型内漏的栓塞治疗:附3例报告
黄建华,李刚,王伟,王宪伟,欧阳洋,刘光强,刘睿
(中南大学湘雅医院 1. 血管外科 2. 介入科,湖南 长沙 410008)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是指的腹主动脉直径大于正常的50%以上的永久扩张,而一旦破裂,病死率可以达到80%~90%[1],在美国已经成为男性死亡的第10位原因,在全世界与约15万人死亡有关[2]。腹主动脉腔内修复术(endovascular abdominal aortic repair,EVAR),现已成为腹主动脉病变手术治疗中最常用的方式[3],相比传统开放手术切除动脉瘤、人工血管置换的手术方式,EVAR具有创伤小、恢复快、早期并发症少等优点,但是中期、长期病死率则同开放手术无明显差异,并且具有更高的再次手术干预率[4]。高鹏等[5]对比了传统手术治疗与EVAR治疗AAA的效果,发现EVAR组的围手术期手术并发症率低于传统手术组,而EVAR组的远期手术并发症率高于传统手术组。随着时间推移,接受EVAR的患者越来越多,术后内漏这一EVAR最常见的并发症越来越成为值得关注的焦点。本文结合笔者工作中碰到EVAR后II型内漏的病例,成功应用弹簧圈栓塞的治疗经验,探讨该并发症可能发生的原因、处理指征、方法以及预后,为预防及治疗II型内漏提供一些借鉴。2011年1月—2016年12月,我院施行的AAA腔内修复手术后发现明显的II型内漏3例,应用栓塞治疗效果较好,现报告如下。
1 病例报告
病例1 女性,44岁。2015年4月因“发现腹部搏动性肿块4个月”入院,CTA检查诊断为AAA(图1A),2015年4月21日行EVAR治疗,术中置入美敦力公司腹主动脉覆膜支架主体及髂腿。2015年10月术后CTA复查发现II型内漏。2015年12月入我科,复查CTA示II型内漏(图1B-C),来自于肠系膜上动脉与肠系膜下动脉的吻合支,决定行经肠系膜上动脉栓塞治疗。
术中微导管超选入肠系膜上动脉到肠系膜下动脉,造影确认内漏来自肠系膜下动脉,交换微导管,释放泰尔茂6 mm弹簧圈,完成第1次栓塞后造影发现栓塞不完全,仍有血流反入瘤腔,遂将导丝回撤至肠系膜下动脉汇合开口处再度栓塞,最后造影示第2次栓塞完全,内漏消失(图1D)。结果:栓塞术后反流消失,术后5 d出院,半年复查内漏消失,瘤腔完全血栓化。
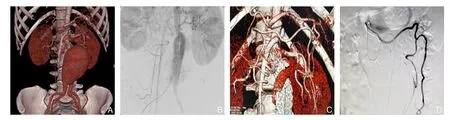
图1 病例1资料 A:术前CTA;B:支架置入术后造影;C:内漏位于肠系膜下动脉;D:栓塞术后造影,内漏消失Figure 1 Data of case 1 A: Preoperative CTA image; B: Angiography after stent plcacement; C: Endoleak from inferior mesenteric artery; D: Angiography after embolization and absence of the endoleak
病例2 男,34岁。因“肾衰肾移植手术前检查发现胸腹主动脉瘤(TAAA)1个月”入院。由于术前CTA检查示胸主动脉下段到腹腔内脏血管分支处动脉瘤形成(图2A),最大直径55 mm,故决定先行开放手术重建内脏血管,再行EVAR,即复合手术(图2B)。于2012年2月行“腹主动脉下段与腹腔干、肠系膜上动脉、左肾动脉人工血管转流+腹主动脉覆膜支架植入术”,术程顺利(由于已经是肾衰竭无尿,故未行右肾动脉重建,且考虑覆膜支架能够覆盖腹腔干根部,故腹腔干未做结扎)(图2C)。2014年7月术后复查发现瘤体增大,支架远端反流考虑为Ib型内漏(图2D-E)。
在支架远端增补一个国产覆膜支架。2015年1月患者因腹痛再入院,复查CTA发现腹腔干动脉反流II型内漏,予以普通弹簧圈对腹腔干进行栓塞,但因血流过快弹簧圈无法固定,共使用23个普通弹簧圈,反流较前减少但效果不满意。2015年11月使用Interlock可控纤毛弹簧圈栓塞,术中使用15×400可控纤毛弹簧圈置入腹腔干,固定5 min,待血栓形成固定良好,术后造影示腹腔干内漏完全消失(图2F-H)。结果:经最后1次栓塞后腹痛症状消失,即时DSA显示无任何内漏,术后半年再次CTA复查,瘤腔消失,无任何内漏(图2I)。
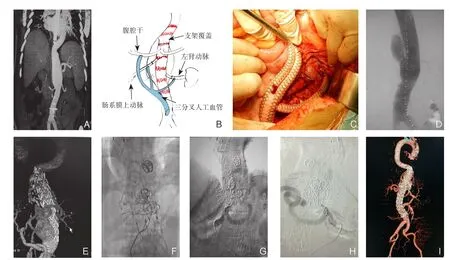
图2 病例2资料 A:第1次手术前CTA;B:杂交手术方案;C:2012年2月杂交手术; D-E:2014年7月瘤腔增大,远端内漏,再加支架;F-H:用可控纤毛弹簧圈栓塞成功,内漏完全消失;I:术后半年CTA复查正常Figure 2 Data of case 2 A: CTA image before thefirst operation; B: Hybrid operation plan; C: Hybrid operation performed in February 2012; D–E: Enlargement of the aneurysmal sac with distal endoleak in July 2014, and then additional stent placement;F–H: Successful embolization with a controllable coil and complete absence of the endoleak; I: CTA image half a year after operation
病例3 男,因“体检发现AAA 1个月”入院(图3A),于2016年6月行EVAR术,术程顺利,术中置入微创公司一体式腹主动脉覆膜支架1枚。后因“腰背部疼痛4月”再次入院,入院后复查CTA示II型内漏(图3B)。决定行肠系膜上动脉选择性造影术,术中再次造影,确认内漏途径为肠系膜上动脉与肠系膜下动脉血管弓吻合至肠系膜下动脉开口。通过肠系膜上动脉微导管超选入肠系膜下动脉开口处,予以泰尔茂6 mm弹簧圈栓塞(图3C-D)。结果:栓塞后瘤腔立即消失,术后3 d出院,术后半年复查无异常。

图3 病例3资料 A:术前CTA示腹主动脉瘤直径接近4 cm;B:术前CTA示II型内漏;C-D:通过肠系膜上动脉与肠系膜下动脉血管弓进行选择性栓塞Figure 3 Data of case 3 A: Preoperative CTA showing abdominal aortic aneurysm of 4 cm in diameter; B: Preoperative CTA showing type II endoleak; C–D: Selective embolization via the collateral pathway between the superior mesenteric artery and inferior mesenteric artery
2 讨 论
2.1 II型内漏的定义和危险因素
术后内漏指的是EVAR术后瘤腔内持续存在血流灌注的情况,使得原本应该被旷置的瘤腔仍然和动脉相通,造成动脉瘤可能继续生长甚至最后破裂的风险[6]。内漏的检出方法主要依赖于彩超和CTA检查,分析对比增强超声(CEUS)检出率更高但需时间推广[7]。内漏的分型最常用的是White等[8]提出的按病因和解剖学分类的方法分为I~IV型。I型:由于近端或远端的不完全隔绝,支架与自体血管无法紧密贴合形成内漏,包括近端和远端内漏。II型:反流性内漏,即来自分支血管如左锁骨下动脉、腰动脉、肠系膜下动脉、骼内动脉等分支血管的反流,内漏量常较小。III型:支架本身破裂或连接处发生内漏,表现为连接处或支架破口处出现对比剂弥散或假腔充盈。IV型:覆膜支架的针孔渗漏或其它质量原因造成内漏,表现为内漏广泛,呈稀疏云雾状在假腔内弥散。其中II型内漏最为常见[9],文献报道其与多种危险因素相关。Warrier等[9-10]研究认为,通畅的肠系膜下动脉和腔内修复术后动脉瘤继续扩张>5 mm为术后II型内漏的独立危险因素;Ward等[11]研究发现,通畅的肠系膜下动脉及腰2、3、4动脉是II型内漏的危险因素,而和腰5动脉无关;Marchiori等[12]统计了11例接受EVAR术后出现II型内漏的患者发现,II型内漏病例的通畅腰动脉均≥4条。Shalaby等[13]研究认为,合并系统性炎症疾病如红斑狼疮、类风湿关节炎、炎症性肠病的AAA患者在腔内修复术后具有更高的II型内漏发生率。另外,Sadek等[14]发现,动脉瘤腔内的血栓体积过少也是II型内漏发生的危险因素。
2.2 II型内漏的转归及处理时机
目前对于II型内漏需不需要处理,以及处理的时机尚存在争议。Walker等[15]统计了474例EVAR术后出现II型内漏的患者,其中111例(23.4%)接受再次腔内修复,与单纯观察组相比不增加动脉瘤相关病死率。Cieri等[16]对1412例 EVAR 患者进行术后长期随访60个月发现,随访结束时有II型内漏组和无II型内漏组动脉瘤腔直径增加>5 mm的患者分别为35.3%和3.3%,说明II型内漏是导致EVAR术后动脉瘤腔持续扩大的危险因素,但II型内漏患者的生存率并没有受到影响。同样的,Batti等[17]也报告了II型内漏导致EVAR术后瘤腔持续生长、并发症率和再干预率升高,但是并不增加患者的全因病死率。Sidloff等[18]共统计了904例接受EVAR术的患者,其中175例(19%)出现II型内漏,且其中54%内漏自行消失,只有9例因动脉瘤直径扩大超过10 mm而接受再次手术,说明大部分II型内漏不需要特殊处理。目前普遍认为,II型内漏的生长速率缓慢,且AAA患者一般就诊时年龄偏大,对II型内漏的处理可以采取密切观察的措施,如果内漏持续增大6个月以上或瘤腔增大超过10 mm,则认为需要进行手术处理,因为持续6个月以上的II型内漏自行消失的可能性很小,且如果因内漏导致动脉瘤体积持续增大,则是II型内漏的处理的指征,也是所有内漏处理的绝对指征[19]。
2.3 II型内漏的处理方法
术后II型内漏的治疗方法包括栓塞、腹腔镜下结扎内漏血管等[19-20]。因其缺乏合适直观的手术入路,其干预比较困难,故临床上主要采取栓塞的方法,即以各种材料如凝血酶、弹簧圈、明胶海绵等,以其在返血动脉中快速形成血栓的能力来封堵血流[22-23]。唐涵斐等[24]自2009年1月—2014年12月间完成了14例使用栓塞方法治疗II型内漏全部获得成功,而叶开创等[20]分析统计了129例II型内漏病例,认为栓塞治疗具有高技术成功率、高临床成功率,且没有严重并发症和术中死亡的发生。Sarac等[25]在一项对II型内漏患者进行长期随访研究中发现,超过20%的患者需要接受2次甚至3次动脉栓塞治疗,在5年随访后,仍只有43%的患者瘤腔生长小于5 mm,说明单独栓塞某根返血动脉可能达不到满意效果。Jouhannet等[26]统计了14例经动脉栓塞治疗II型内漏的病例,其中9例再干预后瘤腔仍有持续扩大,最后5例患者转向开放手术治疗,也说明动脉栓塞治疗II型内漏效果可能有限。
2.4 II型内漏的预防性干预
对II型内漏进行动脉栓塞难度较大且效果有限。目前减少II型内漏的发生率另外一个有效的方法是在植入覆膜支架前进行选择性动脉栓塞,栓塞部位通常位于髂内动脉、肠系膜下动脉及腰动脉开口处。Muthu等[27]尝试在EVAR术中使用凝血酶预防性栓塞进入瘤腔的分支动脉,发现有降低患者术后II型内漏和再次手术干预的趋势。Alerci等[28]发现,EVAR术前15 d对腰动脉>2 mm和肠系膜下动脉通畅的患者进行预防性分支动脉栓塞,结果栓塞组的II型内漏占组内总内漏的3.6%,较未行预防性栓塞组的47.8%明显下降,Fabre等[29]研究认为,对于出现II型内漏的高风险患者,在EVAR术中行弹簧圈栓塞预防(预置导管在瘤腔内,支架释放后从导管释放弹簧圈)是安全和有效的。但也有研究[30]认为80%的患者常规行术前选择性动脉栓塞是没有必要的。目前,一般认为预防性栓塞对于减少II型内漏发生有着很好的效果,但是其会给患者带来不必要的风险如髂腿栓塞、肠缺血坏死等,因此需要严格把握适应证。
2.5 本资料3例患者的对策选择
II型内漏可能在植入覆膜支架后的复查才能被发现,因此需要后续的栓塞处理,以处理不断增大或持续存在的动脉瘤,因为内漏的入路血管已经封闭,这些栓塞的路径通常有:⑴ 从肠系膜下动脉路径进入;⑵ 从腰动脉路径进入;⑶ 动脉瘤位置的直接穿刺进入。对于文中的病例1,笔者推测出现II型内漏的可能原因是患者AAA瘤腔较大,且瘤壁光滑基本无血栓附着,与Sadek等[14]研究报道的一致,故肠系膜下动脉开口处可以持续返血到瘤腔与覆膜支架之间,故我们选择的对策为从肠系膜上动脉入口入路超选至肠系膜下动脉开口处进行选择性栓塞。对于病例2合并肾衰竭无尿的患者,由于在进行第1次杂交手术时腹腔干位置太深,且推测覆膜支架能够覆盖腹腔干开口故未做结扎,造成了长时间的持续反流,动脉瘤继续扩大,以至于出现远端 Ib型内漏,故在2014年第2次手术时远端再置入1个支架,并在2015年分2次栓塞,第1次用了23个普通弹簧圈无效,第2次用可控纤毛弹簧圈才获得成功。Bown等[31]统计了166例AAA术前合并肾功能损害/衰竭的患者,发现相比无肾功能损害的患者,其AAA相关病死率没有区别,但是手术相关并发症率更高。而合并严重肾功能损害乃至肾功能衰竭的AAA患者,何时为最佳处理时机缺乏文献报道。在栓塞材料的选择上,如弹簧圈,和胶[氰基丙烯酸正丁酯(NBCA)],凝血酶和乙烯-乙烯醇共聚物都可以用作栓塞材料,目前还没有使用栓塞材料选择的指导方针,而决定使用何种栓塞材料往往是基于术者的经验,对于该例患者,可控纤毛弹簧圈是功不可没。波士顿科技生产的Interlock可解脱弹簧圈使用铂金材料,与推送圈不同,Interlock可解脱弹簧圈系统拥有独特的Interlocking Arm互锁臂设计。这一设计使得弹簧圈在释放前保持锁定,允许弹簧圈在最终解离点进入血管前可以导入和收回,用于增强弹簧圈输送和回撤能力。
结合文献复习和上述3例EVAR术后II型内漏的处理,可见II型内漏发生主要由没有闭合的内脏血管分支所致;如果预计可能发生II型内漏风险较高,如主动脉分支和腰动脉的数量较多,肠系膜下动脉通畅,动脉瘤内血栓较少时,最好提前干预;目前弹簧圈栓塞是防治II型内漏最主要的方法,栓塞材料的选择主要根据术者的经验和材料释放的准确、稳固程度决定。
[1]Kniemeyer HW, Kessler T, Reber PU, et al. Treatment of ruptured abdominal aortic aneurysm, a permanent challenge or a waste of resources? Prediction of outcome using a multi-organ-dysfunction score[J]. Eur J Vasc Endovasc Surg, 2000, 19(2):190–196.
[2]GBD 2013 Mortality and Causes of Death Collaborators. Global,regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015,385(9963):117–171. doi: 10.1016/S0140–6736(14)61682–2.
[3]黄建华, 刘光强, 符洋, 等. 腹主动脉瘤手术切除与腔内治疗疗效的比较[J]. 中国普通外科杂志, 2008, 17(6):542–545. doi:10.3969/j.issn.1005–6947.2008.06.006.Huang JH, Liu GQ, Fu Y, et al. Comparison the therapeutic effect of endovascular aneurysm repair and open repair for abdominal aortic aneurysm[J]. Chinese Journal of General Surgery, 2008, 17(6):542–545. doi:10.3969/j.issn.1005–6947.2008.06.006.
[4]Becquemin JP, Pillet JC, Lescalie F, et al. A randomized controlled trial of endovascular aneurysm repair versus open surgery for abdominal aortic aneurysms in low-to moderate-risk patients[J]. J Vasc Surg, 2011, 53(5):1167–1173. doi: 10.1016/j.jvs.2010.10.124.
[5]高鹏, 杨彬, 司继媛, 等. EVAR与外科开放手术治疗腹主动脉瘤的手术方法及效果对比[J]. 中国普通外科杂志, 2016,25(12):1801–1805. doi:10.3978/j.issn.1005–6947.2016.12.022.Gao P, Yang B, Si JY, et al. Comparison of surgical method and results between EVAR and open surgical treatment of abdominal aortic aneurysm[J]. Chinese Journal of General Surgery, 2016,25(12):1801–1805. doi:10.3978/j.issn.1005–6947.2016.12.022.
[6]Chung R, Morgan RA. Type 2 Endoleaks Post-EVAR: Current Evidence for Rupture Risk, Intervention and Outcomes of Treatment[J]. Cardiovasc Intervent Radiol, 2015, 38(3):507–522.doi: 10.1007/s00270–014–0987–x.
[7]张忆东, 杨筱, 张波, 等. CEUS、CTA和CDUS对EVAR术后内漏检出效果的比较与评价[J]. 血管与腔内血管外科杂志, 2017,3(1):566–572. doi:10.19418/j.cnki.issn2096–0646.2017.01.04.Zhang YD, Yang X, Zhang B, et al. Comparison and evaluation of CEUS, CTA and CDUS in endoleak detection after EVAR[J].Journal of Vascular and Endovascular Surgery, 2017, 3(1):566–572.doi:10.19418/j.cnki.issn2096–0646.2017.01.04.
[8]White GH, Yu W, May J, et al. Endoleak as a complication of endoluminal grafting of abdominal aortic aneurysms: classification,incidence, diagnosis, and management[J]. J Endovasc Surg, 1997,4(2):152–168.
[9]Warrier R, Miller R, Bond R, et al. Risk factors for type II endoleaks after endovascular repair of abdominal aortic aneurysms[J]. ANZ J Surg, 2008, 78(1/2):61–3. doi: 10.1111/j.1445–2197.2007.04378.x.
[10]van Marrewijk C, Buth J, Harris PL, et al. Significance of endoleaks after endovascular repair of abdominal aortic aneurysms: The EUROSTAR experience[J]. J Vasc Surg, 2002, 35(3):461–473.
[11]Ward TJ, Cohen S, Patel RS, et al. Anatomic risk factors for type-2 endoleak following EVAR: a retrospective review of preoperative CT angiography in 326 patients[J]. Cardiovasc Intervent Radiol,2014, 37(2):324–328. doi: 10.1007/s00270–013–0646–7.
[12]Marchiori A, von Ristow A, Guimaraes M, et al. Predictive factors for the development of type II endoleaks[J]. J Endovasc Ther, 2011,18(3):299–305. doi: 10.1583/10–3116.1.
[13]Shalaby SY, Foster TR, Hall MR, et al. Systemic Inflammatory Disease and Its Association With Type II Endoleak and Late Interventions After Endovascular Aneurysm Repair[J]. JAMA Surg,2016, 151(2):147–153. doi: 10.1001/jamasurg.2015.3219.
[14]Sadek M, Dexter DJ, Rockman CB, et al. Preoperative relative abdominal aortic aneurysm thrombus burden predicts endoleak and sac enlargement after endovascular anerysm repair[J]. Ann Vasc Surg, 2013, 27(8):1036–1041. doi: 10.1016/j.avsg.2013.04.006.
[15]Walker J, Tucker LY, Goodney P, et al. Type II endoleak with or without intervention after endovascular aortic aneurysm repair does not change aneurysm-related outcomes despite sac growth[J]. J Vasc Surg, 2015, 62(3):551–561. doi: 10.1016/j.jvs.2015.04.389.
[16]Cieri E, De Rango P, Isernia G, et al. Type II endoleak is an enigmatic and unpredictable marker of worse outcome after endovascular aneurysm repair[J]. J Vasc Surg, 2014, 59(4):930–937.doi: 10.1016/j.jvs.2013.10.092.
[17]El Batti S, Cochennec F, Roudot-Thoraval F, et al. Type II endoleaks after endovascular repair of abdominal aortic aneurysm are not always a benign condition[J]. J Vasc Surg, 2013, 57(5):1291–1297.doi: 10.1016/j.jvs.2012.10.118.
[18]Sidloff DA, Gokani V, Stather PW, et al. Re: 'Type II Endoleak:Conservative Management Is a Safe Strategy'[J]. Eur J Vasc Endovasc Surg, 2015, 49(1):103–104.
[19]聂皓, 郑月宏. 腹主动脉瘤腔内修复术后II型内漏的治疗进展[J]. 心肺血管病杂志, 2016, 35(5):416–418. doi:10.3969/j.issn.1007–5062.2016.05.019.Nie H, Zheng YH. Progress of treatment of type II endoleak after endovascular aneurysm repair[J]. Journal of Cardiovascular and Pulmonary Diseases, 2016, 35(5):416–418. doi:10.3969/j.issn.1007–5062.2016.05.019.
[20]叶开创, 陆信武, 李维敏, 等. 经动脉栓塞治疗腹主动脉瘤患者腔内修复术后持续性II型内漏的荟萃分析[J]. 中华医学杂志, 2008,88(25):1732–1736. doi:10.3321/j.issn:0376–2491.2008.25.002.Ye KC, Lu XW, Li WM, et al. Effect of transarterial embolization on persistent type II endoleaks after endovascular aneurysm[J].National Medical Journal of China, 2008, 88(25):1732–1736.doi:10.3321/j.issn:0376–2491.2008.25.002.
[21]Abularrage CJ, Crawford RS, Conrad MF, et al. Preoperative variables predict persistent type 2 endoleak after endovascular aneurysm repair[J]. J Vasc Surg, 2010, 52(1):19–24. doi: 10.1016/j.jvs.2010.02.023.
[22]Martin ML, Dolmatch BL, Fry PD, et al. Treatment of type II endoleaks with Onyx[J]. J Vasc Interv Radiol, 2001, 12(5):629–632.
[23]Golzarian J, Maes EB, Sun S. Endoleak: treatment options [J]Tech Vasc Interv Radiol, 2005, 8(1):41–49.
[24]唐涵斐, 郭大乔, 唐骁, 等. 栓塞治疗腹主动脉瘤腔内修复术后II型内漏的单中心经验总结[J]. 中国普外基础与临床杂志, 2017,24(1):14–17. doi:10.7507/1007–9424.201612059.Tang HF, Guo DQ, Tang X, et al. Embolization of type II endoleaks after endovascular repair of abdominal aortic aneurysm: a single center experience[J]. Chinese Journal of Bases and Clinics In General Surgery, 2017, 24(1):14–17. doi:10.7507/1007–9424.201612059.
[25]Sarac TP, Gibbons C, Vargas L, et al. Long-term follow-up of type II endoleak embolization reveals the need for close surveillance[J].J Vasc Surg, 2012, 55(1):33–40. doi: 10.1016/j.jvs.2011.07.092.
[26]Jouhannet C, Alsac JM, Julia P, et al. Reinterventions for type 2 endoleaks with enlargement of the aneurismal sac after endovascular treatment of abdominal aortic aneurysms[J]. Ann Vasc Surg, 2014, 28(1):192–200. doi: 10.1016/j.avsg.2012.10.038.
[27]Muthu C, Maani J, Plank LD, et al. Strategies to reduce the rate of type II endoleaks: routine intraoperative embolization of the inferior mesenteric artery and thrombin injection into the aneurysm sac[J]. J Endovasc Ther, 2007, 14(5):661–668.
[28]Alerci M, Giamboni A, Wyttenbach R, et al. Endovascular abdominal aneurysm repair and impact of systematic preoperative embolization of collateral arteries: endoleak analysis and long-term follow-up[J]. J Endovasc Ther, 2013, 20(5):663–671. doi:10.1583/12–4188MR.1.
[29]Fabre D, Fadel E, Brenot P, et al. Type II endoleak prevention with coil embolization during endovascular aneurysm repair in high-risk patients[J]. J Vasc Surg, 2015, 62(1):1–7. doi: 10.1016/j.jvs.2015.02.030.
[30]Aziz A, Menias CO, Sanchez LA, et al. Outcomes of percutaneous endovascular intervention for type II endoleak with aneurysm expansion[J]. J Vasc Surg, 2012, 55(5):1263–1267. doi: 10.1016/j.jvs.2011.10.131.
[31]Bown MJ, Norwood MG, Sayers RD. The management of abdominal aortic aneurysms in patients with concurrent renal impairment[J]. Eur J Vasc Endovasc Surg, 2005, 30(1):1–11.

