珂立苏治疗晚期早产儿RDS的最佳剂量研究
左 君
(内江市东兴区人民医院儿科,四川 内江 641000)
珂立苏治疗晚期早产儿RDS的最佳剂量研究
左 君
(内江市东兴区人民医院儿科,四川 内江 641000)
目的 探讨珂立苏(PS)治疗晚期早产儿呼吸窘迫综合征(RDS)的最佳剂量。方法 选择于2006年1月至2014年9月在内江市东兴区人民医院就诊的晚期早产儿RDS患儿60例,将60名患儿随机分为观察组(n=30)和对照组(n=30);观察组应用PS 70mg/kg进行治疗,对照组应用PS 40mg/kg进行治疗,比较两组血气指标、氧合指数、并发症发生情况等,分析对比两组患者的治疗效果。结果 第1次给药24小时后,可见氧合指数(OI)和二氧化碳分压(PCO2)均有明显降低,氧分压(PO2)水平有明显升高。治疗后观察组OI和PCO2水平明显优于对照组,差异均有统计学意义(t值分别为-6.505、-3.093,P<0.05);治疗后PO2水平两组差异无统计学意义(均P>0.05)。观察组机械通气时间[经鼻持续气道正压通气(nCPAP)、同步间歇指令通气(SIMV)](t值分别为-5.188、-4.132)、应用PS次数(t=-4.038)、肺炎发生率(χ2=9.320)、氧疗时间(t=-7.006)和住院时间(t=-3.027)均低于对照组,差异均有统计学意义(均P<0.05)。两组患儿的治愈率差异无统计学意义(P>0.05)。结论 PS治疗晚期早产儿RDS患者时,最佳剂量为70mg/kg。
晚期早产儿;呼吸窘迫综合征;珂立苏;牛肺表面活性物质
呼吸窘迫综合征(respiratory distress syndrome,RDS)是新生儿的常见呼吸系统并发症。近年来,RDS患儿人数呈逐年增加的趋势[1]。发病时,患儿心率加快,心脏功能障碍,长期易导致心力衰竭,治疗不及时可能有生命危险。目前临床主要应用牛肺表面活性物质治疗晚期早产儿RDS患儿。晚期早产儿指胎龄为34~36周的新生儿。牛肺表面活性物质能够有效地改善患儿的临床症状,有良好的治疗效果。本次研究通过分析珂立苏(PS)治疗晚期早产儿RDS的最佳剂量,为临床合理用药提供依据。
1对象与方法
1.1对象
选择于2006年1月至2014年9月来内江市东兴区人民医院就诊的晚期早产儿RDS患儿60例,将其随机分为观察组(n=30)和对照组(n=30)。观察组中,男性患儿17例,女性患儿13例;对照组中,男性患儿18例,女性患儿12例。观察组患儿胎龄33~36周,平均胎龄(34.1±1.9)周;体重为2 190~2 692g,平均体重(2 461.9±158.3)g;对照组患儿胎龄32~35.5周,平均胎龄(34.5±1.6)周,体重为2 239~2 725g,平均体重(2 480.9±159.4)g。两组患儿性别、胎龄、体重差异均无统计学意义(均P>0.05),具有可比性。
RDS诊断标准[2]:①急性起病,早期出现呼吸窘迫如紫绀、呼吸困难等呼吸道症状;②无心功能不全;③胸部X片显示双肺密度升高、肺浸润阴影或大白肺。所有患儿均符合病例纳入标准和病例排除标准。
病例纳入标准:①胎龄34~36周的患儿;②患儿符合RDS诊断标准;③患儿入院时间为出生24小时内。病例排除标准:①存在中、重度窒息的患儿;②合并有肾、肺功能衰竭的患儿;③有先天性心脏病的患儿;④患儿对本次研究药物有既往过敏史;⑤存在有胎粪吸入、宫内感染的患儿。
参与本次研究的患儿均由患儿家长签署知情同意书。
1.2研究方法
本次研究选取PS(产品批号:1403991)作为研究药物。采用注射的方法进行给药。对照组应用PS 40mg/kg进行治疗;观察组应用PS 70mg/kg进行治疗。注射药液后,行复苏气囊加压通气5分钟进行处理,使药液在肺部均匀分布[3]。用药时,依据患儿用药反应连接呼吸机进行辅助通气治疗。两组患儿治疗时间均为28天。
1.3观察指标
分别于两组患儿治疗前及给药后24小时测定动脉血气指标,计算患儿氧合参数,观察并记录两组患儿治疗总有效率、机械通气时间、住院时间、肺炎发生率、氧疗时间等一系列指标。
1.4疗效判定标准
依据患儿治疗28天后的临床症状,将患儿疗效分为:痊愈、显效、有效和无效。治疗总有效率=(有效例数+显效例数+痊愈例数)/总病例数×100%。
1.5统计学方法
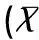
2结果
2.1两组患儿各项指标的比较
两组患儿第1次给药24小时后,可见氧合指数(OI)和二氧化碳分压(PCO2)均有明显降低,氧分压(PO2)水平有明显升高。两组患儿治疗前PO2、OI和PCO2之间差异均无统计学意义(均P>0.05);治疗后,观察组OI和PCO2水平明显优于对照组,差异均有统计学意义(均P<0.05),治疗后PO2水平两组差异无统计学意义(P>0.05),见表1。
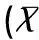


项目观察组(n=30)对照组(n=30)tPPO2(mmHg) 给药前46.8±19.645.3±23.10.2560.799 治疗24小时64.9±4.863.8±6.20.7250.472PCO2(mmHg) 给药前49.1±8.950.9±9.1-0.7340.466 治疗24小时41.3±4.845.3±4.7-3.0930.003OI(%) 给药前12.4±1.911.6±2.91.1890.240 治疗24小时4.9±0.97.8±2.1-6.505 <0.001
2.2两组患儿疗效的比较
观察组机械通气时间[经鼻持续气道正压通气(nCPAP)、同步间歇指令通气(SIMV)]、应用PS次数、肺炎发生率、氧疗时间和住院时间均低于对照组,差异均有统计学意义(均P<0.05);两组患儿的治愈率差异无统计学意义(P>0.05),见表2。



项目观察组(n=30)对照组(n=30)t/χ2P辅助通气时间(天) nCPAP2.5±0.84.4±1.7-5.188<0.001 SIMV1.9±0.93.1±1.2-4.132<0.001应用PS(次)1.2±0.41.7±0.5-4.038<0.001肺炎4(13.3)15(50.0) 9.320 0.002氧疗时间(天)5.2±1.38.8±2.3-7.006<0.001住院时间(天)9.7±2.111.8±2.9-3.0270.004治愈30(100.0)27(90.0) 3.158 0.076
3讨论
由于晚期早产儿身体各器官发育不成熟,有较高的患病率及死亡率。RDS是常见的新生儿呼吸系统并发症之一,患儿常起病急,发病持久[4]。RDS的发病原因可能为剖宫分娩儿未经过阴道挤压,孕妇产程未启动,体内儿茶酚胺水平较低,导致肺表面活性物质缺乏,促进肺液吸收的Na+离子转运通道不成熟或受损,肺液清除延迟,呼吸道及肺泡内液体潴留,影响了正常的通气及换气[5]。临床上广泛应用牛肺表面活性物质进行RDS的相关治疗,可显著改善患儿心肺功能,缓解症状,能有效提高患儿生存率[6]。PS是国产牛肺表面活性物质,剂量范围为40~100mg/kg,能够有效改善患儿的氧合功能。
3.1各项指标比较结果分析
本资料探讨了不同剂量PS治疗晚期早产儿RDS患儿的临床疗效,结果显示应用PS 70mg/kg治疗的观察组与应用PS 40mg/kg治疗的对照组治愈率差异无统计学意义,提示不同剂量的PS治疗晚期早产儿RDS患儿均可达到良好的效果,与有关研究[7]结果一致;但对照组用药次数明显多于观察组,其提示PS首剂40mg/kg已经不能满足大多数晚期早产儿RDS患儿的需要。本资料表明,对照组患儿比观察组患儿肺炎发生率明显增高(P<0.05),其可能与对照组患儿比观察组患儿氧疗时间长、气管插管给药次数多有关,提示在晚期早产儿RDS患儿的治疗过程中,应使剂量尽量达到40mg/kg以上,以减少气管插管给药次数,从而降低患儿肺炎发生率。
3.2临床疗效比较结果分析
本资料显示,治疗后观察组机械通气时间(nCPAP、SIMV)、应用PS次数、肺炎发生率、氧疗时间和住院时间均低于对照组(P<0.05),其表明PS治疗晚期早产儿RDS患儿剂量70mg/kg的临床疗效要明显优于剂量40mg/kg。本资料中两组患儿第1次给药24小时后,可见OI和PCO2均有明显降低,PO2有明显升高;治疗后观察组OI和PCO2水平明显优于对照组(均P<0.05),而PO2差异无统计学意义,其提示大剂量的PS较低剂量能够更好地改善患儿肺功能,与有关研究结果[8]一致。
综上所述,应用PS治疗应密切观察患儿的氧饱和度,及时调整呼吸机参数,以减少患儿肺损伤,在合理应用呼吸机的参数下,70mg/kg的PS用于晚期早产儿RDS患儿的治疗是安全的最佳剂量。
[1]王小虎,姜红,牛世平.不同剂量牛肺表面活性物质治疗晚期早产儿呼吸窘迫综合征的临床研究[J].中国新生儿科杂志,2014,29(1):43-45.
[2]李珍.早产儿呼吸窘迫综合征(RDS)简易评估系统的建立及效果评价[D].广州:广东医学院,2015.
[3]李俊敏,于凤丹.两种肺表面活性物质不同剂量早期治疗晚期早产儿呼吸窘迫综合征临床研究[J].中国基层医药,2015,22(11):1707-1712.
[4]Meneses J,Bhandari V,Alves J G,etal.Noninvasive ventilation for respiratory distress syndrome:a randomized controlled trial[J].Pediatrics,2011,127(2):300-307.
[5]Hourani M,Ziade F,Rajab M.Timing of planned caesarean section and the morbidities of the newborn[J].N Am J Med Sci,2011,3(10):465-468.
[6]Bräuer L,Schicht M,Worlitzsch D,etal.Staphylococcus aureus and Pseudomonas aeruginosa express and secrete human surfactant proteins[J].PLoS One,2013,8(1):e53705.
[7]Numata M, Grinkova Y V, Mitchell J R,etal.Nanodiscs as a therapeutic delivery agent: inhibition of respiratory syncytial virus infection in the lung[J].Int J Nanomedicine,2013,8:1417-1427.
[8]Cole F S, Alleyne C, Barks J D,etal.NIH Consensus Development Conference statement:inhaled nitric-oxide therapy for premature infants[J].Pediatrics,2011,127(2):363-369.
[专业责任编辑: 孙 新]
Optimal dosage of Calsurf for treatment of late preterm infants with respiratory distress syndrome
ZUO Jun
(Department of Pediatrics, Dongxing District People’s Hospital in Neijiang City, Sichuan Neijiang 641000, China)
Objective To analyze the optimal dosage of Calsurf (PS) for treatment of late preterm infants with respiratory distress syndrome (RDS). Methods Altogether 60 late preterm infants with RDS who were treated in Dongxing District People’s Hospital in Neijiang City from January 2006 to September 2014 were selected and randomly divided into control group (30 cases) and observation group (30 cases). The infants in the observation group were given 70mg/kg of PS, and the infants in control group were given 40mg/kg of PS. Blood gas indicators, oxygenation index (OI) and incidence of complications were compared between two groups to analyze the treatment effect of two groups. Results After 24 hours of the first administration, OI and partial pressure of carbon dioxide (PCO2) were significantly reduced, and partial pressure of oxygen (PO2) level increased significantly. After treatment, the levels of OI and PCO2of the observation group were significantly better than those of the control group, and the differences were statistically significant (tvalue was -6.505 and -3.093, respectively, bothP<0.05). There was no significant difference between two groups in level of PO2(bothP>0.05). Mechanical ventilation time [nasal continuous positive airway pressure (nCPAP) and synchronized intermittent mandatory ventilation (SIMV)](tvalue was -5.188 and -4.132, respectively), the number of PS application (t=-4.038), incidence of pneumonia (χ2=9.320), oxygen therapy time (t=-7.006) and hospitalization time (t=-3.027) of the observation group were lower than those of the control group, and the differences were statistically significant (allP<0.05). Difference in cure rate between two groups had no statistical significance (P>0.05).Conclusion Optimal dosage of PS for treatment of late preterm infants with RDS is 70mg/kg.
late preterm infants; respiratory distress syndrome (RDS); Calsurf (PS); pulmonary surfactant
2016-05-12
左 君(1966-),女,副主任医师,主要从事早产儿管理工作。
10.3969/j.issn.1673-5293.2016.11.027
R722.6
A
1673-5293(2016)11-1376-02

