25羟维生素D与妊娠期代谢性疾病综合征的相关性研究
李 慧,周 平,饶美兰,廖碧翎,易 菁
(广东省妇幼保健院妇产科,广东 广州,510010)
25羟维生素D与妊娠期代谢性疾病综合征的相关性研究
李 慧,周 平,饶美兰,廖碧翎,易 菁
(广东省妇幼保健院妇产科,广东 广州,510010)
目的 探讨25羟维生素D[25(OH)D3]与妊娠期代谢性疾病综合征(GMS)的相关性。方法 选取2015年1月至2016年1月广东省妇幼保健院妇产科收集的100例确诊为妊娠期代谢综合征妇女作为GSM组,另选100例正常妊娠妇女作为对照组,检测两组妇女的血25羟维生素D及相关代谢指标,并分析其相关性。结果 GMS组的年龄、孕次、分娩次数、高密度脂蛋白(HDL-C)水平与对照组差异均无统计学意义(t值分别为0.508,1.010,1.179,1.026,P>0.05),GMS组的体质量指数(BMI)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、收缩压(SBP)、舒张压(DBP)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、游离脂肪酸(FFA)水平均显著高于对照组(t值分别为9.284、5.572、4.480、3.192、6.184、4.317、8.689、9.360、3.070,均P<0.05),GMS组的25(OH)D3水平显著低于对照组(t=16.856,P<0.05);多因素分析法采用Logistic回归进入法进行分析,结果显示:孕期BMI、糖化血红蛋白与妊娠妇女并发GMS具有正相关关系,而25(OH)D3水平与妊娠妇女并发GMS具有负相关关系(OR值分别为1.797、1.338、-1.619,均P<0.05)。结论 25(OH)D3缺乏是妊娠期代谢性疾病综合征的独立危险因素。
25羟维生素D;妊娠期代谢性疾病综合征;相关性;妊娠
妊娠期代谢综合征(gestational metabolic syndrome,GMS)是指人体的蛋白质、脂肪、碳水化合物等物质发生代谢紊乱的病理状态,是一组复杂的代谢紊乱症候群,是导致糖尿病心脑血管疾病的危险因素。GMS与普通人群代谢综合症相似的病理机制,但由于正常妊娠的过程中体内葡萄糖代谢、收缩压以及舒张压的波动更为明显,以及其他一系列的代谢机制导致代谢综合征的临床表现更为复杂,预后更差[1]。相关研究表明GMS是妊娠期女性产后出血、产褥期感染以及新生儿缺血缺氧性脑病发生的独立危险因素[2-3]。
目前临床上缺乏对于GMS发生的危险因素的预测,虽然血清脂蛋白、空腹血糖以及血压的长期监测有利于早期诊断GMS,但其联合检测的灵敏度和特异度均较低,不足65%[4],且对于病情反应的能力不足,缺乏远期疾病预后评估价值。25羟维生素D[25(OH)D3]是脂溶性维生素D的体内活化形式,相关研究证实25(OH)D3不仅在平衡钙磷代谢以及骨质代谢性疾病中具有重要的评估价值,同时与细胞增殖调控、自身免疫性疾病以及多种慢性疾病密切相关,且25(OH)D3在GMS中可下降25%以上[5-6],本次研究重在探讨25(OH)D3与GMS的相关性,进而为评估GMS的发生风险提供参考。
1研究对象及方法
1.1研究对象及纳入排除标准
选取2015年1月至2016年1月广东省妇幼保健院妇产科收集的100例确诊为妊娠期代谢综合征妇女作为研究组,另选100例正常妊娠妇女作为对照组。
研究组100例,年龄23~42岁,平均28.1±5.1岁。对照组100例,年龄21~42岁,平均27.7±6.0岁。两组妊娠妇女的年龄差异无统计学意义(P>0.05)。
纳入标准:①GMS的诊断标准参考2004年中华医学会制定的代谢综合征诊断标准,同时参考Wiznitzer等的研究标准[7]:a.孕前体质量指数(body mass index,BMI)≥25kg/m2;b.收缩压(systolic blood pressure,SBP)/舒张压(diastolic blood pressure,DBP)≥140/90mmHg;c.甘油三酯(TG)≥3.23mmol/L;d.妊娠期糖尿病确诊,具备上述全部或者其中3项即可诊断为GMS;②均为单胎、头位妊娠产妇;③在本院产科建卡常规孕检并且分娩的产妇;④各项资料完整,取得研究对象知情同意。
排除标准:①合并甲状腺功能异常、应用甲状腺药物的妊娠妇女;②孕前患有糖尿病、高血压、肝肾功能疾病。
1.2观察指标及检测方法
比较两组妊娠妇女妊娠第24~28周的总胆固醇(TC)、TG、高密度脂蛋白(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(HbA1c)、游离脂肪酸(free fatty acid,FFA)、25(OH)D3、BMI。
患者于入院当时采肘静脉血,2mL血样在室温下静置30分钟后,4 000rpm离心10min分离血清,一次性真空采血管(血液凝固实验专用)内有3.1%柠檬酸钠,日本株氏会社生产,严格按标准采集标本,TC、TG、HDL-C、LDL-C、HbA1c、FFA的检测采用Sysmex系列CA-1500全自动生化分析检测,试剂由DadeBehring公司配套生产。
ELISA法检测25(OH)D3采取两组病例静脉血,经1 500rpm离心5min后得到血清,4℃保存待测,以标准品稀释液将标准品复溶,静置15min后混匀,倍比稀释为7个浓度,取出板条,除了对照孔外每个孔加入不同浓度的标准品,剂量为100μL/孔,采用封板盖封住,室温反应120min,使用PBS液体洗涤3次,除了空白对照孔,每孔加入检测液(100μL),室温孵育1h,PBS洗涤3次,加入底物(50μL/孔),避光孵育25min,加入终止液5min后测定450nm处吸光度。25(OH)D3抗体购自罗氏检测公司,相关配套试剂购自南京凯基生物科技有限公司,严格按照说明书的要求进行操作。
1.3统计学方法
2结果
2.1两组妊娠妇女的一般资料及代谢指标比较
GMS组的年龄、孕次、分娩次数、HDL-C水平与对照组差异均无统计学意义(P>0.05),GMS组的BMI、TC、TG、LDL-C、SBP、DBP、FPG、HbA1c、FFA水平均显著的高于对照组(P<0.05),GMS组的25(OH)D3水平显著低于对照组(P<0.05),见表1。
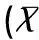

Table 1 Comparison of general information and metabolic indexes of two groups of pregnant ±S)
2.2各种代谢指标及25羟维生素D与妊娠期代谢性疾病综合征的关系分析
以是否确诊为GMS作为因变量,以年龄、孕次、分娩次数、HDL-C、BMI、TC、TG、LDL-C、SBP、DBP、FPG、HbA1c、FFA、25(OH)D3作为自变量,采用Logistic回归进入法进行分析,结果显示:孕期BMI、、HbA1c与妊娠妇女并发GMS具有正相关关系,而25(OH)D3水平与妊娠妇女并发GMS具有负相关关系(OR值分别为1.797、1.338、-1.619,均P<0.05),见表2。

表2 各种代谢指标及25(OH)D3水平与GMS的相关影响因素分析
(转下表)
(续上表)

因素BS.EWaldPOR95%CIFPG(mmol/L)0.3370.1722.7040.0981.4441.260~3.155HbA1c(%)0.8960.4673.9810.0421.3381.184~2.827FFA(mmol/L)0.2950.1511.5520.3101.2641.095~2.65325(OH)D3(nmol/L)-0.502 -0.263 4.9610.028-1.619 -1.296~-4.672
3讨论
3.1妊娠期代谢性疾病综合征的病理机制分析
GMS有共同的病理基础,目前多认为它们的共同原因就是肥胖尤其是中心性肥胖所造成的胰岛素抵抗和高胰岛素血症,GMS可造成多种疾病增加,如高血压、冠心病、脑卒中,特别是对于妊娠期女性而言,GMS可以增加妊娠期高血压、妊娠合并肝内胆汁淤积、羊水异常、巨大儿以及剖宫产率的增加。GMS的病理机制中,血脂异常、高血黏、高尿酸和高胰岛素血症,这些代谢紊乱可以进一步促进心、脑血管病变,特别是在妊娠32周以后,心脏负荷增加较为明显,GMS的代谢异常导致的高尿酸以及高脂血症可以增加5%急性心力衰竭的发生率[8-9],并增加不良妊娠结局的发生,预后不佳。BMI、SBP、DBP、FFA以及FPG均为早期诊断GMS的重要因素,在妊娠24周以后及时地进行BMI、SBP、DBP、FFA等检测或者联合检测,可以提高GMS的诊断水平[10-11]。但一项汇集了47例样本量的多因素分析研究表明,虽然BMI、SBP、DBP、FFA等指标对于提高GMS诊断水平、提高早期筛查率均具有一定的参考价值,但对于GMS并发心力衰竭、慢性肾功能不全、胎儿宫内窘迫以及胎儿生长发育迟缓等疾病的远期预测价值不高,其联合检测对于不良妊娠结局诊断的一致性不足65%[12-13]。
3.2妊娠期代谢性疾病综合征的风险因素
人体内源性维生素D绝大部分由皮肤合成,在紫外线的作用下,胆固醇经过光解脱氢联合氧化反应转化为维生素D原,进入人体血液循环后在肝脏经25-羟化酶作用转化成25(OH)D3,由于25(OH)D3是体内维生素D活化形式之一,同时25(OH)D3的半衰期较长,同时检测血清中的25(OH)D3可以有效评估钙磷代谢和其他基础性疾病的发生风险[14]。已有研究发现25(OH)D3血清中的持续性下降或者异常下降达25%以上时,妊娠期女性发生GMS的风险可上升5%左右[15],但相关研究的纳入样本量不足30,且临床资料收集偏移较为严重,可信性不足,本次研究的创新性在于首次探讨了血糖、血脂以及血压等指数与GMS发生风险的相关关系。
3.3本次研究结果分析
本次研究发现观察组的血脂代谢明显异常,体内脂蛋白代谢HDL-C、TG、TC等异常,其中LDL-C可上升至3.72±0.54mmol/L,TG可上升至3.48±0.36mmol/L,而保护性脂蛋白HDL-C明显下降,相关TG、LDL-C的上升可以促进妊娠女性动脉管壁的损伤,促进胎盘血管的硬化和血流动力学的异常,导致胎儿生长发育异常,增加胎儿生长发育迟缓和发育畸形的发生率。同时GMS组患者的血压和空腹血糖值同样明显高于正常对照组,其中FPG可上升至5.28±0.67mmol/L,但本次研究并未发现HbA1c的上升,考虑到妊娠期女性体内代谢更为复杂,HbA1c的波动更为明显,短时间内的HbA1c可能呈现出下降的趋势。BMI是评估妊娠期女性营养代谢、能量平衡等的重要指标,本研究中GDM组患者的BMI明显高于正常对照组,表明糖尿病组患者呈现出一定的能量代谢正平衡效应,GDM组的BMI的上升考虑可能与异常代谢综合征导致的水钠潴留等有关。本次研究重点探讨了血清中25(OH)D3的改变,发现观察组的25(OH)D3仅为2.80±0.32mmol/L,明显低于对照组,下降幅度可达30%~40%,维生素D的持续性下降可以抑制胰岛B细胞内分泌功能,并通过加速胰岛B细胞的免疫损伤进而促进B细胞的功能衰退和下降,同时25(OH)D3的下降可以促进肾素-血管素进展的表达,进而增加胎盘血管的阻力,降低胎儿体内的血氧饱和度,增加新生儿缺血缺氧性脑病的发生率。近期有资料分析94例年龄大于25岁的妊娠24周以后的GMS患者的血清学资料,发现25(OH)D3可平均下降25%以上,同时认为25(OH)D3直接抑制过氧化物酶体活化受体r的表达,进而调节GMS的多系统代谢性疾病的发生和发展[9]。本研究的多因素分析发现孕期25(OH)D3水平与妊娠妇女并发GMS具有负相关关系,统计学意义较为明显,提示临床上对于25(OH)D3异常下降的患者,应加强检测,早期评估并及时采取有效干预措施降低GMS不良妊娠结局的发生。
3.4总结
综上所述,GMS患者可同时合并血脂代谢、血糖代谢、高血压等异常代谢病理状态,其中25(OH)D3在GMS患者血清中异常低表达,25(OH)D3表达的缺乏是妊娠期代谢性疾病综合征的独立危险因素,对于相关高危因素的孕产妇应加强检测改善临床预后。
[1]刘春艳,向翠平,宋洪仙,等.妊娠期代谢综合征诊断标准的评价及危险因素分析[J]. 检验医学与临床,2014,11(11):1490-1491.
[2]王立伟,程小侠,栾晓丽. 妊娠期糖尿病孕期综合管理对血糖及妊娠结局的影响[J]. 现代仪器与医疗,2014,20(4):83-86.
[3]王娟,马秀玲,张崴.既往妊娠糖尿病患者代谢综合征患病情况及与炎性因子和其他因素的相关性分析[J].国际内分泌代谢杂志,2013,33(4):229-233.
[4]李雪艳,孙成娟,于松. 妊娠期糖代谢变化及其遗传学、代谢组学研究进展[J]. 中国妇产科临床杂志,2016,17(3):279-280.
[5]苏娜,王光亚,付冬霞,等. 妊娠期糖尿病患者产后代谢指标变化及影响因素研究[J]. 中国全科医学,2014,17(8):898-902.
[6]Al-Dughaishi T, Nikolic D, Zadjali F,etal. Nutraceuticals as lipid-lowering treatment in pregnancy and their effects on the metabolic syndrome[J]. Curr Pharm Biotechnol,2016,17(7):614-623.
[7]吕艳红,杜鹃,聂小毳.妊娠期代谢综合征脂蛋白相关磷脂酶A2变化研究[J].中国实用妇科与产科杂志,2014,30(10):798-801.
[8]Rice M M, Landon M B, Varner M W,etal. Pregnancy-associated hypertension in glucose-intolerant pregnancy and subsequent metabolic syndrome[J].Obstet Gynecol,2016,127(4):771-779.
[9]He Z, Li J, Luo H,etal.Sex-specific increase in susceptibility to metabolic syndrome in adult offspring after prenatal ethanol exposure with post-weaning high-fat diet[J]. Sci Rep,2015,5:17679.
[10]苏娜,王光亚,付冬霞,等. 妊娠糖尿病产后代谢综合征发病特点及影响因素研究[J]. 中国实用内科杂志,2014,34(5):504-506.
[11]张玲玉,叶鹏.代谢综合征患病率和C反应蛋白水平在患妊娠期高血压疾病妇女产褥期后的差异情况[J].中华高血压杂志,2011,19(5):421.
[12]赵海燕,高竞生,安利杰,等. 妊娠高血压综合征对妇女远期代谢综合征的影响[J]. 中华高血压杂志,2013,21(10):949-953.
[13]董胜雯,韩姹. 脂肪细胞型脂肪酸结合蛋白与妊娠期糖尿病及代谢综合征[J]. 中华围产医学杂志,2013,16(5):305-307.
[14]Ranke M B, Schweizer R, Rodemann S M,etal.Schoolchildren born VLBW or VLGA show height-related changes in body composition and muscle function but no evidence of metabolic syndrome risk factors. Results from the NEOLONG study[J]. J Pediatr Endocrinol Metab,2016,29(2):163-172.
[15]Facchinetti F, Bizzarri M, Benvenga S,etal. Results from the International Consensus Conference on Myo-inositol and d-chiro-inositol in Obstetrics and Gynecology: the link between metabolic syndrome and PCOS[J]. Eur J Obstet Gynecol Reprod Biol,2015,195:72-76.
[专业责任编辑:马良坤]
Relationship between 25(OH)D3 and gestational metabolic syndrome
LI Hui, ZHOU Ping, RAO Mei-lan, LIAO Bi-ling, YI Jing
(Department of Obstetrics and Gynecology, Guangdong Maternal and Child Health Care Hospital, Guangdong Guangzhou 510010, China)
Objective To investigate the relationship between 25(OH)D3 and gestational metabolic syndrome (GMS). Methods From January 2015 to January 2016 one hundred women diagnosed with GMS were recruited in GMS group from the department of obstetrics and gynecology in Guangdong Maternal and Child Health Care Hospital group, and another 100 healthy pregnant women were selected in control group. Blood 25(OH)D and related metabolic parameters of the cases were detected to analyze their correlation. Results To compare age, gravidity, delivery times and HDL-C levels, the differences had no statistical significance between GMS group and the control group (tvalue was 0.508, 1.010, 1.179 and 1.026, respectively, allP>0.05). In the GMS group BMI, TC, TG, LDL-C, systolic blood pressure (SBP), diastolic blood pressure (DBP), fasting plasma glucose (FPG), HbA1c and serum free fatty acid (FFA) levels were significantly higher than those in the control group (tvalue was 9.284, 5.572, 4.480, 3.192, 6.184, 4.317, 8.689, 9.360 and 3.070, respectively, allP<0.05). Levels of 25(OH) D3 in cases in the GMS group were significantly lower than those in the control group (t=16.856,P<0.05). Multi factor analysis with logistic regression showed that BMI in pregnancy and HbA1c were positively correlated with GMS but 25(OH)D3 level was negatively correlated with GMS (ORvalue was 1.797, 133.8 and -161.9, respectively). Conclusion Deficiency of 25(OH)D3 is an independent risk factor for GMS.
25 (OH) D3; gestation metabolic syndrome (GMS); correlation;gestation
2016-04-23
李慧(1977-),女,副主任医师,主要从事妇产科内分泌专业的工作。
10.3969/j.issn.1673-5293.2016.11.011
R714
A
1673-5293(2016)11-1322-04

