穿心莲内酯总酯磺化物对脓毒症患者血清炎性因子的影响
陈 伟 贾金虎 刘杜姣 薛庆亮
(1 兰州军区兰州总医院呼吸内科,兰州,730050; 2 酒泉市人民医院呼吸内科,酒泉,735000)
穿心莲内酯总酯磺化物对脓毒症患者血清炎性因子的影响
陈 伟1贾金虎2刘杜姣1薛庆亮1
(1 兰州军区兰州总医院呼吸内科,兰州,730050; 2 酒泉市人民医院呼吸内科,酒泉,735000)
目的:观察穿心莲内酯总酯磺化物对脓毒症患者血清中不同时段炎性因子的影响,为临床脓毒症的诊治探讨新思路。方法:将符合纳入标准的2013年12月至2015年3月入住兰州军区兰州总医院呼吸科、呼吸ICU、急诊科、消化科、ICU等科室的脓毒症患者80例,按病情程度分为脓毒症组和严重脓毒症组,各组按就诊先后顺序随机分为治疗亚组和对照亚组,每组20例,并于入院当天、治疗后第3天、7天测定各组患者血清中PCT、IL-6、CRP、HsCRP的浓度。结果:脓毒症、严重脓毒症中治疗亚组和对照亚组基本资料及治疗前炎性因子浓度相互比较(P>0.05),脓毒症治疗亚组中IL-6、HsCRP、PCT水平在治疗前后各时间段分别进行比较差异有统计学意义(P<0.05),治疗亚组和对照亚组患者CRP水平在治疗前与治疗后第3天比较差异有统计学意义(P<0.05),2组患者治疗后第3天与第7天分别比较,差异无统计学意义(P>0.05)。严重脓毒症治疗亚组治疗前和治疗后第3天IL-6、PCT、CRP浓度比较(P<0.05),HsCRP在对照亚组和治疗亚组各时间段比较差异无统计学意义(P>0.05)。结论:穿心莲内酯总酯磺化物可显著降低脓毒症及严重脓毒症患者发病早期IL-6、HsCRP、PCT、CRP等炎性因子的浓度,理论上可用于脓毒症的治疗。
脓毒症;严重脓毒症;炎性因子;穿心莲内酯总酯磺化物
脓毒症(Sepsis)是指各种感染引起的全身炎性反应综合征,其发病机制复杂[1],在病程的各个阶段,由于感染病原体的刺激及机体免疫机制的启动,在不同阶段分泌不同的炎性因子[2-3]。在发病早期,由于促炎因子(IL-6)等的大量分泌,使得感染机体产生严重的全身炎性反应,加重患者病情[4]。随着促炎-抗炎反应的发展,过多的抗炎因子的分泌使机体逐渐转入免疫抑制,对感染机体自身免疫的启动及恢复极为不利。PCT、CRP、HsCRP等炎性因子在病情发展的不同阶段,随着病情及感染的加重,其浓度也不同程度的升高[5-6]。有效降低炎性因子的浓度,减轻机体炎性反应,避免免疫抑制的发生,可能是脓毒症有效治疗的突破口。现观察穿心莲内酯总酯磺化物对脓毒症及严重脓毒症患者血清中不同时间段炎性因子浓度的影响,探讨临床药物干预对减轻脓毒症患者炎性反应的疗效。
1 资料与方法
1.1 一般资料 收集2013年12月至2015年3月于兰州军区兰州总医院呼吸科、呼吸ICU、消化科、急诊科、ICU等科室住院符合纳入标准的脓毒症患者80例作为研究对象,年龄均大于18周岁,向患者及家属告知清楚,签署知情同意书。将入选患者按病情严重程度分为脓毒症组和严重脓毒症组,各组按就诊顺序采用随机数字表法随机分为治疗亚组和对照亚组,每组20例。2组基本资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 选择标准
1.2.1 诊断标准 脓毒症的诊断标准参照《2012年国际严重脓毒症及脓毒性休克诊疗指南》[7]。
1.2.2 纳入与排除标准 纳入标准:通过医院伦理委员会批准,符合脓毒症诊断标准,患者签署知情同意书。排除标准:1)脓毒性休克(因病情危重,不易临床试验观察),非感染因素引起的SIRS;2)病毒或除外细菌外的其他微生物感染;3)应用刺激细胞炎性递质释放的药物;4)血液系统疾病及明确诊断为肿瘤的患者;5)慢性心功能不全或急性脑血管病变或长期器官灌注异常;6)18周岁≤年龄≦70周岁及2周以内有外科手术的患者;7)住院期间死亡或住院时间<5 d。
1.2.3 脱落及剔除标准 1)对穿心莲内酯总酯磺化物过敏者;2)治疗过程中患者病情加重或死亡者;3)治疗天数不足7 d;4)受试者依从性差、发生严重不良反应事件、发生并发症或不能耐受不宜继续接受试验,自行退出者等,均为脱落病例。
1.3 治疗方法 脓毒症治疗亚组采用注射用头孢曲松钠(上海罗氏制药有限公司)2 g静脉滴注,1次/d,穿心莲内酯总酯磺化物(江西青峰药业有限公司,国药准字Z20026249)250 mg静脉滴注,1次/d,治疗7 d,对照亚组只给予注射用头孢曲松钠及对症治疗7 d。严重脓毒症治疗亚组采用亚胺培南西司他丁钠[泰能,MerckCo.Inc,国药准字J20080046(20 mL)0.5 g静脉滴注,6 h/次]联合穿心莲内酯总酯磺化物250 mg静脉滴注,1次/d;严重脓毒症对照亚组采用亚胺培南西司他丁钠及对症治疗,总疗程为7 d。
1.4 观察指标 于入院当日、治疗后第3天、7天分别抽取各组患者空腹肘静脉血6 mL送检验科检验炎性因子(IL-6、PCT、CRP、HsCRP),并记录患者基本资料。
1.5 疗效标准 参照2012年美国胸科医师协会及危重病委员会关于脓毒症的诊疗指南[8]评定疗效。显效:治疗7 d时患者临床症状显著改善,肌酐等指标较治疗前下降,氧合指数较前增高或正常。无效:患者上述各项指标较治疗前无明显变化或明显加重或者患者死亡。

表1 各组患者基线资料比较

表2 各组患者治疗后疗效比较[例(%)]
注:aP<0.05表示与治疗前比较有统计学意义,abP<0.05表示与对照组比较有统计学意义,abcP<0.05表示亚组间比较差异有统计学意义。

表3 各组患者治疗前后各时间段血清中炎性因子浓度变化比较
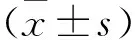
2 结果
2.1 基线资料比较 80例脓毒症患者基本资料进行比较,治疗前脓毒症组中治疗亚组和对照亚组基本资料相比较(P>0.05),严重脓毒症组中治疗亚组和对照亚组治疗前基本资料相互比较(P>0.05);而脓毒症及严重脓毒症中治疗亚组和对照亚组相互之间比较,年龄、体温、呼吸、性别、PaCO2、PaO2、血糖等相互比较(P>0.05),各亚组其余指标相互比较(P<0.05)。见表1。
2.2 疗效比较 两型脓毒症各亚组患者治疗后各疗效指标比较后可见治疗亚组有效率高于对照亚组(P<0.05),脓毒症型治疗亚组、对照亚组治疗后有效率高于严重脓毒症治疗亚组、对照亚组(P<0.05),无效率低于严重脓毒症治疗亚组(P<0.05)。见表2。
2.3 炎性因子比较 脓毒症组治疗亚组治疗前后各时间段IL-6、HsCRP、PCT水平比较,差异有统计学意义(P<0.05),CRP水平在治疗前与治疗后第3天比较,差异有统计学意义(P<0.05),治疗后第3天与第7天比较,差异无统计学意义(P>0.05);对照亚组治疗后3天与治疗前比较,差异有统计学意义(P<0.05),第3天与第7天分别比较,差异无统计学意义(P>0.05)。严重脓毒症组中治疗亚组和对照亚组治疗前各炎性指标比较(P>0.05)。治疗亚组治疗前和治疗后第3天IL-6、PCT、CRP浓度比较(P<0.05),第3天和第7天比较(P>0.05),HsCRP在对照亚组和治疗亚组各时间段比较,差异无统计学意义(P>0.05),治疗后7 d 2亚组间炎性因子浓度比较后IL-6、PCT浓度严重脓毒症型高于脓毒症型(P<0.05),CRP、HsCRP浓度2组脓毒症患者差异无统计学意义(P>0.05)。见表3。
3 讨论
脓毒症是临床常见急危重症,是内外科ICU患者死亡的主要原因之一[9-10],既往针对脓毒症的研究说明炎性因子是脓毒症患者病程中最为活跃的发病因素[11-12],在病程的不同阶段,呈不同的分泌特点,甚至过度的炎性因子分泌引起细胞因子风暴及机体免疫抑制,造成疾病后期患者处于免疫抑制状态[13],炎性因子的浓度与机体感染的严重程度呈正相关[14-15]。过多的炎性因子一方面可加重机体的全身炎性反应,另一方面可抑制机体免疫应答的启动,对脓毒症等感染性疾病的预后极为不利[16]。中药穿心莲内酯总酯磺化物具有清热解毒、凉血合营的功效,对多种病原体均具有较好抑制作用,研究提示[17]其抗炎机制主要是通过抑制机体一氧化氮(NO)、环氧化物酶(COX-2)的表达,抑制黏附分子产生及NF-κb(信号转导通路)激活,抑制细胞因子释放及活化等多条途径而发挥作用。本结果显示:中药穿心莲提取物穿心莲内酯总酯磺化物可显著降低脓毒症及严重脓毒症患者发病早期IL-6、HsCRP、PCT、CRP等炎性因子的浓度,但并不能降低脓毒症后期CRP浓度及严重脓毒症患者HsCRP的浓度,CRP作为一种急性反应蛋白,在发病初期升高,随着病程的发展及治疗,CRP浓度在疾病后期下降缓慢,在严重脓毒症患者治疗过程中,HsCRP浓度并未显著降低,可能与严重脓毒症时患者血管功能障碍有关,这与林诗杰等研究结果一致[18]。治疗亚组有效率明显高于对照亚组,无效率低于对照亚组,穿心莲内酯总酯磺化物对严重脓毒症亦有显著疗效,可提高严重脓毒症患者有效率。通过检测炎性因子在脓毒症及严重脓毒症患者血清中各发病时期的浓度变化,研究参与脓毒症病程发展的炎性因子及其各时项分泌特点,从而为临床各时期降低脓毒症患者血液中促炎因子的分泌及炎性因子的浓度,减轻感染机体的全身炎性反应,避免感染机体免疫抑制的发生而提供理论参考。本研究由于脓毒症患者病例收集困难,存在样本量少,统计结果存在误差等不足,需要大样本量、随机、多中心的双盲对照研究结果证实本研究的可靠性。
[1]尹承芬,姚咏明.脓毒症动物模型的研究进展[J].中华实验外科杂志,2013,30(5):1092-1093.
[2]Goyert SM,Silver J.Editorial:PD-1,a new target for sepsis treatment:better late than never[J].J Leukoc Biol,2010,88(2):225-226.
[3]伏建峰.脓毒症的发病机制及防治药物研发新思路[J].国际检验医学杂志,2011,32(1):66-68.
[4]罩月秋,廖品玻.重症急性胰腺炎脏毒症发病机制的研究进展[J].医学综述,2013,19(8)1359-1362.
[5]付阳,陈捷,蔡蓓,等.血清降钙素原和免疫炎性因子C反应蛋白、白介素-6、血清淀粉样蛋白A在脓毒血症中的诊断价值[J].四川大学学报:医学版,2012,43(5):702-705.
[6]于永焕,孙丰楠.降钙素原与C-反应蛋白检测在菌血症和脓毒血症中的临床价值[J].中国医刊,2013,48(9):56-57.
[7]Dellinger R P,Levy M M,Rhodes A,et a1.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock,2012[J].Intensive Care Med,2013,39:165-228.
[8]高戈,冯拮,常志刚,等.2012国际严重脓毒症及脓毒性休克诊疗指南[S].中华危重病急救医学,2013,25(8):501-505.
[9]颜默磊,严静,陈进,等.老年严重脓毒症及脓毒性休克微循环变化的观察[J].中华医学杂志,2013,93(25):1965-1969.
[10]Sakr Y,Dubois MJ,De Backer D,et al.Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock[J].Crit Care Med,2004,32(9):1825-1831.
[11]Dellinger R P,Levy M M,Cadet J M,et a1.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock:2008[J].Crit Care Med,2008,36:296-327.
[12]Russell J A.Management of sepsis [J].N Engl J Med,2006,355(16):1699-1713.
[13]Hotchkiss R S,Karl I E.The pathophysiology and treatment of sepsis[J].N Engl J Med,2003,348(2):138-150.
[14]Marshal J C.The pathogenesis and molecular biology of sepsis[J].Crit Care Resusc,2006(8):227-229.
[15]张伟,林兆奋,瞿金龙,等.急诊感染患者凝血障碍与脓毒症严重程度的关系[J].中华急诊医学杂志,2012,21(2):123-127.
[16]艾红梅.常用生物标记物在脓毒症中的应用现状及展望[J].实用医学杂志,2012,28(4):662-663.
[17]尹青,邓明明.穿心莲内酯抗炎作用机制研究进展[J].广东医学,2014,35(5):786-788.
[18]林诗杰,刘升明.肺炎合并脓毒症患者检测血清降钙素原、超敏C反应蛋白的临床意义[J].实用医学杂志,2011,27(24):4440-4442.
(2015-12-22收稿 责任编辑:王明)
Effect of Andrographolide Total Ester Sulfonate on Inflammatory Factors in Serum of Patients with Sepsis
Chen Wei1, Jia Jinhu2, Liu Dujiao1, Xue Qingliang1
(1RespiratoryDepartmentofInternalMedicine,LanzhouGeneralHospitalofLanzhouMilitaryCommand,Lanzhou730050,China; 2People′shospitalofJiuquan,Jiuquan735000,China)
Objective:To observe the effect of andrographolide total ester sulfonate on inflammatory factors in serum of patients with sepsis in different periods and to explore new methods of diagnosis and treatment of sepsis.Methods:There were 80 cases of sepsis meeting the criteria, who were hospitalized in respiratory department, respiratory ICU, emergency department, digestive department, ICU and other departments of Lanzhou General Hospital of Lanzhou Military Command from December 2013 to March 2015, divided into sepsis group and severe sepsis group according to their condition. Each group were randomized into sub treatment group and sub control group, each 20 people, and on the day of admission, 3 days and 7 days after treatment, all patients′ PCT, IL-6, CRP and HsCRP in serum were tested.Results:The Basic information and Inflammatory facotrs concentration before treatment were compared in sepsis group, severe sepsis sub treatment group and sub control group (P>0.05); it showed statistical significance in the comparison of PCT,IL-6 and HsCRP level between various periods before and after the treatment (P<0.05); in sub treatment group and sub control group, patients′ CRP level before treatment was compared with that of 3 days after treatment (P<0.05), and the difference was statistically significant, while that of 3 day and 7 days after treatment in both groups were also compared (P>0.05), there was no statistical significance.IL-6, PCT and CRP concentration of severe sepsis sub treatment group before and after treatment 3 days were compared(P<0.05), showing no statistical significance when HsCRP in the sub control group and sub treatment group of various period was compared (P>0.05).Conclusion:Andrographolide total ester sulfonate had great effect on reducing inflammatory factors concentration like IL-6, HsCRP, PCT and CRP in sepsis and severe sepsis patients of early stage, thun it could be used as treatment of sepsis theoretically.
Sepsis; Severe sepsis; Inflammatory factor; Andrographolide total ester sulfonate
全军十二五后勤科研面上项目(编号:CWS11J230)
陈伟(1979.08—),男,大学本科,主治医师,研究方向:呼吸危重症及感染性疾病的诊疗,E-mail:jiajinhu1987@163.com
贾金虎(1987.02—),男,研究生,医师,研究方向:呼吸系统危重症及感染性疾病的诊治,E-mail:jinhujia1984@163.com
R259
A
10.3969/j.issn.1673-7202.2016.11.030

