一种酿酒用工业微生物简易扩大培养装置的设计与应用
程 伟,王海雷,汪焰胜,黄训端,丁 雷,高志远,薛锡佳,吴宏萍,谢国排,彭 兵
(1.安徽金种子酒业股份有限公司,安徽阜阳236023; 2.安徽省阜阳市肿瘤医院神经内科,安徽阜阳236000;3.安徽大学健康科学研究院,安徽合肥230601; 4.安徽金种子集团有限公司检测中心,安徽阜阳236018)
一种酿酒用工业微生物简易扩大培养装置的设计与应用
程伟1,王海雷2,汪焰胜3,黄训端3,丁雷1,高志远1,薛锡佳4,吴宏萍4,谢国排1,彭兵1
(1.安徽金种子酒业股份有限公司,安徽阜阳236023; 2.安徽省阜阳市肿瘤医院神经内科,安徽阜阳236000;3.安徽大学健康科学研究院,安徽合肥230601; 4.安徽金种子集团有限公司检测中心,安徽阜阳236018)
提供发酵产量高、生产性能稳定、数量充足且不被杂菌污染的生产菌种,是种子制备工艺的关键;其中,扩大培养装置的设计与应用在微生物扩大培养种子制备过程中起到重要作用,直接关系到种子制备的质量与效率。探讨了一种酿酒用工业微生物简易扩大培养装置的设计与应用,该简易培养装置包括1m3小培养罐和5m3扩大培养罐,并配备有罐体保温罩、空气压缩机、搅拌器、循环盘管、温度传感器和液位计等;该装置的罐体呈圆柱体,分别开启蒸汽、搅拌机、循环水等对应管线或装置,可实现蒸汽加热杀菌、搅拌、冷却或保温、温度及液位监测等,提高酿酒用工业微生物扩大培养的效率,尤其适用于复合己酸菌液的培养。该装置可基本实现酿酒用工业微生物的密闭连续性扩大培养、有效避免杂菌污染,且微生物生长旺盛、酶活较传统扩大培养方式大为提高,生产应用效果较好。
酿酒; 工业微生物; 扩大培养; 装置; 设计
微生物菌种的扩大培养是发酵生产的第一道工序,该工序又称之为种子制备。种子制备不仅要使菌体数量增加,更重要的是培养出具有高质量的生产种子供发酵生产使用。因此,如何提供发酵产量高、生产性能稳定、数量充足而且不被其他杂菌污染的生产菌种,是种子制备工艺的关键[1]。扩大培养装置的设计与应用在微生物菌种的扩大培养种子制备过程中起到重要作用,直接关系到微生物生产种子制备的质量与效率。在传统固态白酒酿造过程中,微生物对白酒的产量、品质、风味等都起着重要作用[2]。酿酒酵母、高糖化力霉菌、酯化红曲霉菌、己酸菌等的扩大培养与应用,对提高原酒的产量、质量起到积极作用。在原酒生产实际过程中,不可避免地要用到酿酒工业微生物的液体扩大培养装置,尤其是浓香型白酒人工窖泥培养及窖池养护过程中的复合己酸菌液的制备。从浓香型白酒优质老窖泥中分离的功能己酸菌,其己酸代谢能力较强,己酸乙酯的合成丰富;在浓香型白酒酿造过程中,己酸菌的液体复合培养技术及其应用,对促进人工窖泥的老熟、提高基酒优质酒率等,具有明显的效果[3]。现有的酒企使用工业微生物的扩大培养装置,尤其是复合己酸菌液的扩大培养装置,结构大多较为粗放、密闭连续性不强、温度控制效果差等,容易造成杂菌污染,影响菌种的扩大培养效果,影响生产。因此,设计与应用一种结合酿酒生产实际需要、结构合理、功能完备的酿酒用工业微生物的扩大培养装置十分必要。
1 设计目的及其实施例分析
1.1所要解决的技术问题及其达到的有益效果
菌种扩大培养的主要目的是为每次发酵罐的投料提供相当数量代谢旺盛的微生物种子,工业生产规模越大,每次发酵所需的种子就越多。发酵时间与接种量有关,接种量越大,发酵时间越短;将较多数量的成熟菌体接入发酵罐中,有利于缩短发酵时间,提高发酵罐的利用率,并且也有利于减少杂菌污染的机会;因此,种子扩大培养不但需要纯而壮的菌体,而且还需要有活力旺盛接种数量充足的菌体。
本设计所要解决的技术问题是提供一种酿酒用工业微生物的简易扩大培养装置,为解决现有酿酒用工业微生物扩大培养装置,尤其是复合己酸菌液的扩大培养装置,结构大多较为粗放、密闭连续性不强、温度控制效果差等弊端。本设计所提供的一种酿酒用工业微生物的简易扩大培养装置,尤其适用于复合己酸菌液的扩大培养。该酿酒用工业微生物的简易扩大培养装置,占地面积小、设备投资少,不仅可以实现常用酿酒工业微生物逐级扩大培养的密闭连续性,避免杂菌污染,而且能实现温度的调整控制,适用于好氧、兼氧与厌氧等酿酒用工业微生物扩大培养,应用价值较高。
1.2种子罐级数的确定
对不同微生物菌种的发酵过程来说,必须根据菌种生长繁殖速度决定种子扩大培养的级数[4],一般50 t发酵罐多采用三级发酵,有的甚至采用四级发酵,如链霉素生产;有些酶制剂发酵生产也采用三级发酵,而谷氨酸及其他氨基酸的发酵所采用的菌种是细菌,生长繁殖速度较快,一般采用二级发酵。种子制备的过程大致可分为实验室种子制备阶段和生产车间种子制备阶段。实验室种子制备阶段是指琼脂斜面保藏菌种转接至固体培养基扩大培养(如茄子瓶斜面培养)或液体摇瓶培养,进行保藏菌种的复壮与传代培养,生产车间种子制备阶段是种子罐扩大培养,以便直接应用与生产。
微生物液体种子的制备方法主要分为好氧培养与厌氧培养[5]:(1)好氧培养:对于产孢子能力不强或孢子发芽慢的菌种,可以用摇瓶液体培养法,将孢子接入含液体培养基的摇瓶中,于摇瓶机上恒温振荡培养,获得菌丝体作为种子,试管→三角瓶→摇床→种子罐;(2)厌氧培养:对于酵母菌,试管→三角瓶→卡式罐→种子罐。种子罐级数是指制备种子需逐级扩大培养的次数,种子罐的级数取决于菌种生长特性、孢子发芽及菌体繁殖速度、所采用发酵罐的容积等,对于细菌来说,菌体生长快,种子用量比例少,级数也较少,一般采用二级发酵,即茄子瓶→种子罐→发酵罐。对于霉菌来说,霉菌生长较慢,需要三级发酵,即孢子悬浮液→一级种子罐(27℃,40 h孢子发芽,产生菌丝)→二级种子罐(27℃,10~24 h,菌体迅速繁殖,粗壮菌丝体)→发酵罐。放线菌生长更慢,采用四级发酵。酵母生长比细菌慢,比霉菌、放线菌快,通常用一级种子。
确定种子罐级数需注意一些问题:种子级数越少越好,可简化工艺和控制,减少染菌机会。但种子级数太少,接种量小,发酵时间延长,降低发酵罐的生产率,增加染菌机会。虽然种子罐级数随产物的品种及生产规模而定,也与所选用的工艺条件有关。如改变种子罐的培养条件,加速了孢子发芽及菌体的繁殖,也可相应地减少种子罐的级数。本设计的种子罐包括1m3的小培养罐和5m3的扩大培养罐,其培养级数可根据需要采用1~3级,各级培养罐独立设置又相互联系,适用于细菌、霉菌、酵母菌等微生物的扩大培养。种子罐包括1m3的小培养罐和5m3的扩大培养罐,小培养罐与扩大培养罐上下放置,且小培养罐位于扩大培养罐上方,小培养罐顶部设有进料口,小培养罐底部设有放料口,扩大培养罐顶部设有进料口,扩大培养罐底部设有培养液出口,且扩大培养罐顶部进料口通过三通阀与小培养罐底部放料口连接。
1.3具体实施例分析
微生物发酵是一个无菌供气(或厌氧)的复杂生化过程,需要无菌空气与培养基的纯种浸没培养;因而发酵罐的设计,不仅是单体设备单元的设计,而且还涉及到培养基灭菌、无菌空气的制备与供给、发酵过程控制与工艺管道配制等的系统工程[6]。本文设计的一种酿酒用工业微生物的简易扩大培养装置,其特征:包括1m3的小培养罐和5m3的扩大培养罐,小培养罐与扩大培养罐上下安置,且小培养罐位于扩大培养罐上方,小培养罐顶部设有进料口,罐底部设有放料口,扩大培养罐顶部设有进料口,底部设有培养液出口,且扩大培养罐顶部进料口通过三通阀与小培养罐底部放料口连接。小培养罐、扩大培养罐中分别转动安装有中心轴竖向的搅拌轴,搅拌轴下部分别固定有搅拌叶片。小培养罐、扩大培养罐顶部分别安装有驱动搅拌轴转动的电机,小培养罐、扩大培养罐内还分别设有环绕在各自搅拌轴外的加热及冷却盘管,加热及冷却盘管两端分别穿出所在培养罐,且2个加热及冷却盘管一端共接后与给汽、循环水管连接,另一端共接后与排汽、循环水管连接。小培养罐、扩大培养罐底部分别连通安装有净化空气的进气管,连通位置分别邻近对应的搅拌轴下端。小培养罐、扩大培养罐顶部分别连通安装有净化空气排气管,小培养罐、扩大培养罐相同方向一侧分别连通安装有给汽、进水管。
如图1所示的一种酿酒用工业微生物的简易扩大培养装置,其包括罐体稳固架、支腿、1m3小培养罐(4)、5 m3扩大培养罐(6),培养罐上下放置,罐体呈圆柱体,罐体保温罩外置于罐体表层,并配备有搅拌器(3)、加热及冷却盘管(5),温度显示、液位计(10)等。通过对应阀门控制,通过给汽、进水管(2),实现对小培养罐和扩大培养罐的蒸汽加热,注水等;同时,给汽、循环水管(1),可实现对罐内培养基的间接加热、冷却以及保温。加热及冷却盘管(5),呈低进高出,排布在培养装置的中心区域。
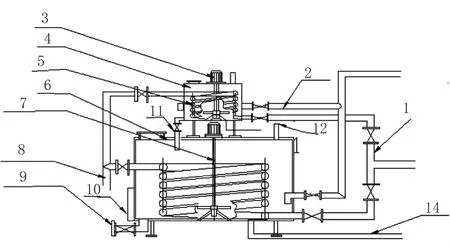
图1 酿酒用工业微生物简易扩大培养装置的结构示意图
如图1所示,小培养罐(4)、扩大培养罐(6)内底部中心分别安装有搅拌轴支架(15),搅拌轴(7)下端分别转动安装在对应的搅拌轴支架(15)中,并且小培养罐(4)、扩大培养罐(6)外分别罩有保温罩。加热及冷却盘管(5)在培养罐中呈低进高出向上循环,其中2个加热及冷却盘管(5)上端穿出培养罐并共接后与排汽、循环水管(8)连接,2个加热及冷却盘管(5)下端穿出培养罐并共接后与给汽、循环水管(1)连接。扩大培养罐(6)一侧安装有温度显示及液位计(10)。净化空气进气管(14)设置于罐体底部,与搅拌轴(7)下端相邻,净化空气可通过配备有空气净化装置的空气压缩机供给。
本设计的扩大培养装置设置有排汽、循环水管(8),如图1所示,可实现对经过加热及冷却盘管(5)后排放的蒸汽、循环水的收集再利用。该扩大培养罐(6)通过三通阀(11)与小培养罐(4)连接,可实现小培养罐(4)与扩大培养罐(6)的连通,通过培养液出口(9),可实现成熟扩大培养菌液的排放使用。该扩大培养罐(6)一段顶部设置有净化空气排气管(12),可实现罐体内外压力的平衡,又避免杂菌污染。
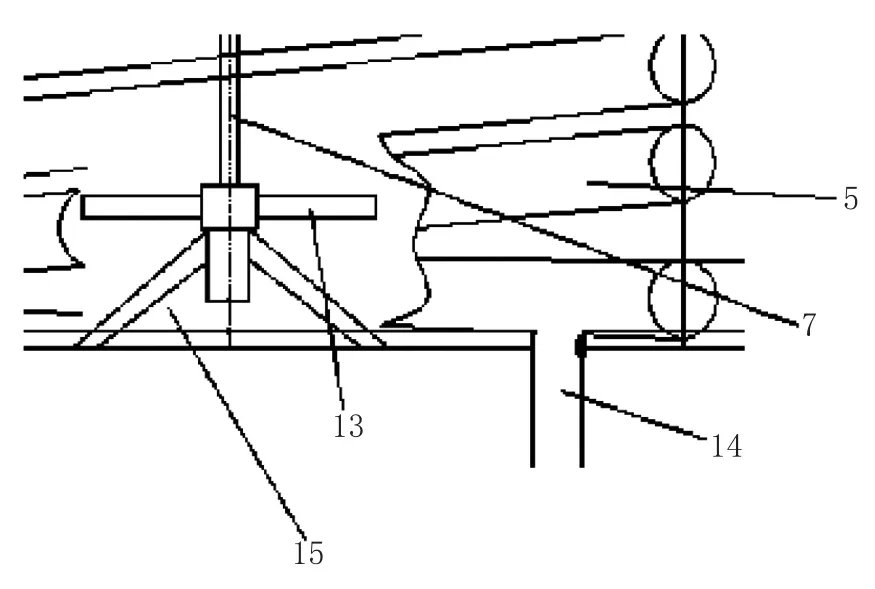
图2 简易扩大培养装置净化空气进口局部示意图
培养罐内安装的搅拌器首先用来分散气泡以得到尽可能高的传质系数KLa(好氧培养),此外还使被搅拌的发酵液(培养基)循环以增加气泡的平均停留时间,并在整个培养液系统中均匀分布,防止其并聚。当气体流量一定时,罐内流型取决于搅拌叶的速度。搅拌叶转速低时,搅拌叶的作用被上升气流吞没,增加搅拌速度,气体就在整个罐内形成循环,此时出现了完全分散的搅拌速度(以Ncd表示),以后再加大搅拌叶转速,罐内整体流型保持不变,增加搅拌强度也就增加了气体截留率和传质速率。如图2所示,本设计的搅拌系统采用在罐体底部安装一个用来分散空气的涡轮搅拌器,其上部再安装一组轴流式搅拌器,用来循环发酵液(培养基),达到气泡分布均匀、加强热量传递和消除罐内上、下部之间含氧量梯度差等效果。
本设计的扩大培养装置主要采用深层液体发酵方式实现微生物菌种的扩大培养,由罐底部通气,送入的净化空气由搅拌桨叶分散成微小气泡以促进氧的溶解。这种由罐底部通气搅拌的培养方法,相对于由气液界面靠自然扩散使氧溶解的表面培养法,液体培养基溶解氧较为充分,可以有效促进好氧微生物的扩大培养,其特点是容易按照生产菌种对代谢的营养要求以及不同生长时期的通气、搅拌、温度与培养基中氢离子浓度等条件,选择最佳培养条件。本设计的培养装置采用深层培养基本操作的主要控制点有:①灭菌:发酵工业要求纯培养,因此在种子培养前必须对培养基进行加热灭菌,所以本设计的种子罐具有蒸汽夹套,以便将培养基和种子罐进行加热灭菌;②温度控制:培养基灭菌后,冷却至培养温度进行种子培养,由于随着微生物的生长和繁殖会产生热量,搅拌也会产生热量,所以设计要维持温度恒定,在夹套中或盘管中通冷却水循环;③通气、搅拌:空气进入种子罐前先经过空气过滤器除去杂菌,制成无菌空气,而后由罐底部进入,再通过搅拌将空气分散成微小气泡,为了延长气泡滞留时间,可在罐内装挡板产生涡流;搅拌的目的除增加溶解氧以外,可使培养液中的微生物均匀分散在种子罐内,促进热传递,以及pH值均衡,并使加入的酸、碱等分散均匀。
本设计的扩大培养装置培养基采用实罐灭菌,为使灭菌时培养基的传热较为理想,需要开动搅拌电机,但此时往往不通入空气,因而使搅拌功率上升,如果操作不当,有可能导致电机损坏;为此,本设计使用多极电机,其电机(3)固定于罐体顶部居中位置,可以在实消时低速搅拌,在正常发酵时搅拌全速运行,在发酵过程中以满足不同需氧量的搅拌操作要求。如图1所示,电机(3)固定于罐体顶部居中位置,搅拌轴(7)伸入到罐体底部,搅拌轴(7)下端设有搅拌叶片(13),搅拌轴(7)与罐体底部设置搅拌轴支架(15),加热及冷却盘管(5)在搅拌叶片(13)处呈环绕排布。
2 生产应用分析与探讨
2.1在复合己酸菌液培养中的应用
生产优质的浓香型白酒,窖泥是重要保障,原料是前提,大曲是基础,工艺是关键。浓香型大曲酒的主体香味物质是己酸乙酯,而己酸乙酯是窖泥中梭状芽孢杆菌、己酸菌等各种生香产酯微生物的代谢产物,因此,窖泥的质量直接决定着酒质的优劣,利用现代微生物技术培养的复合己酸菌液在浓香型白酒窖池养护与窖泥培养过程中起到重要作用。己酸菌培养液可广泛应用于浓香型大曲酒的灌窖、窖池保养、人工窖泥培养、酯化液的制作等,以改善和提高浓香型大曲酒的质量[7]。
应用本文设计的一种酿酒用工业微生物的简易扩大培养装置进行复合己酸菌液培养取得较好效果,将实验室制备的复合己酸菌种子液在1m3小罐内培养7 d后使用或转接到5m3大罐培养;在进行菌液配制前,先将大、小罐加入一定量的自来水后加热至97℃左右,达到一定的灭菌效果;自然冷却至37℃时接入实验室转接复壮的复合己酸菌菌种进行培养,培养时2 d取样检测。取样时每次取4支2m L离心管,以液面没至手腕(液面下10 cm左右)处作为取样深度,取样时注意将表层菌膜拨去,以免影响菌体密度检测。培养过程中,做好罐体的密闭与保温工作,培养温度控制在32~35℃;杜绝空气压缩机向培养罐通气,并封闭好罐口,尽量减少培养液与空气接触,创造厌氧条件,又可以避免杂菌污染。
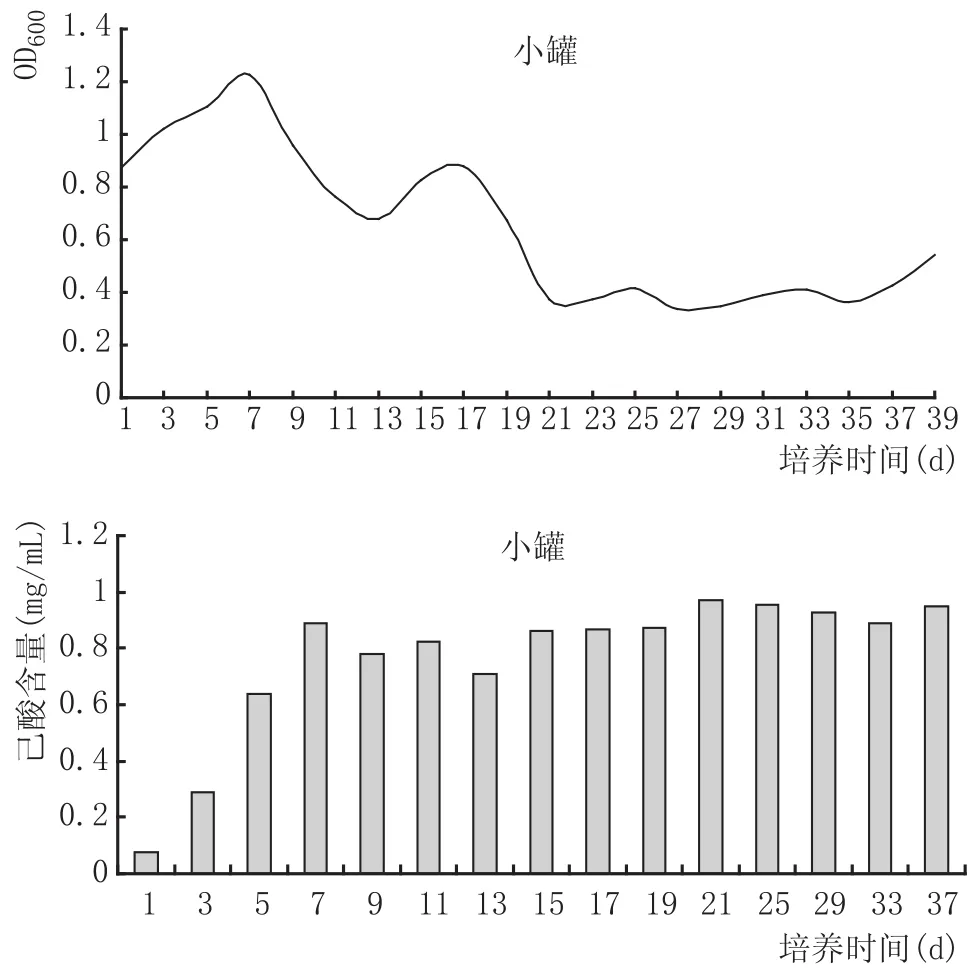
图3 培养装置厌氧培养复合己酸菌液1m3培养罐中菌体密度、己酸含量变化
由图3可知,1m3小罐培养液中菌体密度在前7 d内逐渐增大,在7 d时达到最大值,培养后期菌体密度逐渐降低;己酸含量在7 d时达到最大值,之后己酸含量趋于平稳。由图4可知,5m3大罐菌液在前10 d菌体密度逐渐增大,在10 d时达到最大值,菌体密度在后期培养过程中逐渐降低;可能是因为营养物质的消耗而导致最终的菌体数量减少,而己酸含量在前10 d逐渐增大,在达到最大值后期整体无太大变动。
以上结果表明,在1m3小罐培养液中菌体密度和己酸含量在7 d时达到最大值,而5m3大罐培养液中菌体密度和己酸含量达到最大值的时间则稍有延迟,在10 d时达到最大值,说明5m3大罐与1m3小罐因培养体积、温度控制等的差异对菌体密度和己酸含量有一定的影响,也表明,7~10 d是菌体转接较适宜的时间。
2.2在黑曲霉液体培养产糖化酶中试实验中的应用
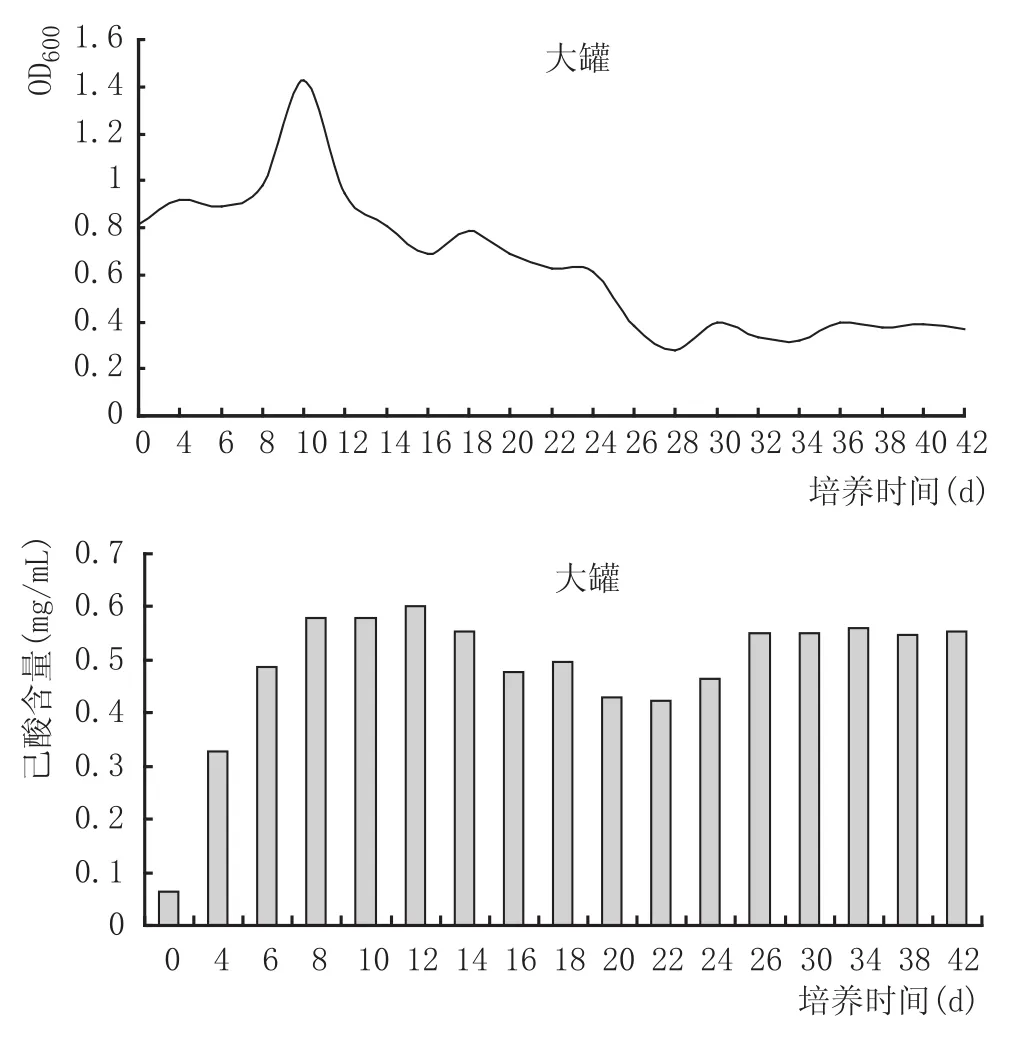
图4 培养装置厌氧培养复合己酸菌液5m3培养罐中菌体密度、己酸含量变化
浓香型白酒的酿造过程主要依靠众多微生物的协同参与,在微生物及其代谢酶的作用下大分子物质的降解、代谢产物的相互作用是决定白酒产量与品质的重要因素;其中,淀粉的糖化过程主要受霉菌代谢产生糖化酶的催化影响[8]。利用黑曲霉的液体深层发酵生产糖化酶,由于黑曲霉具很强的抗污染能力,生产力强,易培养,所以菌种培养条件一般较好控制,不会受到污染,而发酵培养条件较难控制。利用本文设计的培养装置对从金种子浓香型大曲中筛选得到的1株产糖化酶功能较强的黑曲霉霉菌进行液体培养产糖化酶条件考察,结果表明,黑曲霉菌株Mxzd-001液体发酵产糖化酶的适宜培养时间、培养温度分别为4 d、30℃,本文设计的培养装置取得了较好的应用效果。
将实验室制备的黑曲霉M xzd-001种子液以10%的比例接入到1m3小培养罐中进行扩大培养,培养过程中定时开启通气、搅拌装置,并分别考察培养时间、培养温度等培养条件对菌株产糖化酶活力的影响;取种子培养液于离心管中,以6000 r/m in离心10m in,取上清液分离纯化后,按照GB 8276—2006《食品添加剂糖化酶制剂》中的方法测定糖化酶活力[9]。
由图5(a)可知,随着发酵时间的延长,发酵液的糖化酶活性逐渐增加,培养96 h后,酶活达到最高值(910 U/m L),随后又逐渐下降;其中,在培养48~96 h期间,发酵液的糖化酶活性增加迅速,种子扩培液在培养3 d左右即可得到菌丝球长势较好、酶代谢旺盛的转接菌种。固态白酒酿造过程中的发酵温度呈现“前缓、中挺、后缓落”的趋势,发酵温度甚至可达到40℃以上;因此,参与发酵的糖化酶菌株要具备一定的耐高温性。由图5(b)可知,当培养温度在15~30℃时,发酵液糖化酶活性随着温度的上升而提高;当培养温度为30℃时,糖化酶活性最高(850 U/m L);培养温度达到50℃时,发酵液糖化酶活性仍可达到200U/m L,表明该菌株是可耐受高温环境的。

图5 中试实验过程中培养时间、温度对菌株Mxzd-001液体培养产糖化酶能力的影响
3 总结
本文设计了一种酿酒用工业微生物的简易扩大培养装置,并探讨了该装置在复合己酸菌液培养、霉菌液体发酵产糖化酶中试实验过程中的应用,生产实践结果表明,该装置的应用效果良好。本文所设计的一种酿酒用工业微生物的简易扩大培养装置,通过开启蒸汽、搅拌机、循环水等对应管线或装置,可实现加热杀菌、搅拌、冷却、保温、温度及液位监测等,可通过空气压缩机实现对罐体内培养基溶解氧的控制;该培养装置占地面积小、设备投资少,不仅可以实现常用酿酒工业微生物逐级扩大培养的密闭连续性,避免杂菌污染,而且能实现温度的调整控制,适用于好氧、兼氧与厌氧等酿酒用工业微生物扩大培养,尤其适用于复合己酸菌液的扩大培养,生产应用价值较高。
微生物液体发酵过程的自动化依赖于对发酵过程中工艺参数的检测与控制,目前,应用比较普遍的测量参数及自动控制主要有罐温、罐压、pH值、补糖、补水和加油消沫,以及空气流量、发酵液体积、溶氧、电机电流和功率等[10];由于生化工程的要求,培养罐的检测元件必须能满足蒸汽灭菌且不能对发酵液产生污染等;因此,本文设计的一种酿酒用工业微生物的简易扩大培养装置还需要进一步完善自动化控制单元与系统,以提高该装置的自动化控制水平,提高生产菌种的扩大培养效率。
[1]赵煜.基于嵌入式技术的微生物发酵罐控制系统研究及实现[D].杨凌:西北农林科技大学,2007.
[2]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014(3):1-4.
[3]肖冬光.白酒生产技术[M].2版.北京:化学工业出版社,2011.
[4]侯洪国.大型侧搅拌发酵罐内气液两相流的计算流体力学模拟[D].天津:天津大学,2010.
[5]钱竹.灵芝酸的液体发酵及其分离纯化的研究[D].无锡:江南大学,2006.
[6] 刘宝玲.锥形啤酒发酵罐无菌化测量及控制的研究[D].杭州:浙江大学,2006.
[7]谢国排,程伟,汪焰胜,等.金种子浓香型白酒人工窖泥培养工艺分析与探讨[J].酿酒,2015(5):49-54.
[8]刘兴照.谈谈传统白酒发酵过程中糖化酶的应用[J].中国酿造, 1998,17(4):27-29.
[9] 中国轻工业联合会.食品添加剂糖化酶制剂:GB 8276—2006 [S].北京:中国标准出版社,2007.
[10]石荣华,虞军.大型发酵罐设计及实例[J].医药工程设计杂志.2002,23(1):5-10.
Design and App lication of a Sim p le Device for Expanding CultureofM icrobes in Liquor-M aking Industry
CHENGWei1,WANG Hailei2,WANGYansheng3,HUANG Xunduan3,DING Lei1,gAO Zhiyuan1,XUEXijia4,WU Hongping4,XIEGuopai1and PENG Bing1
(1.JinzhongziDistillery Co.Ltd.,Fuyang,Anhui236023;2.Departmentof Neurology,Fuyang Tumor Hospital, Fuyang,Anhui236000;3.Research Institute of Health Sciences,AnhuiUniversity,Hefei,Anhui230601; 4.Testing Center,JinzhongziDistillery Co.Ltd.,Fuyang,Anhui236018,China)
M icrobialstrainw ith high fermentation yield,stable production performance,and sufficientquantity and no harm fulbacteria contamination is the key to the preparation of seed.The design and the application of the device for expanding culture ofm icrobes play an important role in seed preparation and w ill directly influence the quality and the efficiency of seed preparation.In this paper,the design and the application of a simple device for expanding culture ofm icrobes in liquor-making industry were introduced.Such simple device is composed of 1m3small culture tank and 5m3expanding culture tank,which are equipped w ith a tank insulation cover,air compressor,m ixer,circular coil,temperature sensor and liquid levelmeter etc.The tank of the device is a cylinder in correspondence to steamer,mixer,and circulatingwater pipeline etc.,respectively.Steam heating sterilization,stirring,cooling and insulation,temperature and liquid levelmonitoring could be easily achieved.Such device is especially suitable for the culture of compound caproic acid bacteria liquid.The use of such device could achieve closed continuous expanding culture ofmicrobes,and effectively avoid the contam ination of harm ful bacteria.Compared w ith traditional culturemodes,the device could achievebettereffects.
liquor-making;industrialm icroorganism;expanding culture;device;design
TS262.3;TS261.1;Q93-3
A
1001-9286(2016)11-0072-05
10.13746/j.njkj.2016233
安徽大学金种子酒业产业技术研究院校企合作项目;安徽省柔和型白酒酿造及质量安全工程技术研究中心资助项目。
2016-07-22
程伟(1984-),男,安徽阜阳人,工学硕士,工程师,高级品酒师,研究方向为食品微生物技术及发酵工程,E-mail:564853735@qq.com。
谢国排(1977-),男,安徽阜阳人,高级工程师,研究方向为酿酒生产技术与现代企业管理。
优先数字出版时间:2016-10-12;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20161012.1050.011.htm l。

