海马齿生态浮床对海水养殖池塘的修复效果
袁 星, 林彦彦, 黄建荣, 黎祖福
(中山大学生命科学学院,广东广州 510275)
海马齿生态浮床对海水养殖池塘的修复效果
袁 星, 林彦彦, 黄建荣, 黎祖福*
(中山大学生命科学学院,广东广州 510275)
摘要[目的]研究海马齿生态浮床对海水养殖池塘的修复效果。[方法]采取自然条件下周期性监测,根据试验海塘的地理形状和海马齿浮床铺设分布特点,设试验区和对照区,其中试验区设有海马齿区和无海马齿区,选择传统鱼塘作为对照区,研究养殖池塘在原位生态修复方法下水体氮、磷营养盐、海马齿生长、沉积物-水界面通量等的变化规律。[结果]海马齿生态浮床修复的试验区与对照区相比,DO浓度与透明度增大,主要污染物浓度降低。与对照区比较,海马齿浮床对磷、氨、氮有显著去除作用(P<0.05),海马齿浮床区域COD含量较对照区明显降低(P<0.05)。叶绿素a含量、TPM、POM均表现出试验区较对照区小(P<0.05),说明海马齿浮床对水体的颗粒有机物有去除作用。11月浮床区海马齿C储量为39.56 g/m2,N储量为0.77 g/m2,P储量为0.21 g/m2。[结论]海马齿生态浮床能改善养殖区域生态环境。
关键词海马齿生态浮床;生态修复;营养盐通量;沉积物
随着海洋养殖业的迅速发展,养殖区生态功能日益退化,制约着我国渔业发展。因此,建立符合国情的海水养殖区环境修复技术,对海水养殖产业可持续发展及生态环境保护具有重要意义。目前,利用海马齿生态浮床技术修复海水养殖区环境已有大量研究[1-2],但对环境中营养盐的立体监测较少,难以掌握营养盐流通情况。生态浮床具有较多优点,如工艺加工简便,可操作性强,运行成本低且易维护,生态风险相对较低及景观效果好等,得到了广泛研究与应用。海马齿(SesuviumportulacastrumLinn.)又名滨水菜、猪母菜或蟳螯菜,为番杏科(Aizonaceae)海马齿属(SesuviumL.),草本或亚灌木植物,是一种多年生匍匐性喜沙的兼性盐生植物[3]。笔者对耐盐植物海马齿生态浮床修复下的海水养殖池塘进行自然条件下周期性监测,以期全面掌握养殖池塘在原位生态修复方法下各指标(包括水体氮、磷营养盐,海马齿生长情况,沉积物-水界面通量等)的变化规律,旨在为构建更完善的海水养殖区生态修复体系提供理论基础与数据支撑。
1材料与方法
1.1试验地点试验地点位于广东省阳江市平岗镇海陵大堤东侧的滩涂水域(图1),该水域为新开发的养殖区域,滩涂底质为泥沙质,面积约66.66 hm2,平均水深1.2 m,为海水围塘。试验鱼塘能通过闸门与外界海域相通,涨潮时,定期开启闸门注入新鲜海水。
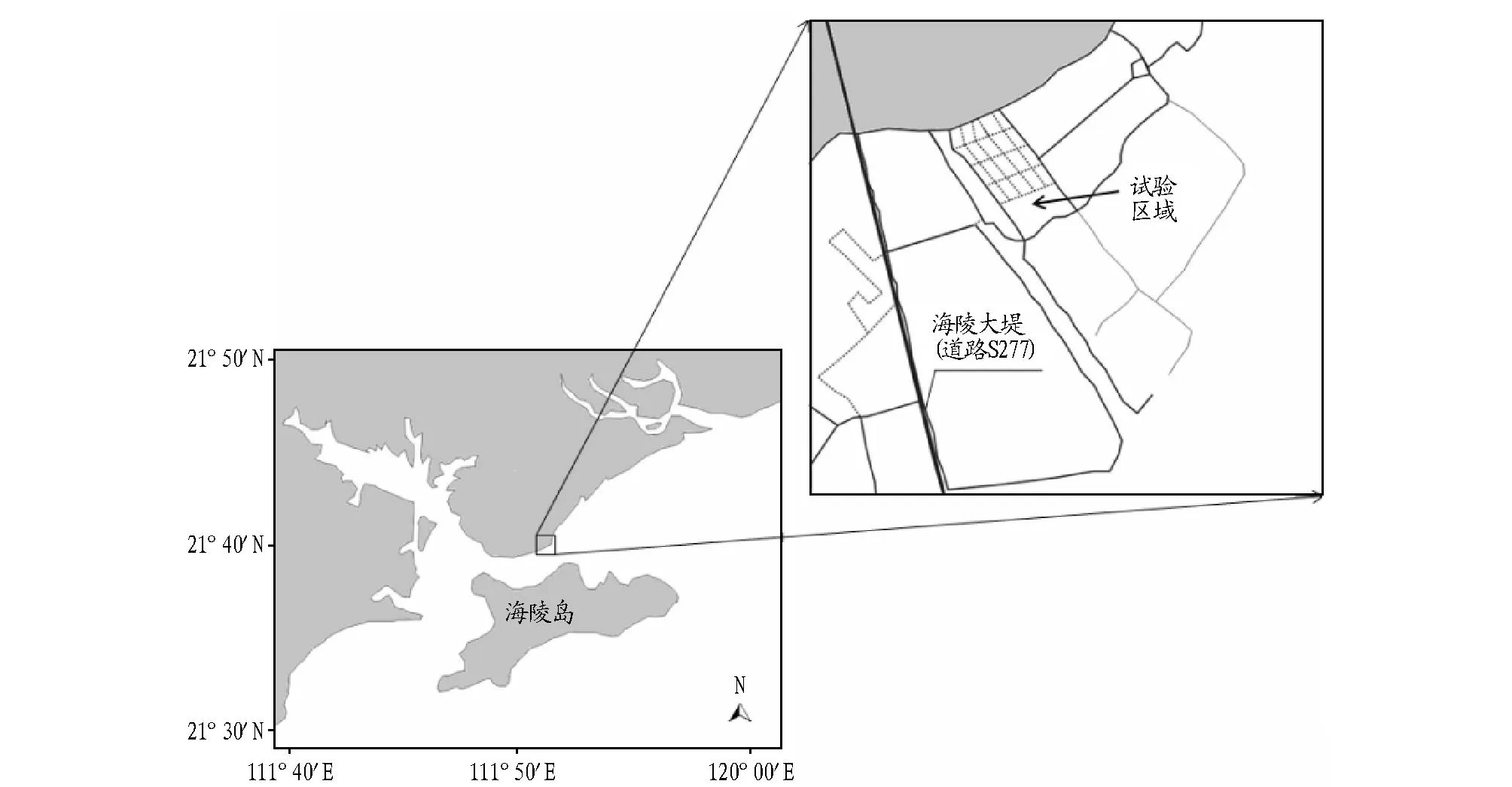
图1 试验地点Fig.1 Experimental sites
1.2试验设计试验池塘于2015年5月初投放35万尾黄鳍鲷(Sparuslatus)与15万尾罗非鱼(Oreochromismossambicus)。试验期间投喂罗非鱼饲料,2次/d,1次40 kg。
试验海塘海马齿铺设完成于2015年5月,试验区域海马齿浮床有2种,其中716个圆式浮床(图2)(种植面积1.04 m2/个)和950个条式浮床(种植面积1.82 m2/个)。浮床主体框架为PVC管加工而成,利用直径1 cm的网为载体种植30~40 cm海马齿30株左右,加以浮球增加浮力,且通过尼龙绳使海马齿浮床联结,利用木桩或竹子固定。海马齿来源于鱼塘周围红树林与堤坝生长旺盛的海马齿。海马齿铺设面积达到试验海塘的10%。根据试验海塘的地理形状和海马齿浮床铺设分布特点,共设5个采样点(图3、表1),选择旁边的传统鱼塘作为对照(CK)。

图2 海马齿浮床Fig.2 Sesuvium portulacastrum ecological floating bed
1.3测定项目与方法
1.3.1鱼塘海水环境的测定。2015年3~11月,每2个月采样1次,其中,3月为本底样。按照《海洋监测规范·第4部分·海水分析》(GB 17378.4—2007)进行水质分析。用温度计和盐度计现场测定水体温度和盐度,利用塞氏盘测定透明度,采用PHSJ—3F型pH计测定pH。
各化学指标方法:采用碱性高锰酸钾法测定COD含量;采用过硫酸钾氧化法测定TP、NP含量;采用溶解氧仪测定溶解氧(DO)浓度;采用次溴酸盐氧化法测定氨氮(NH4+-N)含量;采用抗坏血酸还原磷钼蓝法测定活性磷含量。叶绿素a(Chl a)测定方法:用GF/C膜抽滤适量水体,滤膜经过90%丙酮处理18~24 h后,用Turner Designs 10—AU叶绿素荧光测定仪测定含量。此外,取试验塘水进行抽滤,滤膜在500 ℃下灼烧3 h,并称量GF /F膜(直径47 mm),每次抽滤水300~500 mL。抽滤完的滤膜,用蒸馏水脱盐后,于65 ℃干燥24 h称量,得水体总悬浮颗粒物(TPM);65 ℃干燥24 h后的滤膜在500 ℃下灼烧3 h处理前后的质量差得颗粒有机质(POM)重量;采用Elementar Vario Macro CHN 型元素分析仪测定已经在干燥器中用浓盐酸烟雾去除碳酸盐滤膜获得[4]颗粒有机碳(POC) 和颗粒有机氮(PON);采用改进的灰化法测定[5]总磷(TP)含量。
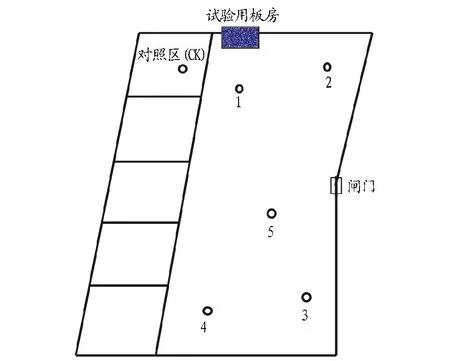
注:1~5分别表示5个采样点;1、2、3为海马齿浮床区域;4、5非海马齿浮床区域。Note:1-5 were five sampling sites. 1,2 and 3 were regions of S.portulacastrum ecological floating bed. 4 and 5 were regions without S.portulacastrum ecological floating bed.图3 采样点分布Fig.3 The distribution of sampling sites
1.3.2海马齿的生长及C、N、P含量的测定。从海马齿浮床中随机采集完整的海马齿50株,冲洗后放入封口袋,带回实验室测定各生长指标。同时将海马齿分成叶、茎、根3部分,把海马齿各部分置于60 ℃烘箱烘72 h,将样品研磨过滤后放入封口袋保存。利用Elementar Vario Macro CHN 型元素分析仪测定C、N含量,按照钼锑抗比色法测定[6]P含量。通过换算估算海马齿浮床的C、N、P含量。采用我国森林碳汇估算公式推导海马齿的C、N、P含量[7]。
Cj(g)=∑(Ci×Mi)
式中,Ci为海马齿各部分C、N、P含率,Mi为海马齿各部分平均生物量。
试验海塘海马齿碳密度= (Cj×ρj)/S
式中,S为浮床单体面积,ρj为浮床单体海马齿平均种植密度。
试验海塘海马齿N、P的总含量=Cj×Nj×ρj
式中,Nj为浮床数量。
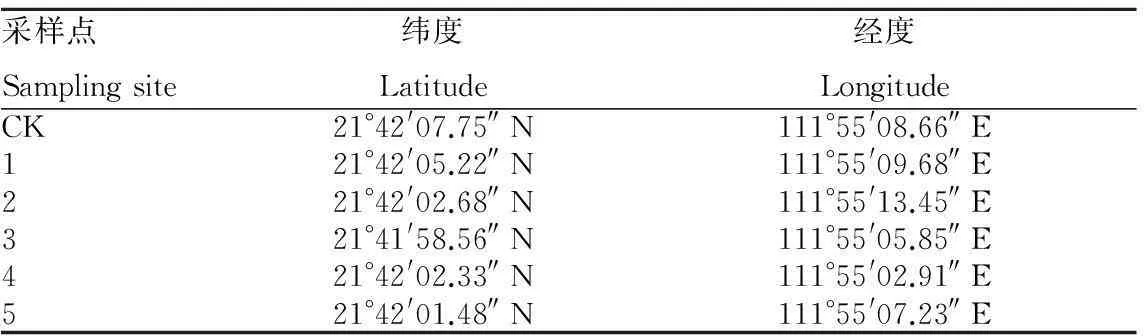
表1 各采样点的地理坐标
注:对照组为传统养殖塘;1、2、3为海马齿浮床区域;4、5非海马齿浮床区域。
Note:Control group was traditional pond; 1,2 and 3 were regions ofS.portulacastrumecological floating bed; 4 and 5 were regions withoutS.portulacastrumecological floating bed.
1.3.3鱼塘沉积物-水界面N、P通量的测定。利用直径为5 cm的有机玻璃管制作底泥采集器,采集5个样点与对照鱼塘深2 cm左右的沉积物与上覆水作为样品。用离心机5 000 r/min离心15 min沉积物得到间隙水,适当稀释后按照《海洋监测规范·第4部分·海水分析》(GB 17378.4—2007)测定氨氮(NH4+-N)、硝基氮(NO3--N)、亚硝基氮(NO2--N)、活性磷(PO43--P)含量。上覆水也测定以上4个指标。称取湿沉积物样,于110 ℃烘至恒重,测定沉积物的孔隙度,研磨后,利用Elementar Vario Macro CHN 型元素分析仪测定C、N含量,P含量消解后按照钼锑抗比色法测定[8]。采用扩散通量计算法,通过Fick第一定律计算沉积物间隙水与上覆水通量。
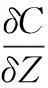
孔隙度根据沉积物的干湿比估算,公式为φ=(r-s)/r,其中,r为沉积物湿重,s为110 ℃干燥处理的沉积物质量[9]。该试验涉及的分子扩散系数见表2。
表2不同温度下各营养盐的扩散系数
Table 2Diffusion coefficients of nutritive salts under different temperatures
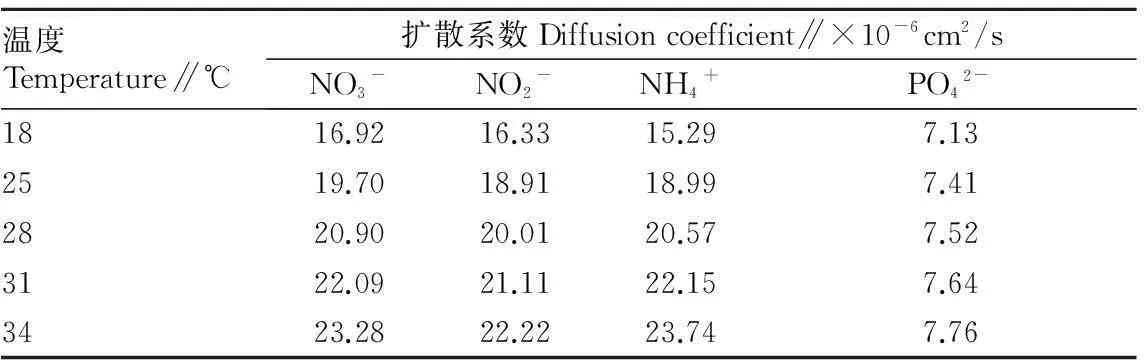
温度Temperature∥℃扩散系数Diffusioncoefficient∥×10-6cm2/sNO3-NO2-NH4+PO42-1816.9216.3315.297.132519.7018.9118.997.412820.9020.0120.577.523122.0921.1122.157.643423.2822.2223.747.76
2结果与分析
2.1水质变化结果由表3可知,3~7月水温从18 ℃升至35 ℃后,降至11月的28 ℃。盐度以5月最低,为12‰,这是由于5月雨水较多,11月盐度最高,为18‰。3~11月对照点的透明度较试验区低,无海马齿浮床的4、5号点的透明度略小于铺设海马齿浮床的1、2、3号点,这说明海马齿浮床系统可以增加水体透明度。随着时间的推移,试验区域水体透明度总体呈升高趋势,这与海马齿在浮床系统开始长出根系,旺盛生长有关。试验区域的pH大于对照区,DO浓度也表现出相似情况。
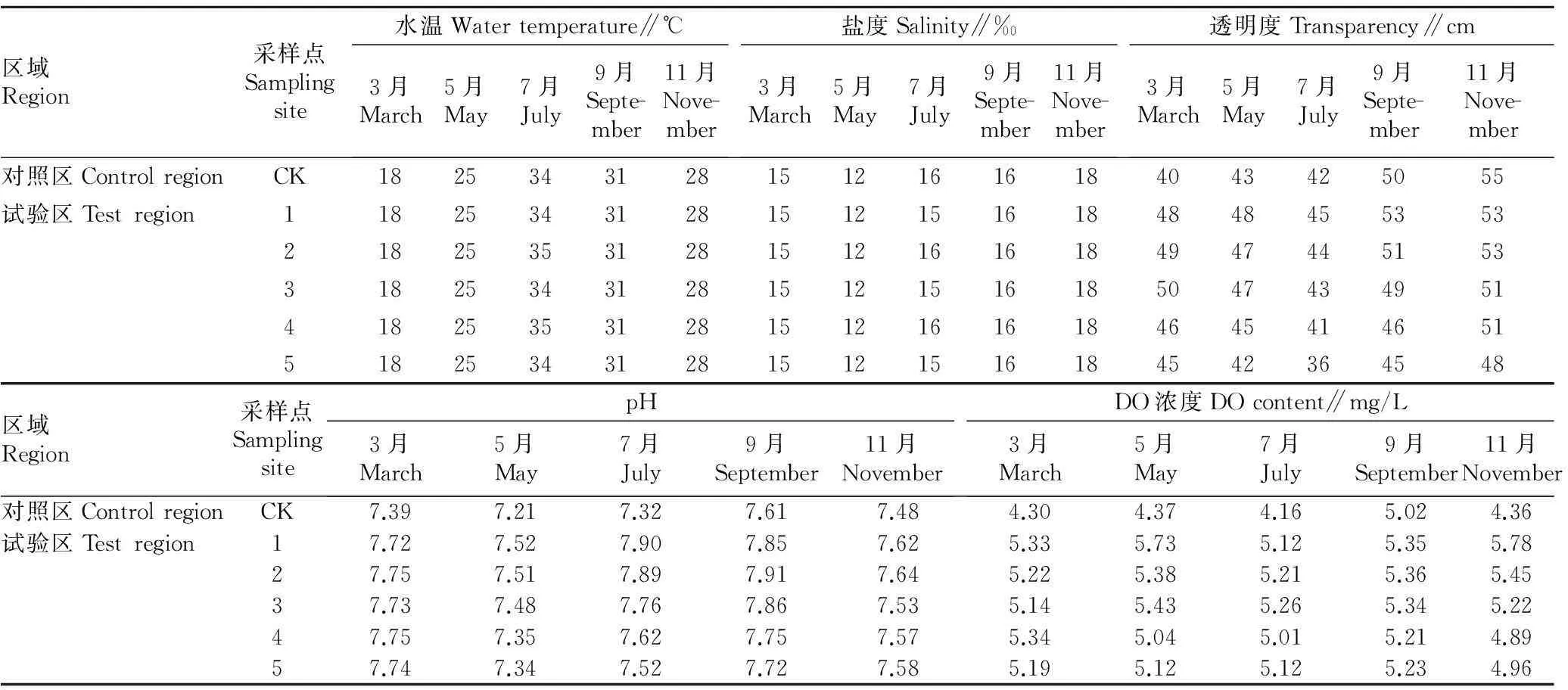
表3 2015年3~11月各采样点的水温、盐度、pH、透明度及DO比较
由表4可知,试验区与对照区相比,DO浓度明显增大,透明度增加,主要污染物浓度降低;有海马齿浮床(1、2、3号点)的透明度、DO浓度和污染物浓度均低于无海马齿浮床(4、5号点)。这表明海马齿浮床对P、NH4+-N有显著的去除作用(P<0.05)。
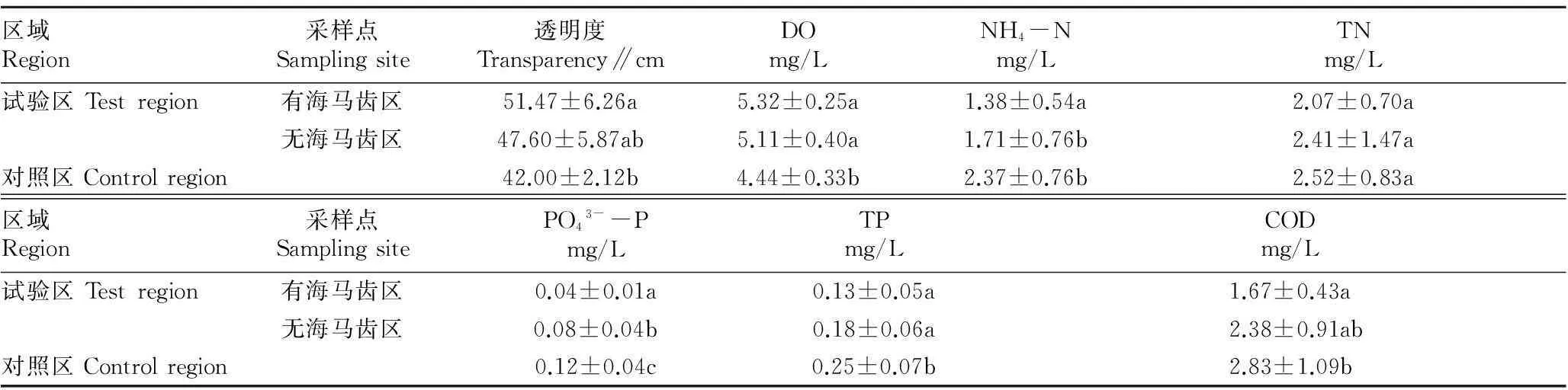
表4 对照区与试验区水质比较
注:同列不同小写字母表示差异性显著(P<0.05)。
Note:Different lowercases in the same row indicated significant differences (P<0.05).
由表5可知,叶绿素a、TPM、POM含量均表现出试验区比对照区小(P<0.05),说明海马齿浮床对水体的颗粒有机物有去除作用。此外,叶绿素a、POM、POC、PON、TP含量均与TPM含量有正向相关性(r=0.952,P<0.05;r=0.606,P<0.05;r=665,P<0.05;r=0.651,P<0.05;r=0.514,P<0.05)。
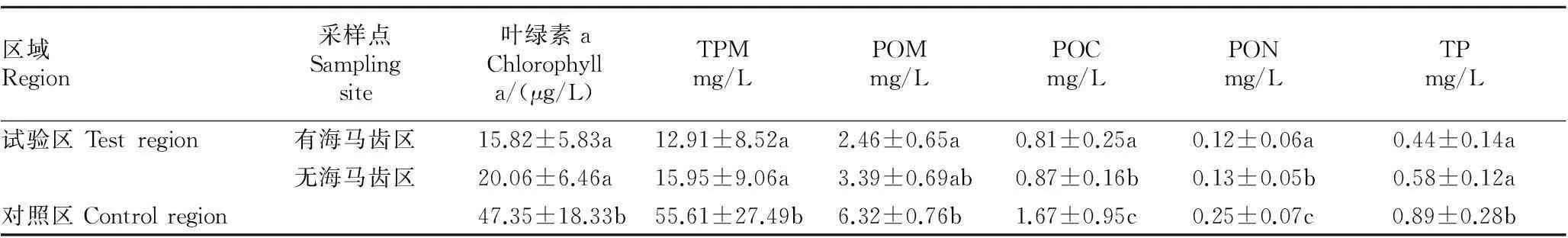
表5 试验区与对照区水体颗粒物及其成分含量比较
注:同列不同小写字母表示差异性显著(P<0.05)
Note:Different lowercases in the same row indicated significant differences (P<0.05).
2.2海马齿的生长与C、N、P含量由表6可知,5月海马齿最长根均值已达到26.23 mm,且在7~9月长势最好,可能与温度及水体营养盐有关。湿重、茎粗、茎长、茎节数均表现出逐步增长趋势。在11月出现枯萎掉叶现象,叶片数较9月有所下降。
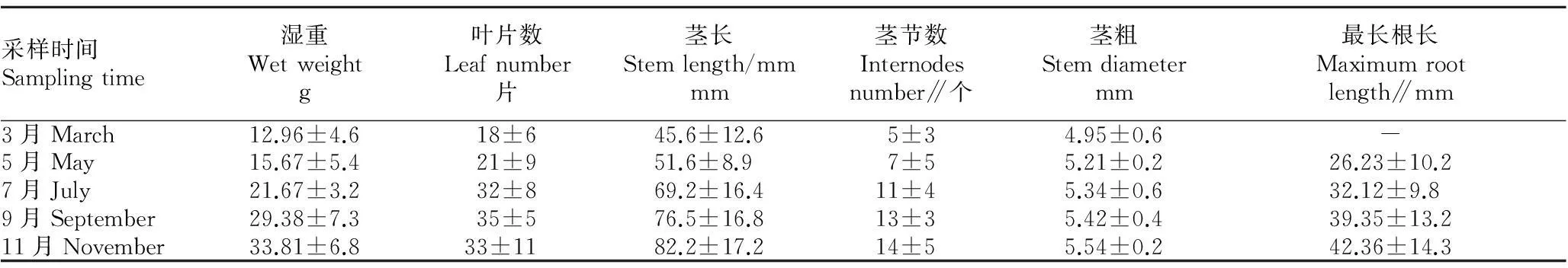
表6 2015年3~11月单株海马齿生长指标
由表7可知,海马齿各部分的生物量均随着时间的推移而增长。
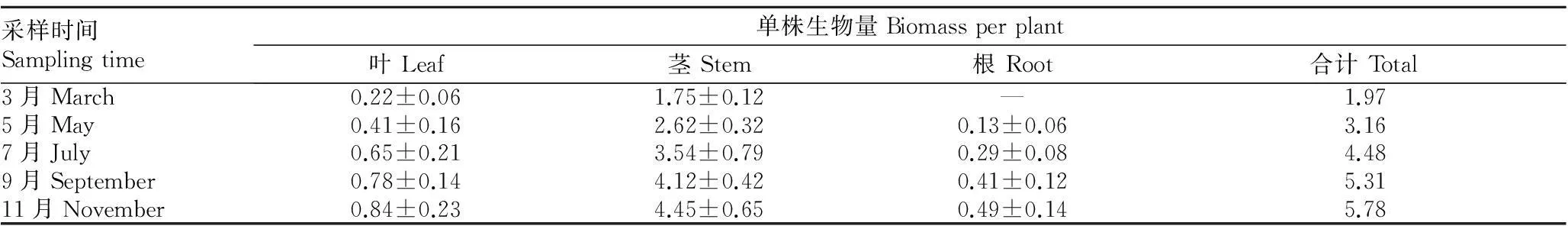
表7 2015年3~11月单株海马齿各部分生物量
由表8可知,海马齿各部分的C、N、P含量随着季节有所变化。在分析海马齿各部位的C、N、P积累量与生物量的相关性发现,C、N、P积累量与生物量正向相关(P<0.05)。
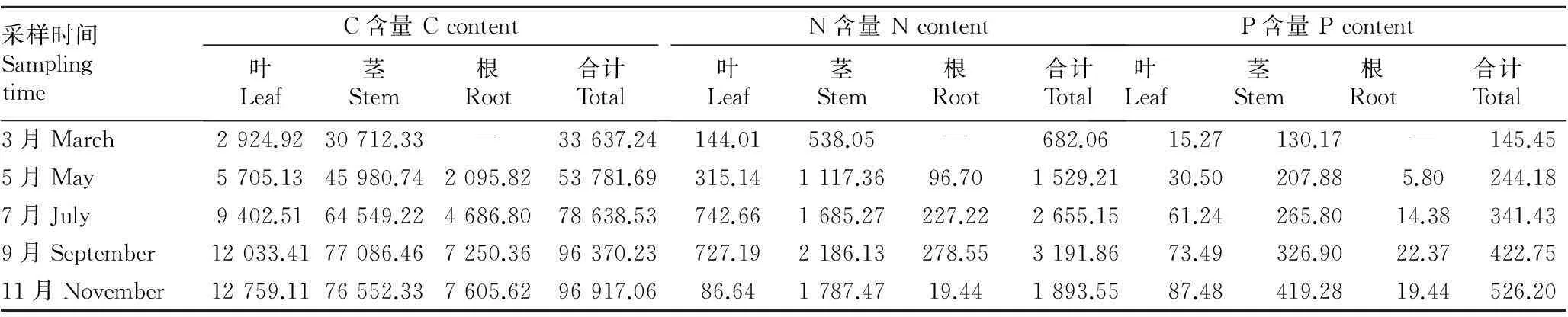
表8 2015年3~11月海马齿不同部位的C、N、P含量
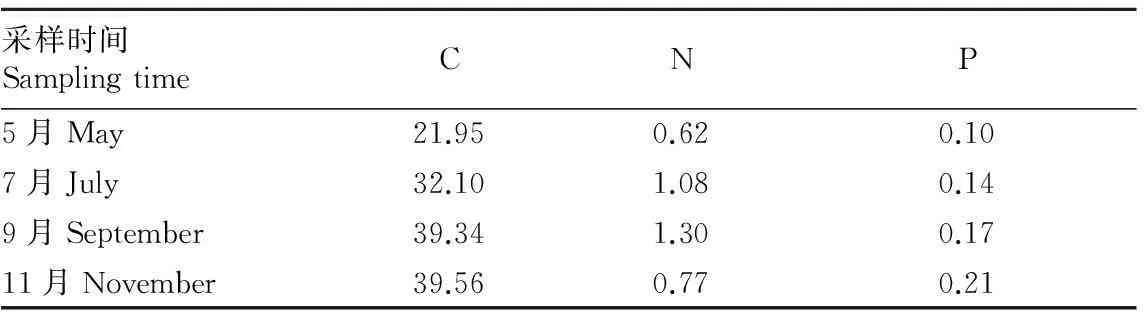
由表8可知,随着时间的推移,C含量呈上升趋势,从3月的33 637.24 g上升至9月的96 370.23 g;而N含量在11月有所降低,P含量呈上升趋势。由表9可知,5~11月C、N、P储量的变化趋势与C、N、P含量相同。
表92015年5~11月海马齿C、N、P的储量
Table 9The C,N and P storages ofSesuviumportulacastrumfrom March to November 2015
g/m2
2.3沉积物-上覆水N、P通量与底泥C、N、P含量由表10可知,采样时间内各区域的孔隙度变化不大,对照区的孔隙度大于试验区,且无齿区大于有齿区。
表102015年5~11月对照区与试验区沉积物孔隙度(φ)比较
Table 10Comparison of the sediment porosity of test region and control region from March to November 2015
由表11可知,对照区的C、N、P含量显著大于试验区(P<0.05),试验区有齿区和无齿区相差不大。试验区有海马齿浮床的区域底泥C/N为10.0,C/P为5.7;无海马齿浮床区域底泥C/N为9.6,C/P为5.1;对照区的底泥C/N为9.1,C/P为5.44。

表11 对照区与试验区沉积物C、N、P含量比较
注:同列不同小写字母表示差异性显著(P<0.05)。
Note:Different lowercases in the same row indicated significant differences (P<0.05).
从图4可见,对照区营养盐的通量均大于试验区。在试验期间,PO43-和NH4+的通量为正值,表现为由沉积物向上覆水扩散;NO3-和NO2-的通量值为负值,说明由上覆水向沉积物迁移。在不同季节,各沉积物-上覆水营养盐通量表现不同变化趋势。对照区PO43-的通量表现为3月下降至5月的0.26 mmol/(m2·d)后上升,最后下降至11月的0.20 mmol/(m2·d);试验区也表现相似趋势。NH4+的通量有海马齿和无海马齿区域3、5月变化不大,然后逐步增加,11月上升至1.86和2.97 mmol/(m2·d);对照区呈现逐步上升趋势。对照区NO3-和NO2-的通量表现为先增后减的趋势,最大值出现在9月(-3.60和-5.20 mol/(m2·d))。试验区NO2-的通量表现为先降后增再降的趋势,而试验区NO3-的通量表现为先升后降。
3讨论
3.1海马齿的生长及C、N、P的含量海马齿具有较强环境适应能力,在盐渍和非盐渍条件下均能较好生长,并完成其生活史[10]。此外,海马齿有很强的逆境适应性,能适应高盐干旱环境,自然条件下扦插即可进行繁殖[11],在盐胁迫下,植株生长旺盛,叶片大而肥厚[12]。因海马齿具有良好的耐盐特性,成为修复海水环境的首选植物。张艳琳等[13]研究发现,全淡水培养条件下,植株生长旺盛,茎细且长,叶片较薄呈嫩绿色,根分枝多且细长;海水比例上升后,海马齿能正常生长,但表现为茎变粗而短,叶片变厚,叶片肉质化程度加重,其干物质的积累和水分含量无明显变化。Messedi等[14-15]研究表明,海马齿在400 mmol/L NaCl溶液中能够正常生长,NaCl浓度达600 mmol/L以上时,海马齿生长受到明显抑制,植株干重迅速降低。Vinayak等[16]研究表明,200 mmol/L为海马齿最适生长的盐浓度。笔者研究表明,海水养殖塘盐度变化范围为12‰~18‰,海马齿生长良好,茎长较长,叶片较多,根系庞杂。2015年3~5月,雨水较多,盐度下降,茎粗变化相对较小。9~11月,水体盐度上升,茎粗变化相对较大,根长变化较小。窦碧霞[17]对不同盐度条件下海马齿的生长适应性及适宜栽培盐度进行研究,结果表明,盐度为0~20‰时,海马齿能快速生长,根系繁盛,分枝多且强壮,最佳生长盐度为10‰;当盐度超过20‰时,海马齿生长逐渐受到限制,随着水体盐度升高,茎周变粗,茎节长变短,叶片肉质化加重,存活率也降低;盐度到达35‰时,表现为生长被严重抑制,存活率较低。
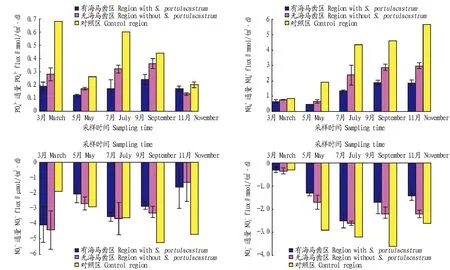
图4 2015年3~11月对照区与试验区N、P营养盐通量比较Fig.4 Comparison of nitrogen and phosphorus nutrient flux of test region and control region from March to November 2015
N是植物生长、发育和繁殖需要的基本物质,在植物生命活动中具有重要作用;N是组成蛋白质的主要元素,占蛋白质总量的 16%~18%,而蛋白质是植物体内叶绿素、核酸、植物激素等组成部分。P是构成植物体的重要组成元素,对促进植物的生长发育和生理代谢具有重要作用。一般,P在植物体分布情况为幼嫩器官大于衰老器官,叶片大于根系,根系大于茎秆。植物的C、N、P储量主要取决于生物量和C含量。浮床植物海马齿在生长过程中,通过光合作用固定空气中的CO2,而且吸收水体中的N、P。随着海马齿生物量的不断增加,海马齿中的C、N、P含量亦不断积累。笔者研究表明,海马齿的C、N、P储量逐渐变大,且与生物量正向相关。邵学新等[18]研究了杭州湾潮滩湿地植物C、N、P储量特征,对植物生物量、C、N、P含量及储量的季节动态进行分析,结果表明,湿地植物地上部POC含量全年维持相对稳定,N、P含量随植物生长而明显下降;此外,植物C、N、P储量与植物生物量显著正相关。海马齿各部位的C、N、P含量有所差异。阳承胜等[19]研究了叶香蒲(Typhalatifolia)人工湿地系统中叶香蒲、芦苇、茳芏和伴根草4种水生植物的N、P元素含量,结果表明,4种植物体各部位的N、P含量相同,N含量从大到小依次为叶、凋落物、地上茎、地下茎、根, P含量从大到小依次为叶、凋落物、根、地上茎、地下茎。
3.2海马齿生态浮床中水质变化在水污染区域的植物可以通过自身及其根际微生物的代谢活动及生长繁殖吸收、积累或降解水体中的各种污染物,如N、P营养盐、有机物及重金属等,对水体起到净化作用,从而达到修复环境的效果[20]。该研究中,试验区的DO浓度明显大于对照区,透明度增加,悬浮颗粒物含量较低,主要污染物浓度也更低。水体悬浮颗粒物在植物根系的作用下浓度会有所降低,浮床植物能有效提高水体透明度。林永青等[21]研究表明,海马齿根系对海水中的悬浮颗粒物具有较好的清除效果,且能使水体悬浮颗粒物浓度提前达到稳定水平。窦碧霞等[22]在室内模拟海水养殖系统,发现海马齿浮床养殖系统持续处理2个月,对TN的移除率达到 11%~25%,对TP的移除率为 41%~68%。张志英等[23]利用海马齿浮床对厦门某富营养化湖水进行净化,发现浮床覆盖率为30%时,移除量分别为1.11、0.19 g/m2。
3.3海马齿生态浮床池塘中沉积物-上覆水的营养盐通量沉积物-水界面营养盐扩散通量受分子扩散的影响,且受界面附近的氧化还原环境、水温、DO浓度、生物扰动、水动力条件等因素制约[24]。该研究结果表明,2015年5~11月沉积物-上覆水营养盐通量表现为对照区大于试验区,试验区PO43-通量在7、9月较大,而7、9月pH为弱碱性,水体DO与PO43-通量呈负向相关(P<0.05)。在氧化条件下,Fe3+会与PO43-结合形成沉淀,且因水体pH为弱碱性,会形成Fe(OH)3;以胶体形式出现的Fe(OH)3会吸附水中游离的P,从而抑制P的释放[25]。此外,该研究试验区域浮床上的海马齿不断生长,吸收水体中的P盐,水体中的P浓度得到控制,导致沉积物中的PO43-不断向上覆水扩散。试验区的NO2-和NO3-为负值,即从上覆水迁移至沉积物,均在7月达最大值。NO2-和NO3-在沉积物-水界面的扩散情况是由沉积物间隙水和上覆水之间的NO2-和NO3-浓度梯度决定,而硝化与反硝化作用决定两者浓度[26]。温度可以通过影响硝化和反硝化作用而间接影响沉积物-上覆水的硝酸盐和亚硝酸盐通量。水温高时,硝化速率和反硝化速率会受到抑制,而硝酸盐还原为铵的速率变化不大[27]。这种还原为铵所消耗NO2--N 的速率可达到硝化作用产生NO2--N 速率的几倍,该现象将会消耗沉积物内原有的NO3-,甚至需要上覆水的NO3-进行补充[28]。此外,试验期间水体温度较高,鱼类与其他生物排出较多N、P营养盐。综合以上因素,表现出NO2-和NO3-向沉积物迁移。试验区NH4+通量呈上升趋势且为正值,即由沉积物向上覆水扩散。对鱼类的研究表明,在一定温度范围内,鱼类的代谢率随着温度的升高而增大,超过某一温度时其代谢率反而降低[29]。笔者通过研究表明,水体温度较高,生物的排氨率较高。浮游植物对NH4+-N的吸收率远远小于氨排泄及形成速率。在温度较高造成硝化速率和反硝化速率均受到抑制的情况下,其异化为氨进程产生较多的NH4+-N,界面出现NH4+-N 高通量的释放。
在养殖池塘中,鱼类及其他生物的摄食、排泄与浮游植物数量变化将影响营养盐通量,此外,沉积物的结构、底栖生物扰动、微生物繁殖生长等因素也会制约营养盐通量的变化。总体而言,营养盐的交换通量是各种物理、化学及生物作用的综合结果,导致在不同养殖模式下池塘营养盐通量规律表现不一。郭永坚等[27]研究了草鱼不同养殖模式试验围隔内沉积物-界面营养盐通量,结果表明:在不同养殖模式下,养殖中后期的NO3-、NH4+-N通量、无机磷通量表现为差异显著(P<0.05)。黄小平等[30]研究表明,在鱼类网箱养殖区域,营养盐由沉积物向海水界面的交换通量明显提高,导致养殖海域成为污染源。
3.4沉积物C、N、P含量变化一般而言,在养殖池塘中P主要以固态形式沉积于底泥中,而N则多吸附于悬浮物或以溶解态形式存在于水体中。该试验中,试验区域的沉积物C、N、P含量均小于对照区(P<0.05),但试验区沉积物C、N含量差异性不明显(P>0.05),而P含量差异性明显(P<0.05),说明海马齿浮床可以降低P沉积于底泥。海马齿通过对悬浮物质的吸附于去除,使水体向底泥沉积的颗粒物减少,对沉积物产生影响。Nickell等[31]研究表明,较低的C/N或C/P比表示底泥不稳定,有机质含量较高。试验中,相比对照区,试验区C/P或C/N较大。这说明试验区有机物含量较低且稳定。
4结论
(1)试验区与对照区相比,DO浓度更大,透明度增加,主要的污染物浓度也更低。结果表明,海马齿浮床对P、NH4-N有显著的去除作用(P<0.05),海马齿浮床区域COD含量较对照点明显降低(P<0.05)。叶绿素a含量、TPM、POM均表现出试验区较对照区小(P<0.05),说明海马齿浮床对水体的颗粒有机物有去除作用。
(2)通过计算,2015年5~11月浮床区海马齿的C储量为21.95、32.10、39.34、39.56 g/m2;N储量为0.62、1.08、1.30、0.77 g/m2;P储量为0.10、0.14、0.17、0.21 g/m2。
(3)对照区营养盐通量均大于试验区。PO43-和NH4+的通量为正值,表现为由沉积物向上覆水扩散;NO3-和NO2-的通量值为负值,说明由上覆水向沉积物迁移。在不同季节,各沉积物-上覆水营养盐通量表现不同变化趋势。
参考文献
[1] 窦碧霞,黄建荣,李连春,等.海马齿对海水养殖系统中氮、磷的移除效果研究[J].水生态学杂志,2011,32(5):94-99.
[2] 岳晓彩,饶科,熊安安,等.生态浮床原位修复对海水养殖池塘底栖动物群落结构的影响[J].水生态学杂志,2014,35(1):22-27.
[3] 唐昌林.中国植物志[M].北京:科学出版社,1996:30-32.
[4] GRASSHOFF K,ERHARDT M,KREMLING K,et al.Methods of seawater analysis[M]. Weiheim,Germany:Verlag Chemie,1983.
[5] ZHOU Y,ZHANG F S,YAH S,et al.Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters,aquatic organismand sediment by ignition method[J].Water research,2003,37:3875-3882.
[6] 中华人民共和国林业部科技司.林业标准汇编(三)[M].北京:中国林业出版社,1991.
[7] 顾凯平,张坤,张丽霞.森林碳汇计量方法的研究[J].南京林业大学学报(自然科学版),2008,32(5):105-109.
[8] 北京林业大学.土壤理化分析实验指导书[M].北京:北京林业大学出版社,2002.
[9] LI Y,GREGROY S.Diffusion of ions in a water and deep-sea sediment[J].Geoclumica et cosmochimica acta,1974,38:703-714.
[10] GHANYA T,MESSEDI D,ABDELLY C,et al.Cadmium effects on growth an mineral nutrition of two halophytes:SesuviumportulacastrumandMesembryanthemumcrystallinum[J].Journal of plant physiology,2005,162:1133-1140.
[11] 段瑞军,胡新文,符少萍,等.盐胁迫下海马齿叶肉细胞超微结构观察[J]. 热带作物学报,2010,31(3):397-403.
[12] LOKHANDE V H,NIKAM T D,SUPRASANNA P.Biochemical,physiological and growth changes in response to salinity in callus cultures ofSesuviumportulacastrumL.[J].Plant Cell Tiss Organ Cult,2010,102:17-25.
[13] 张艳琳,范伟,蔡元保,等.海马齿对不同比例淡海水组培的生长和生理响应[J].西北植物学报,2009,29(6):1240-1245.
[14] MESSDDI D,LABIDI N,GRIGNON G,et al.Limits imposed by salt to the growth of the halophyteSesuviumportulacastrum[J].Plant nutrition soil science,2004,167:720-725.
[15] MESSEDDI D,SLEIMI N,ABDELLY C.Salt tolerance inSesuviumportulacastrum[J].Plant nutrition-food security and sustainability of agro-ecosystems,2001,92(6):406-407.
[16] VINAYAK H L,TUKARAM D N,VIKAS Y P,et al.Effects of optimal and supra-optimal salinity stress on antioxidative defence,osmolytes and in vitro growth responses inSesuviumportulacastrumL.[J].Plant Cell Tiss Organ Cult,2011,104:41-49.
[17] 窦碧霞.海马齿处理海水养殖污水及其营养价值综合研究[D].广州:中山大学,2012.
[18] 邵学新,李文华,吴明,等.杭州湾潮滩湿地 3 种优势植物碳氮磷储量特征研究[J].环境科学,2013,34(9):3451-3457.
[19] 阳承胜,蓝崇钰,张干.N、P、K在宽叶香蒲人工湿地系统中的分布与积累[J].深圳大学学报(理工版),2005,22(3):264-268.
[20] DIETZ A C,SCHNOOR J L.Advances in phytoremediation[J].Environ health perspect,2001,109(S1):163-168.
[21] 林永青,吴佳鑫,郑新庆,等.浮床栽培海马齿对海水中悬浮颗粒物清除作用的实验研究[J].厦门大学学报(自然科学版),2011,50(5):909-914.
[22] 窦碧霞,黄建荣,李连春,等.海马齿对海水养殖系统中氮、磷的移除效果研究[J].水生态学杂志,2011,32(5):94-99.
[23] 张志英,黄凌风,姜丹,等.浮床种植海马齿对富营养化海水氮、磷移除能力的初步研究[C]//中国环境科学学会.中国环境科学学会2009年学术年会论文集(第二卷).北京:北京航空航天大学出版社,2009:50-54.
[24] 黄小平,郭芳,岳维忠.南海北部沉积物间隙水中营养盐研究[J].热带海洋学报,2006,25(5):43-48.
[25] 卢光明,乐观宗,钟明杰,等.锯缘青蟹养殖池塘中沉积物磷释放的初步研究[J].中国水产科学,2010,17(5):1115-1120.
[26] 赵志梅,张雷,郑丙辉,等.渤海湾沉积物中氮、磷的空间分布特征研究[J].西北农林科技大学学报(自然科学版),2005,33(4):107-111.
[27] 郭永坚,王芳,董双林,等.草鱼不同混养模式下围隔底泥反硝化、硝化和氨化速率[J].中国水产科学,2011,18(4):857-866.
[28] GARDNER W S,MCCARTHY M J,SOBOLEV D.Nitrogen fixation and dissimilatory nitrate reduction to ammonium (DNRA) support nitrogen dynamics in Texas estuaries[J] .Limnology and oceanography,2006,51(1):558-568.
[29] 孙德文,詹勇,许梓荣.环境温度在鱼类养殖业中的重要作用研究[J].水产养殖,2003,24(2):36-39.
[30] 黄小平,郭芳,黄道建.大亚湾典型养殖区沉积物-海水界面营养盐扩散通量及其环境意义[J].海洋环境科学,2008,27(S2):6-12.
[31] NICKELL L A,BLACK K D,HUGHES D J,et al,Bioturbation,sediment fluxes and benthic community structure around a salmon cage farm in Loch Creran,Scotland [J].Exp Mar Biol Ecol,2003,285/286:221-233.
基金项目海洋公益性行业科研专项(201305021);广东省省级科技计划项目(2015B020235006);2011~2012年中央分成海域使用金支出项目(环保类)。
作者简介袁星(1989- ),男,江西赣州人,硕士研究生,研究方向:水环境修复。*通讯作者,教授,硕士生导师,从事水生生物学研究。
收稿日期2016-04-01
中图分类号S 181
文献标识码A
文章编号0517-6611(2016)14-069-07
Restoration ofSesuviumportulacastrumEcological Floating Bed to Mariculture Pond
YUAN Xing,LIN Yan-yan,HUANG Jian-ron,LI Zu-fu*
(School of Life Science,Sun Yat-Sen University,Guangzhou,Guangdong 510275)
Abstract[Objective] To research the restoration effects of Sesuvium portulacastrum ecological floating bed to mariculture pond.[Method] Periodic monitoring under natural condition was adopted.According to the characteristics of geographic shapes of mariculture pond and the distribution characteristics of S.portulacastrum ecological floating bed,we designed both test region and control region.Among them,test region had S.portulacastrum region and region without S.portulacastrum.With traditional fish pond as the control,the change laws of water N and P nutrient salt,S.portulacastrum growth,sediment-water layer flux were researched under the method of in situ ecological restoration method.[Result] Compared with the control region,the test region of S.portulacastrum ecological floating bed had greater dissolved oxygen and transparency,and lower concentration of main pollutants.Compared with the control region,S.portulacastrum ecological floating bed showed significant removal action to phosphorus,nitrogen and ammonia (P<0.05).COD in S.portulacastrum ecological floating bed region reduced significantly compared with control region.Chlorophyll a content,TPM and POM in test region were all smaller than those in control region (P<0.05),showing that S.portulacastrum ecological floating bed had significant removal action to particulate organic matter in water body.C,N and P storages of S.portulacastrum in the ecological floating bed were 39.56 ,0.77 and 0.21 g/m2 in November.[Conclusion] S.portulacastrum ecological floating bed improves the ecological environment of culture area.
Key wordsSesuvium portulacastrum ecological floating bed; Ecological restoration; Nutrient fluxes; Sediment

