解脂耶氏酵母不对称还原苯乙酮合成(R)-苯乙醇
许芹,王丹,徐晴,李霜(南京工业大学生物与制药工程学院,江苏 南京 210009)
解脂耶氏酵母不对称还原苯乙酮合成(R)-苯乙醇
许芹,王丹,徐晴,李霜
(南京工业大学生物与制药工程学院,江苏 南京 210009)
摘要:为了提高解脂耶氏酵母对苯乙酮的催化效率,以20mmol/L的苯乙酮和苯乙醇为筛选压力,采用紫外诱变获得突变株,优化了反应体系参数,如温度、pH值、辅助底物、有机溶剂(如甲苯、己烷、辛烷、DMF、DMSO等)以及离子液体(1-丁基-3-甲基咪唑六氟磷酸盐,BMIM·PF6)等对催化体系的影响。结果表明,利用解脂耶氏酵母突变株全细胞催化苯乙酮(20mmol/L)合成(R)-苯乙醇,转化率76%,e.e.达99.2%。优化后的反应体系如下:最适辅助底物为葡萄糖,反应温度30℃,pH=7.0,30%(体积分数)疏水性离子液体BMIM·PF6。当利用解脂耶氏酵母突变株的发酵液为催化体系,向反应体系中添加30%(体积分数) BMIM·PF6,以60mmol/L苯乙酮为底物,反应36h,(R)-苯乙醇的转化率达95%,e.e.值达97%。解脂耶氏酵母突变株全细胞催化苯乙酮不对称还原反应,在高底物浓度、高转化率以及高光学纯度等方面具有突出表现。
关键词:解脂耶氏酵母; 苯乙酮; (R)-苯乙醇; 生物催化;酶;优化
第一作者:许芹(1991—),女,硕士研究生,主要从事生物催化研究。
联系人:李霜,教授,主要从事生物催化与生物转化研究。E-mail lishuang@njtech.edu.cn。
含有芳香基的手性醇是许多手性药物合成的关键手性模块和平台化合物,在手性合成中占有重要的地位;而前手性芳香酮的不对称催化还原是制备光学活性醇的一个重要方法[1-2]。微生物细胞中含有许多具有立体选择性的酶,使用全细胞催化不对称合成反应不但可以省去繁杂的酶分离和纯化步骤,而且在催化反应过程中细胞可以通过代谢廉价的葡萄糖等辅助底物实现辅酶再生,同时所有的酶和辅酶因被保护在天然的细胞环境中,不易失活,有利于生物催化反应的进行[3-4]。
解脂耶氏酵母是一种非常规性酵母,可使用油脂作为唯一碳源[5]。解脂耶氏酵母在羰基不对称还原反应中的应用只有少数报道。LAGOS等[6]通过筛选得到解脂耶氏酵母CECT 1240,可将1-芳氧基-3-氯-2-丙酮还原为光学纯度为99%的(S)-醇;而FANTIN等[7]则研究了来自不同环境中的解脂耶氏酵母催化各种前手性羰基化合物。
苯乙酮是筛选不对称还原立体选择性酶的模式底物,利用微生物细胞催化苯乙酮不对称还原反应得到光学纯的苯乙醇,无论从经济角度还是学术角度考虑,都具有广泛的应用前景和潜在的巨大经济效益。由于底物苯乙酮对细胞具有毒性,过低的底物浓度(<10mmol/L)成为生物催化反应的瓶颈之一。
本文通过将解脂耶氏酵母ACA-DC 50109进行紫外诱变来提高对苯乙酮的耐受性和催化效率。为了进一步提高产物光学纯度和转化率,优化了反应体系,如温度、pH值、辅助底物和反应时间;进一步考察了添加有机溶剂(如甲苯、己烷、辛烷、DMF、DMSO等)以及离子液体(1-丁基-3-甲基咪唑六氟磷酸盐,BMIM·PF6)对催化体系的影响。
1 材料与方法
1.1 材料
1.1.1 菌种及试剂
解脂耶氏酵母ACA-DC 50109[5]由希腊派图拉斯大学George Aggelis教授馈赠。底物苯乙酮、(R)-苯乙醇和(S)-苯乙醇标准品以及各种苯乙酮的衍生物均购自Sigma-Aldrich公司。离子液体BMIM·PF6购自Aladdin公司。其他试剂均为分析纯。
1.1.2 产酶培养基
液体培养基组成:葡萄糖45g/L,酵母粉13g/L,NH4Cl 2.5g/L,K2HPO41.0g/L,MgSO4·7H2O 0.4g/L,KH2PO41.0g/L,Fe2(SO4)30.01g/L,ZnSO40.01g/L,苯乙酮(诱导剂)0.01g/L。固体培养基:在液体培养基中加入15g/L的琼脂即可。
1.2 紫外诱变以及突变菌株筛选
解脂耶氏酵母ACA-DC 50109在15W的紫外线下照射30s,再将经过紫外照射的酵母接种到含有20mmol/L苯乙酮和20mmol/L苯乙醇的固体培养基中,在避光条件下30℃培养两天,将得到的单菌落进行分离并研究催化苯乙酮效率。
1.3 催化苯乙酮的不对称还原反应
优化反应体系:将培养36h的解脂耶氏酵母ACA-DC 50109-H菌液离心分离,用0.85%的生理盐水洗涤两次,将洗涤后的菌体分散于磷酸缓冲液(pH=7.0)中。20mL还原反应体系中添加0.2g湿菌体,加入一定量的底物苯乙酮,放入摇床(150r/min)中反应36h。
发酵液反应体系:解脂耶氏酵母培养36h后,向发酵后的培养基(20mL)中投加一定量的底物苯乙酮,放入摇床(150r/min)中反应36h。
1.4 分析方法
反应结束后,用1倍体积的乙酸乙酯萃取,用气相色谱分析,安捷伦6890N气相色谱仪,色谱柱:Supelco Bata DEXTM120(30m×0.25mm×0.25μm)。色谱条件为:进样量1μL,进样口温度200℃,FID检测器,检测器温度250℃,采用程序升温:125℃保持5min,以10℃/min升温至165℃,保持1min,载气N2流速为25mL/min,燃烧气H2流速为30mL/min,空气流速为300mL/min,苯乙酮出峰时间7.032min,(R)-苯乙醇出峰时间为8.751min,(S)-苯乙醇出峰时间为8.923min。
2 结果与讨论
2.1 解脂耶氏酵母ACA-DC 50109的突变菌株筛选
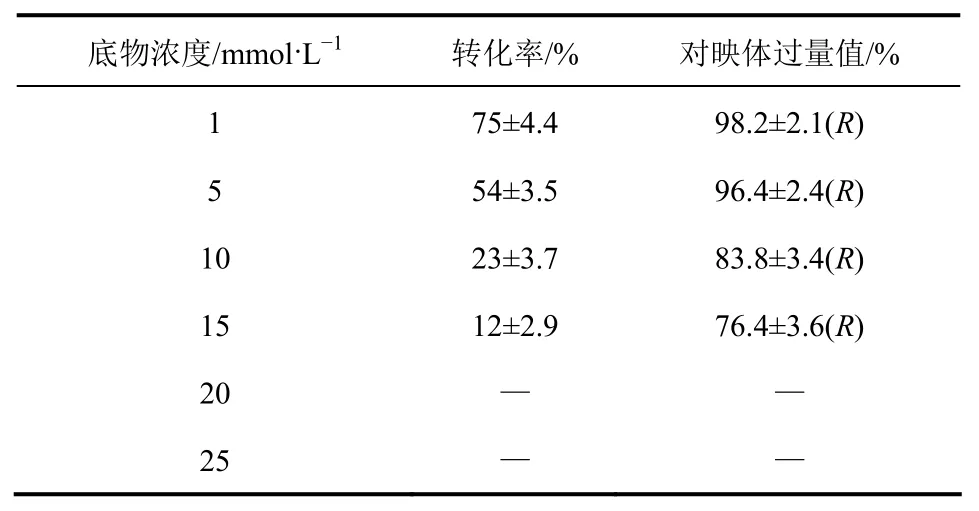
表1 底物浓度对解脂耶氏酵母ACA-DC 50109还原反应的影响
首先,考察了野生解脂耶氏酵母ACA-DC 50109对苯乙酮的催化能力。从表1中可以看出,野生解脂耶氏酵母ACA-DC 50109对苯乙酮的催化能力较低,当底物为1mmol/L时,转化率为75%,而当底物达到15mmol/L时,转化率只有12%。但是,对映体过量值(e.e.)值相对较高。
对于酵母菌而言,酮还原酶通常以组成型的形式存在于细胞,往培养基中添加少量的苯乙酮可以促进产酶。但是,苯乙酮的细胞毒性较大,2mmol/L的苯乙酮即可抑制细胞的生长。因此,生物催化不对称还原苯乙酮的反应体系中,要想获得较高的转化率,底物浓度较低(1~10mmol/L)[8],细胞用量极大(150g/L)[9],或者使用双相反应体系[10]。
为了提高解脂耶氏酵母ACA-DC 50109的催化能力和底物耐受性,将野生菌进行紫外诱变,以20mmol/L苯乙酮和20mmol/L外消旋苯乙醇为筛选压力,最终获得10株突变菌。以20mmol/L苯乙酮为底物,表2中,大部分突变菌株都保留了较高的选择性,其中突变株H的转化率和选择性都最高,分别为76%和99.2%。因此,突变株H继续应用于后面的研究。

表2 10株突变株的催化能力
2.2 反应体系的优化
2.2.1 pH值对反应的影响
生物催化体系的pH值不仅影响酶的活性和立体选择性[11],还影响到细胞内辅酶再生,从而影响生物催化剂的转化表现[12]。因此,考察了体系pH值对突变株H立体选择性和产物得率的影响。以20mmol/L底物反应36h后,从图1可知,在pH=7.0~8.0范围内,反应的转化率和选择性都具有优势,反应pH=7.0时,转化率为80%,e.e.值为93%,两者均达到最大。
2.2.2 温度对反应的影响
反应温度通常影响催化剂的选择性和稳定性[13-14],为了确定突变株H的最适转化温度,考察了当pH值为7.0时,反应温度(25~50℃)对反应的影响。从图2中可知,以20mmol/L苯乙酮为底物,30℃时转化率和e.e.值均最高;30℃以下,酶活不足;超过30℃,酶迅速失活,转化率和e.e.值均迅速下降。
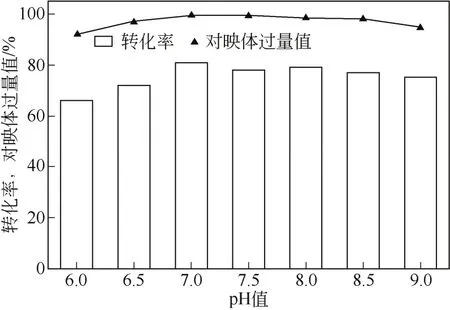
图1 pH值对反应的影响(反应条件:20mL反应缓冲,细胞量0.2g,苯乙酮浓度20mmol/L,葡萄糖10mmol/L,30℃,150r/min,36h)
根据多点依附的理论,前手性碳周围的3个基团必需和酶相互作用,使底物被牢牢地控制在一个不对称活性部位上,只有一个面对着攻击基团,从而得到某一对映体产物,即高e.e.值的产物,而随着温度的升高,这种酶与底物基团的结合会逐步破坏,e.e.下降,温度低时,分子运动速度变慢,影响酶活力的发挥,e.e.值也不高[15],因此,较适合的反应温度为30℃。
2.2.3 辅助底物的选择
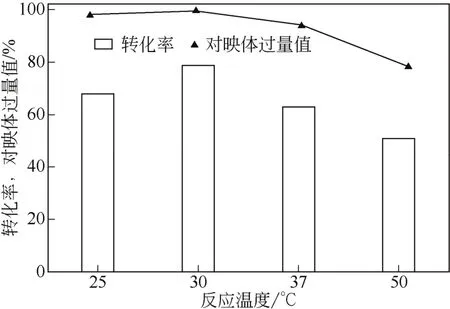
图2 温度对反应的影响(反应条件:20mL反应缓冲,细胞量0.2g,pH=7.0,苯乙酮浓度20mmol/L,不同温度,150r/min,36h,葡萄糖10mmol/L)
酵母细胞内含有NADPH和NADH,但其数量有限[16],为使生物催化反应能够顺利进行,通常需要向反应介质内添加一定量辅助底物[17],常见的辅助底物为糖类和醇类化合物[18]。本实验中以葡萄糖、蔗糖、柠檬酸、异丙醇、乙醇和丙三醇为辅助底物研究了添加辅助底物对反应的影响(表3)。以30mmol/L苯乙酮为底物,反应36h后,葡萄糖和蔗糖为辅助底物均可提高反应的转化率,其中葡萄糖提高转化率最佳,其转化率为62%,而e.e.值只有95.9%,低于空白98.6%,虽然蔗糖同样提高转化率为54%,但是e.e.值只有87.4%,为此选择葡萄糖为辅助底物。
鉴于突变株H产酶发酵36h时细胞生物量(湿重)约25g/L,同时发酵液中的残余葡萄糖浓度为5~8g/L(27~44mmol/L),为了省略收集细胞的繁琐操作,并充分利用发酵液残糖,此后的研究中可将产酶培养基作为反应体系,添加底物苯乙酮及离子液体等考察反应进程。
2.2.4 底物投加量对转化率和e.e.值的影响
由表4可知,在5mmol/L和10mmol/L的低底物浓度下,转化率为100%,且e.e.值为95%以上。但随着底物浓度的增加,转化率逐渐下降,底物浓度达60mmol/L时,e.e.值开始大幅下降。
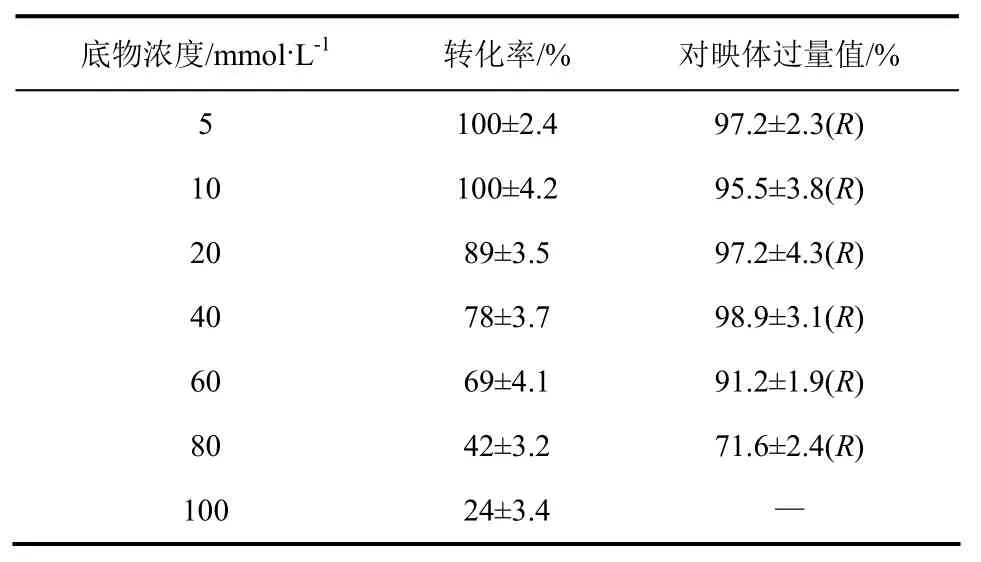
表4 底物投加量对反应的影响
当酵母细胞的浓度一定时,其酶活性部位所能接纳的底物量也就确定了,因此酵母浓度一定时底物转化成产物的量基本不变,但随着底物浓度的增加,底物对酶产生了抑制作用,底物的转化率下降。当酵母细胞的浓度一定、底物浓度较低时,酶活性部位数目与底物浓度相比较充足,对底物的诱导契合较好,从而得到某一对映体产物,即高e.e.值的产物,但底物浓度增加时,酶活性部位数目不足,对底物的诱导契合不好,羰基的加氢能从底物的两面进行,此时e.e.值下降[19]。
2.3 双相体系反应
2.3.1 有机试剂的选择
从表5可以看出,与未添加有机试剂相比,所选的甲苯、正己烷、辛烷、N,N-二甲基甲酰胺(DMF)和二甲基亚砜(DMSO)这5种有机试剂并没有提高反应的转化率,可能是因为有机溶剂也具有一定的细胞毒性,并引起酶构象变化导致失活而转化率较低。而添加离子液体BMIM·PF6后,转化率和e.e.值均有所提高。这是因为离子液体通常被认为是一种能替代有机溶剂的绿色介质,用其替代有机溶剂与水形成双相反应体系用于微生物细胞催化的生物转化过程,不仅可以减少对环境和产品的污染,还可能提高细胞的活性和稳定性[20]。
2.3.2 离子液体浓度对反应的影响
由表6可知,离子液体和缓冲液的体积比对突变株H催化苯乙酮不对称还原反应产率有明显影响,但是对产物e.e.值的影响较小。当离子液体用量由5%上升到30%,转化率和e.e.值随之增加;而继续离子液体用量,会导致转化率和e.e.值降低。离子液体最适添加体积为30%(体积分数)。
2.4 解脂耶氏酵母突变株H不对称还原苯乙酮
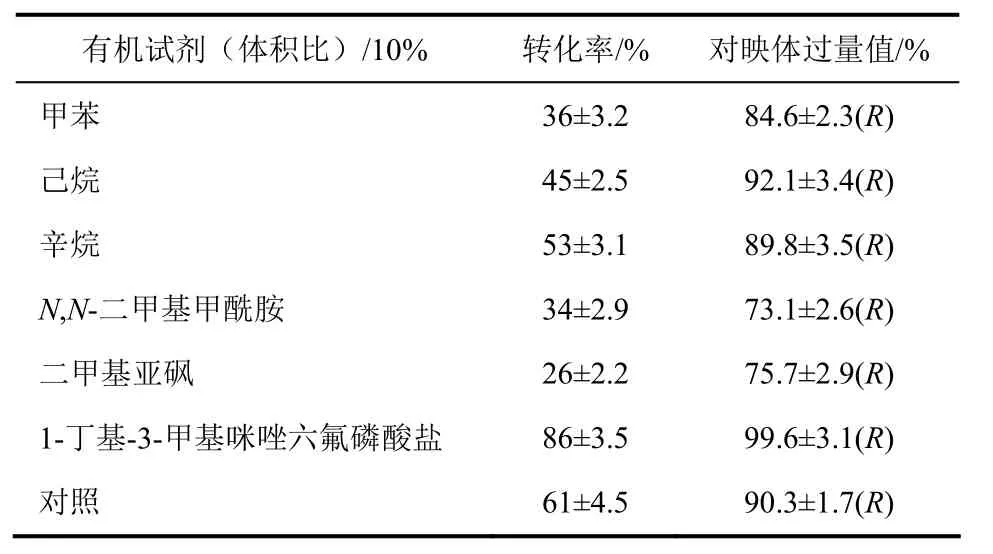
表5 有机溶剂的选择
将30%(体积分数)离子液体BMIM·PF6及60mmol/L苯乙酮直接添加到发酵36h的发酵液(100mL)中,于30℃反应,考察不对称还原的转化过程。
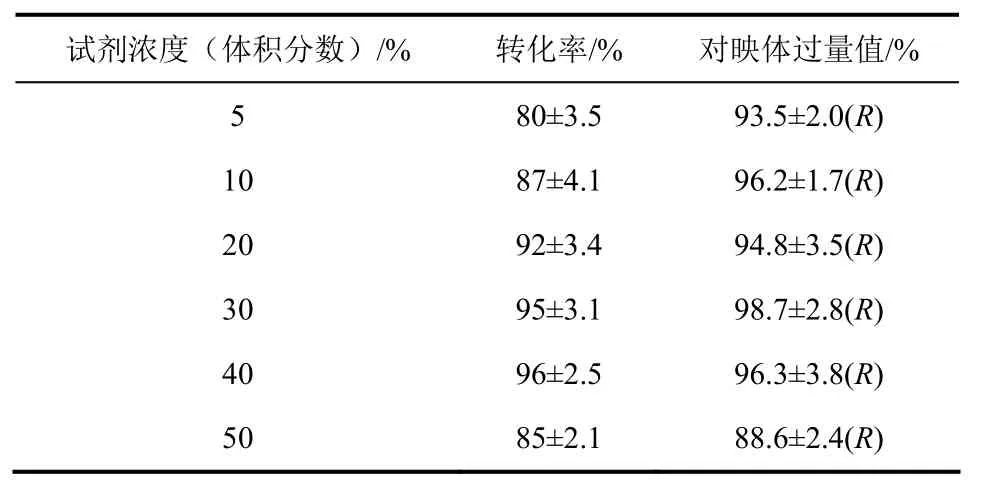
表6 离子液体浓度对反应的影响
由图3可知,在反应6~36h内,转化率由27%增加到95%,e.e.值变化不大。综合时间、转化率和e.e.值三方面因素,确定最佳反应时间为36h。

图3 解脂耶氏酵母-H不对称还原苯乙酮的时间进程(反应条件:100mL发酵液(36h),苯乙酮浓度60mmol/L,BMIM·PF6 30%(体积分数),pH=7.0,30℃,150r/min)
与其他微生物不对称还原苯乙酮相比(表7),将苯乙酮和离子液体直接添加到发酵液中,省略收集细胞的繁琐操作,并充分利用发酵液残糖,既提高底物的上载量(60mmol/L),又得到了较高的立体选择性(97%)。
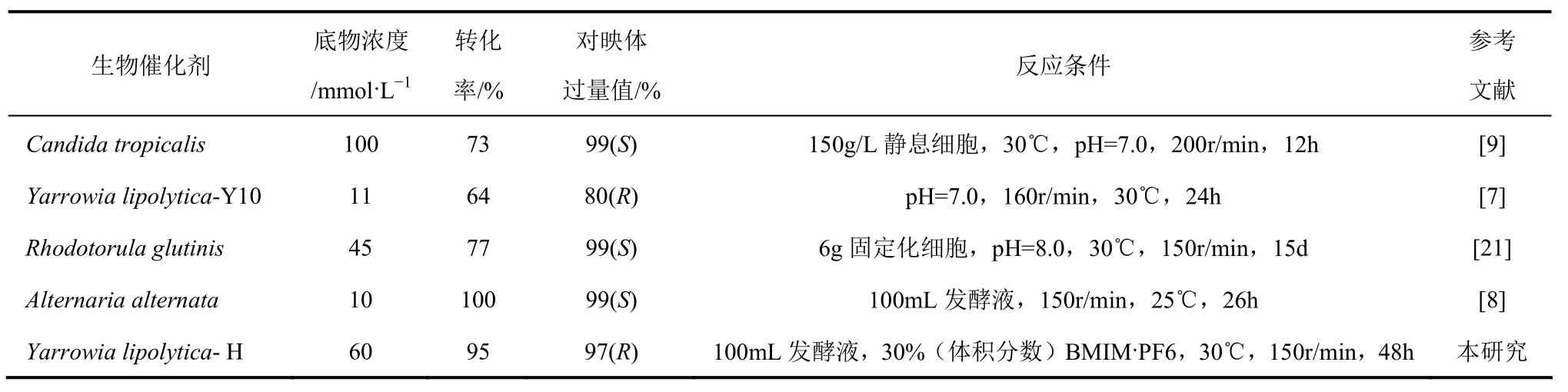
表7 微生物不对称还原苯乙酮的比较
3 结 论
本文通过紫外诱变得到1株解脂耶氏酵母突变株H,通过向解脂耶氏酵母产酶发酵液(20mL)中直接添加30%(体积分数)的离子液体BMIM·PF6 和60mmol/L 苯乙酮底物,30℃下催化反应36h,(R)-苯乙醇的转化率达95%,e.e.值达97%。突变株全细胞催化苯乙酮不对称还原反应,在高底物浓度、高转化率以及高光学纯度产物得率等方面具有突出表现,也为其在工业应用和基础研究领域奠定基础。
参 考 文 献
[1] XU G C,YU H L,SHANG Y P,et al. Enantioselective bioreductive preparation of chiral halohydrins employing two newly identified stereocmpleentary reductase[J]. RSC Advances,2015,5(29):22703-22711.
[2] NI Y,XU J H. Asymmetric reduction of aryl ketones with a new isolate Rhodotorula sp. AS2.2241[J]. Journal of Molecular Catalysis B:Enzymatic,2002,18(4):233-241.
[3] GOLDBERG K,SEHROER K,LUTZ S,et al. Biocatalytic ketone reduction-a powerful tool for the production of chiral alcohols—Part I:processes with isolated enzymes[J]. Applied Microbiology and Biotechnology,2007,76(2):237-248.
[4] ISHIGE T,HONDA K,SHIMIZU S. Whole organism biocatalysis[J]. Current Opinion in Chemical Biology,2005,9(2):174-180.
[5] PAPANIKOLAOU S,AGGELIS G. Yarrowia lipolytica:a model microorganism used for the production of tailor-made lipids[J]. European Journal of Lipid Science and Technology,2010,112(6):639-654.
[6] LAGOS F M,CARBALLEIRA J D,BERMUDEZ J L,et al. Highly stereoselective reduction of haloketones using three new yeasts:Application to the synthesis of (S)-adrenergic β-blockers related to propranolol[J]. Tetrahedron:Asymmetry,2004,15(5):763-770.
[7] FANTIN G,FOGANGNOLO,GIOVANNINI P P,et al. Anti-Prelog microbial reduction of prochiral carbonyl compounds[J]. Tetrahedrom,1996,52(10):3547-3552.
[8] KURBANOGLU E B,ZILBEYAZ K,KURBANOGLUC N I,et al. Highly enantioselective reduction of acetophenone by locally isolated Alternaria alternata using ram horn peptone[J]. Tetrahedron:Asymmetry,2007,18(13):1529-1532.
[9] SONI P,BANERJEE U C. Enantioselective reduction of acetophenone and its derivatives with a new yeast isolate Candida tropicalis PBR-2 MTCC 5158[J]. Journal of Biotechnology,2006,1 (1):80-85.
[10] 杨忠华,曾嵘,吴高明,等. 水-有机溶剂两相体系中面包酵母不对称还原苯乙酮合成手性苯乙醇的研究[J]. 高校化学工程学报,2009,23(3):450-454.
[11] XIAO M T,YE J,ZHANG Y W,et al. Reaction characteristics of asymmetric synthesis of (2S,5S)-2,5-hexanediol catalyzed with baker’s yeast number 6[J]. Chinese Journal of Chemical Engineering,2009,17(3):493-499.
[12] XIAO M T,HUANG Y Y,SHI X A,et al. Bioreduction of phenylglyoxylic acid to R-(-)-mandelic acid by Saccharomyces cerevisiae FD11b[J]. Enzyme and Microbial Technology,2005,37 (6):589-596.
[13] POLIZZI K M,BOMMARIUS A S,BROERING J M,et al. Stability of biocatalysts[J]. Current Opinion in Chemical Biology,2007,11 (2):220-225.
[14] PHILLIPS R S. Temperature modulation of the stereochemistry of enzymatic catalysis:prospects for exploitation[J]. Trends in Biotechnology,1996,14(1):13-16.
[15] 刘湘,孙培冬,李明,等. 面包酵母用于苯乙酮的不对称还原研究[J]. 分子催化,2002,16(2):107-110.
[16] CHIN-JOEI,STRAATHOF A J J,PRONK J T,et al. Influence of the ethanol and glucose supply rate on the rate and enantioselectivity of 3-oxo ester reduction by baker’s yeast[J]. Biotechnology and Bioengineering,2001,75(1):29-38.
[17] HILKER I,GUTIERREZ M C,FURSTOSS R,et al. Preparative scale Baeyer-Villiger biooxidation at high conversion using recombinant Escherichia coli and in situ substrate feeding and product removal process[J]. Nature Protocols,2008,3(3):546-554.
[18] MATSUDA T,YAMANAKA R,NAKAMURA K. Recent progress in biocatalysis for asymmetric oxidation and reduction[J]. Tetrahedron:Asymmetry,2009,20(5):513-557.
[19] 刘湘,方志杰,许建和,等. 酵母细胞催化芳香酮的不对称还原反应[J]. 催化学报,2006,27(1):20-24.
[20] LOU W Y,ZONG M H,SMITH T J. Use of ionic liquids to improve whole-cell biocatalytic asymmetric reduction of acetyltrimethylsilane for efficient synthesis of enantiopure (S)-1-trimethylsilylethanol[J]. Green Chemistry,2006,8(2):147-155.
[21] KURBANOGLU E B,ZILBEYAZ K,OZDAL M,et al. Asymmetric reduction of substituted acetophenones using once immobilized Rhodotorula glutinis cells[J]. Bioresource Technology,2010,101 (11):3825-3829.
研究开发
Asymmetric reduction of acetophenone to (R)-phenyl ethanol by Yarrowia lipolytica
XU Qin,WANG Dan,XU Qing,LI Shuang
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech. University,Nanjing 21009,Jiangsu,China)
Abstract:In order to improve Yarrowia lipolytica’s catalytic efficiency for acetophenone ,using 20mmol/L acetophenone and 20mmol/L phenyl ethanol as screening pressure,we obtained a mutant strain through UV mutation. Then we optimized the reaction conditions,such as temperature,pH,co-substrate and organic solvents. The mutant strain Yarrowia lipolytica ACA-DC 50109-H could reduce 20mmol/L acetophenone to optical pure (R)-phenyl ethanol (76% conversion,99.2% e.e.). The optimal reaction conditions were using glucose as co-substrate,and with t=30℃,pH=7.0 and the addition of 30%(v/v) ionic liquid (BMIM·PF6). When the culture broth of Yarrowia lipolytica ACA-DC 50109-H was used as the reaction system,with the addition of 30% BMIM·PF6, 60mmol/L acetophenone could be reduced to (R)-phenyl ethanol (97.5% conversion,95% e.e.) after 36h. Yarrowia lipolytica ACA-DC 50109-H could efficiently catalyze the asymmetric reduction of α-acetophenone to (R)-phenyl ethanol with high substrate loading,high conversion and e.e..
Key words:Yarrowia lipolytica; acetophenone; (R)-phenyl ethanol; biocatalysis; enzyme; optimization
基金项目:国家重点基础研究发展计划项目(2011CB710800)。
收稿日期:2015-05-21;修改稿日期:2015-07-30。
DOI:10.16085/j.issn.1000-6613.2016.02.028
中图分类号:Q 503
文献标志码:A
文章编号:1000–6613(2016)02–0528–06

