腺苷钴胺有关物质分析方法的改进及杂质研究
杨洪淼,廖海明,任雪,范慧红
(中国食品药品检定研究院,北京 100050)
腺苷钴胺有关物质分析方法的改进及杂质研究
杨洪淼,廖海明,任雪,范慧红Δ
(中国食品药品检定研究院,北京 100050)
目的 改进腺苷钴胺有关物质的分析方法,并对腺苷钴胺光降解的特性进行研究。 方法 采用色谱条件为Merck Hibar C18色谱柱(4.6 mm×250 mm,5 μm),0.05 mol/L磷酸二氢钾溶液:乙腈(90:10)-80%乙腈为流动相进行梯度洗脱,检测波长为260 nm的高效液相色谱法测定经光照后的腺苷钴胺固体和水溶液2种不同状态的有关物质,比较其光稳定性;采用LC-MS方法测定其主要的3种光降解杂质。结果 梯度洗脱条件可以使腺苷钴胺的光降解杂质更好的分离开,精密度和重复性实验结果由RSD=3.8%(n=6)和RSD=38%(n=5)提高至RSD=0.2%(n=6)和RSD=8%(n=5)。此外腺苷钴胺溶液对光非常敏感,配制时应注意严格避光操作。2种光降解杂质为腺苷和羟钴胺,相对响应因子分别为2.5和0.7。结论 改进后的方法专属性、耐用性和重复性均很好,可以更好的为腺苷钴胺的质量控制服务。
腺苷钴胺;高效液相色谱;有关物质;液相色谱-质谱
腺苷钴胺化学名为5,6-二甲基苯并咪唑基-5’-脱氧腺嘌呤核苷基钴胺,分子式为C72H100CoN18O17P,分子量1579.60,CAS号13870-90-1。腺苷钴胺及其片剂收载于《中国药典》2010年版二部,其片剂同时收载于《国家基本药物目录》(2012版)。氰钴胺、羟钴胺、腺苷钴胺及甲钴胺均属于维生素B12类物质,但只有腺苷钴胺和甲钴胺是活性辅酶形式,在人体内可直接发挥生物活性。临床上广泛应用于神经炎、神经麻痹等各种神经损伤的修复[1-4]。
本文将《中国药典》2010年版中腺苷钴胺项下有关物质分析方法加以改进,可以将腺苷钴胺的光降解杂质更好的分离开,从而有效提高杂质定量的准确性和重复性。由于腺苷钴胺具有较强的光不稳定特性,本文考察了固体和水溶液2种不同状态的光稳定性,为在检验过程中应如何进行避光操作提供了数据基础。并对主要的3种光降解杂质进行了LC-MS测定,最终确定了2种杂质的结构,进一步测定了这2种已知杂质的相对响应因子。
1 材料与方法
1.1 药品与试剂 腺苷钴胺(批号140658-201302,含量98.5%)、腺苷(批号110879-200202,含量99.0%)(购自中国食品药品检定研究院)。羟钴胺素(货号H7126,含量90.3%)、5’-脱氧腺苷(货号D1771,含量≥90.0%)(购自Sigma Alrich公司)。乙腈(购自Fisher试剂公司,色谱纯),磷酸、磷酸二氢钾(购自国药集团化学试剂有限公司,分析纯)。
1.2 仪器 Agilent 1100 液相色谱仪(包括G1311A四元泵、G1329自动进样器、G1316A柱温箱、G1314A VWD检测器、HP ChemStation for LC)(购自美国Agilent公司);MP230型pH计(购自瑞士Mettler Toledo公司);LTQ orbitrap型高分辨率液质联用仪(购自美国Thermo公司)。
1.3 腺苷钴胺有关物质测定方法的改进
1.3.1 色谱条件及溶液的配制:
① 色谱条件:色谱柱:Merck Hibar C18柱(4.6 mm×250 mm,5 μm);流动相:流动相A为0.05 mol/L磷酸二氢钾溶液(用磷酸调节pH值至3.2):乙腈(90:10),流动相B为乙腈:水(80:20);检测波长:260 nm;柱温:35 ℃;进样量10 μL;流速:1 mL/min。
② 供试品溶液配制:称取本品约25 mg,置25 mL量瓶中,加水适量,超声处理使溶解并加水稀释至刻度。避光操作。
③ 对照溶液配制:精密量取供试品溶液1 mL,至100 mL量瓶中,加水稀释至刻度。采用自身对照法进行定量。
1.3.2 梯度的改进:药典方法为采用0.05 mol/L磷酸二氢钾溶液(用磷酸调节pH值至3.2):乙腈(85:15),进行恒梯度洗脱;改进后的色谱条件为梯度洗脱,条件为B相:0~7 min,2%→9%;7~25 min,9%;25~25.1 min,9%→2%;25~35 min,2%。
1.3.3 精密度试验:将同一份供试品溶液,分别采用药典方法及改良方法,各连续进样6针,计算主峰前杂质峰面积总和的RSD。
1.3.4 重复性试验:配制5份浓度约为1 mg/mL的供试品溶液。分别采用采用药典方法及改良方法进样,采用峰面积归一化法计算主峰前面杂质的含量总和。
1.3.5 方法的耐用性考察:
① 色谱柱的影响:除Merck Hibar C18柱外,还考察了Venusil XBP C18柱(4.6 mm×250 mm,5 μm)和华谱Unitary C18柱(4.6 mm×250 mm,5 μm)。
② 流动相pH的影响:将流动相A中的磷酸盐缓冲液的pH调至4.5,其他条件不变进行实验。
1.4 腺苷钴胺稳定性的研究
1.4.1 光照破坏试验:
① 固体的光不稳定性试验:称取腺苷钴胺约50 mg,置称量瓶中,室内(非阳光直射、非日光灯照射,光度约600 xL)放置0.5 h后,进行有关物质测定。同时测定了60 ℃减压干燥至恒重后的样品(使用透明称量瓶,将真空干燥箱的可视窗口用白纸盖住,同时将干燥器置于暗处冷却,但其他操作步骤非避光操作)的有关物质。
② 溶液的光不稳定性试验:将1 mg/mL的腺苷钴胺溶液放置于敞口烧杯中,室内(光度条件同上)放置0.5 h后,按改良后的方法进行有关物质测定。
1.4.2 酸碱、氧化、高温破坏试验:
① 酸破坏试验溶液配制:称取本品约5 mg,加入1 mol/L盐酸溶液1.0 mL,避光放置30 min,加1 mol/L氢氧化钠溶液1.0 mL中和,再加水稀释至5 mL。
② 碱破坏试验溶液配制:称取本品约5 mg,加入2 mol/L氢氧化钠溶液1.0 mL,避光放置45 min,加1 mol/L盐酸溶液2.0 mL中和,再加水稀释至5 mL。
③ 高温破坏试验溶液配制:称取本品约5 mg,加水5.0 mL溶解,置于90 ℃烘箱中加热15 min。
④ 氧化破坏试验溶液配制:称取本品约5 mg,加水2 mL溶解,加0.1%氯胺T溶液0.4 mL,再加0.05 mol/L盐酸溶液0.1 mL,放置1 min,再加水至5 mL。
⑤ 分别取上述破坏试验溶液20 μL,按改良色谱条件测定。
1.5 腺苷钴胺的杂质研究
1.5.1 LC-MS法对腺苷钴胺光降解杂质的鉴定:
① 色谱条件:色谱柱为华谱Unitary C18柱(2.1 mm×10 mm,2.8 μm);流动相A为0.1%醋酸-乙腈溶液(90:10),流动相B为80%乙腈溶液,梯度洗脱(0~15 min,B相0%→15%);流速:0.2 mL/mL;检测波长:260 nm;柱温:35 ℃;进样5 μL。
② 质谱条件:正离子检测模式;数据采集范围m/z=100~2000;毛细管电压:4 kV;干燥器流速:8 mL/min;干燥器温度:350 ℃;雾化气压力:0.24 MPa;裂解电压:110 V;碎片碰撞能量:20 eV。
③ 样品溶液配制:取腺苷钴胺加水制成1 mg/mL的样品溶液。
1.5.2 杂质腺苷及羟钴胺的进一步确证:取腺苷对照品及羟钴胺对照品与腺苷钴胺在相同的色谱条件下进行液相测定。
1.5.3 已知杂质响应因子的测定: 精密称取腺苷钴胺、腺苷、羟钴胺各10 mg,置于同一10 mL量瓶中,加水制得储备液。精密量取储备液适量,加水稀释分别制成浓度为0.6125、1.25、2.5、5、10、20、40 μg/mL的系列溶液,分别精密量取上述溶液10 μL注入液相色谱仪,记录色谱图。以浓度为横坐标(C),以峰面积为纵坐标(A),进行线性回归。
2 结果
2.1 梯度的洗脱 采用药典方法测定腺苷钴胺的有关物质时发现,供试品溶液的色谱图在死体积后会出现一簇色谱峰,见图1A。进一步研究发现这些色谱峰并非溶剂峰,而是腺苷钴胺光降解的主要杂质峰。并且这些峰的峰面积在同份供试品溶液的不同次进样之间或是相同浓度的不同份供试品溶液之间,积分得到的结果变异性均较大,导致有关物质测定结果的重复性差。

图1 2种方法进行有关物质分析的色谱图A.药典方法;B.新方法Fig.1 Chromatogram of related substances analysis using two methodsA.Pharmacopeia method;B.New method
尝试将恒梯度洗脱改为梯度洗脱从而将前面的杂质峰分离,梯度洗脱条件所得色谱图,见图1B。前端可清楚地分出3个主要杂质峰,分离度良好。
2.2 精密度试验和重复性试验 精密度试验和重复性试验结果均表明新方法对结果有显著的改善,见表1。

表1 2种方法进行的精密度试验与重复性试验的结果Tab.1 Results of precision test and repeatability test in two methods
2.3 方法的耐用性试验
2.3.1 色谱柱的影响:不同色谱柱所得到色谱图中杂质的分离度均良好,见图2。
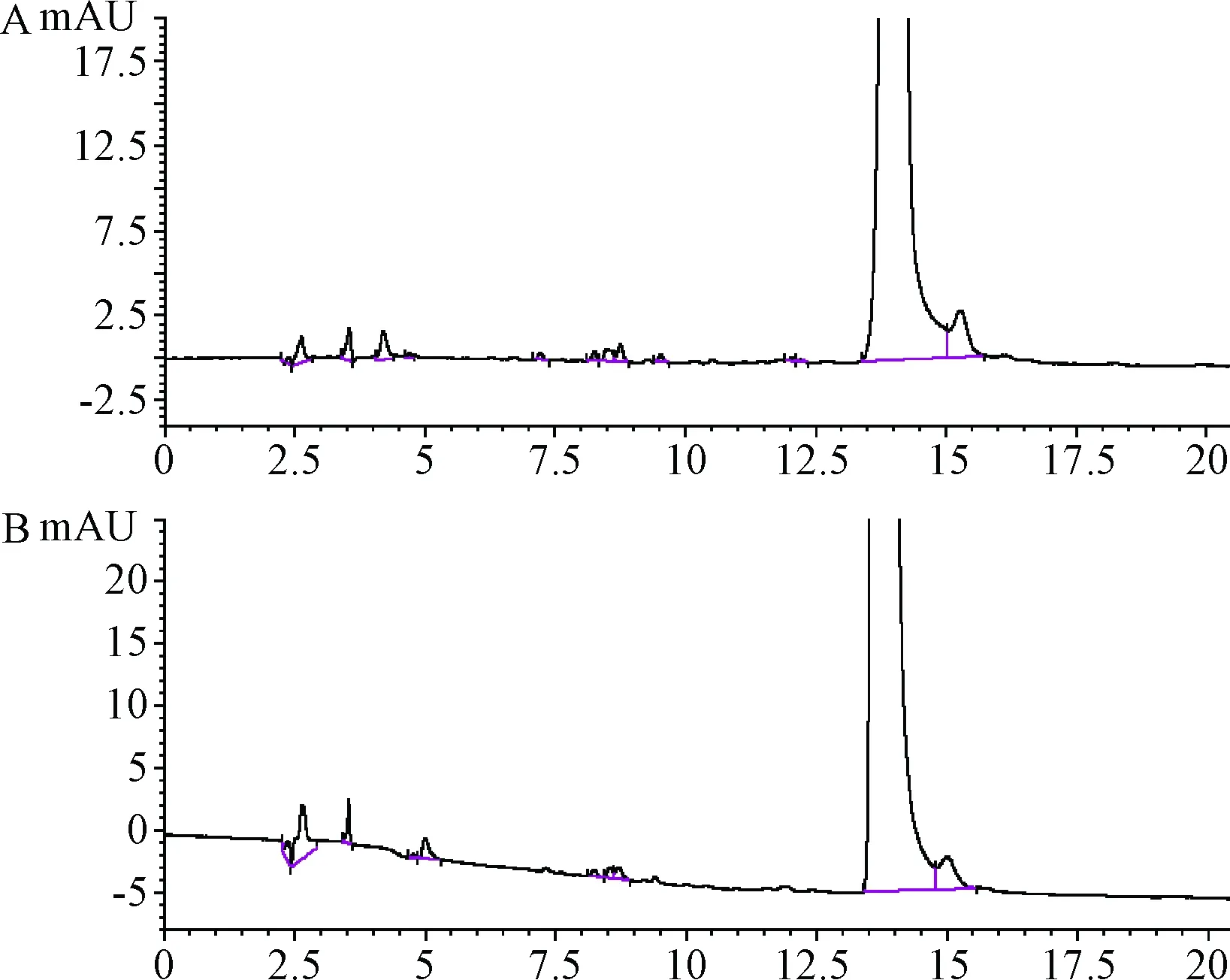
图2 不同色谱柱进行有关物质分析的色谱图A.Venusil XBP C18柱;B.华谱Unitary C18柱Fig.2 Chromatogram of related substances analysis by different columnsA.Venusil XBP C18 column;B.Huapu Unitary C18 column
2.3.2 流动相pH的影响:所得色谱图中各峰的峰形稍差,但色谱图前端的杂质依然可以分开,见图3。
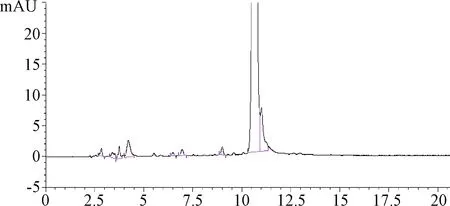
图3 流动相A的pH为4.5时进行有关物质分析的色谱图Fig.3 Chromatogram of related substances analysis with pH4.5 of mobile phase A
2.4 光照破坏试验
2.4.1 固体的光破坏条件:经过光照后的腺苷钴胺固体及60 ℃减压干燥至恒重后的样品杂质均未见明显增加。
2.4.2 溶液的光不稳定性试验:腺苷钴胺溶液经光照后,色谱图前端3个杂质峰面积明显增加,腺苷钴胺的峰面积降低约10%,见图4。而将腺苷钴胺溶液放置于黑暗的环境中(如液相色谱仪的可遮光的进样盘内),放置12 h后,杂质也未见明显增加。
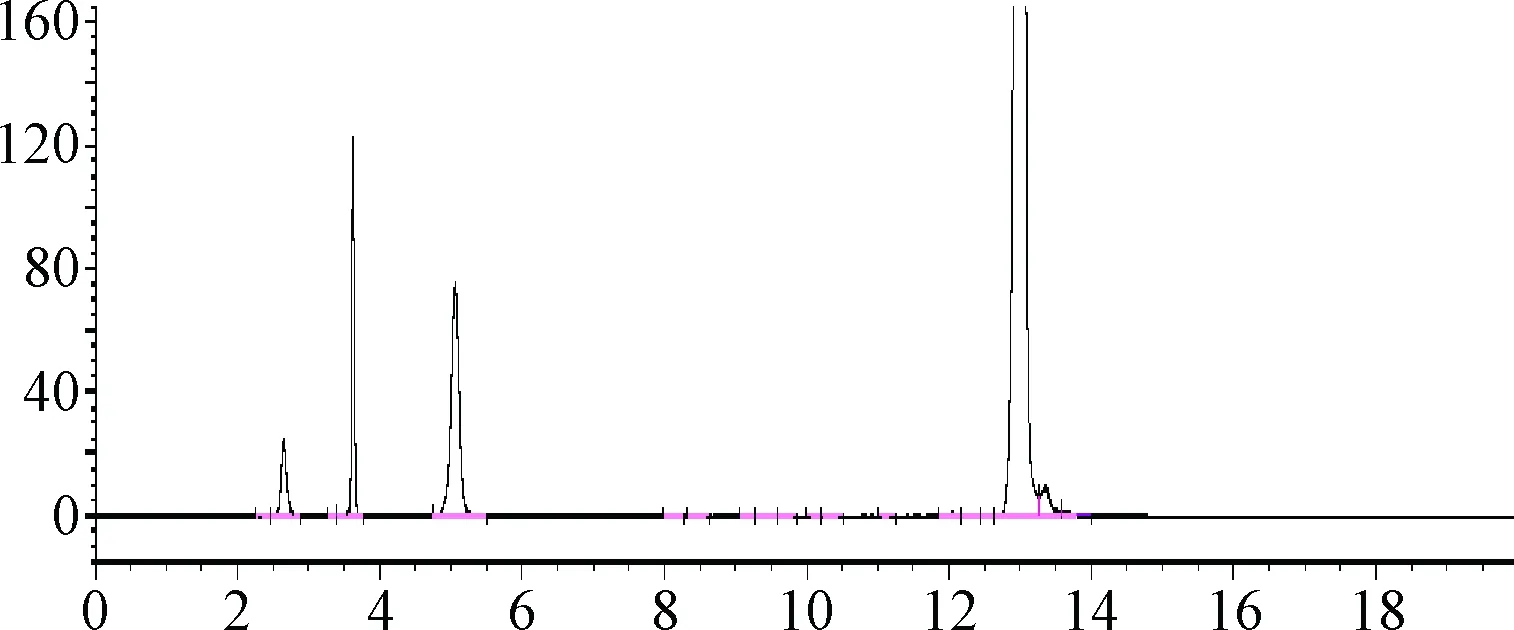
图4 腺苷钴胺溶液光降解试验色谱图Fig.4 Chromatogram of light degradation test of cobamamide solution
2.5 酸碱、氧化、高温破坏试验 结果表明本品除对光不稳定,对酸、碱、加热和氧化也不稳定,而本方法可以将降解杂质与主成分进行较好的分离,尤其可以将色谱图前端产生的主要降解杂质之间进行较好分离,更利于杂质的控制。氧化破坏试验条件是参照《中国药典》维生素B12品种[4]项下有关物质检查中系统适用性溶液的配制方法,所得色谱图与维生素B12类似[5-6],主峰后出现降解杂质峰,且分离度良好。本实验结果说明改良后的有关物质测定方法专属性良好。见图5。
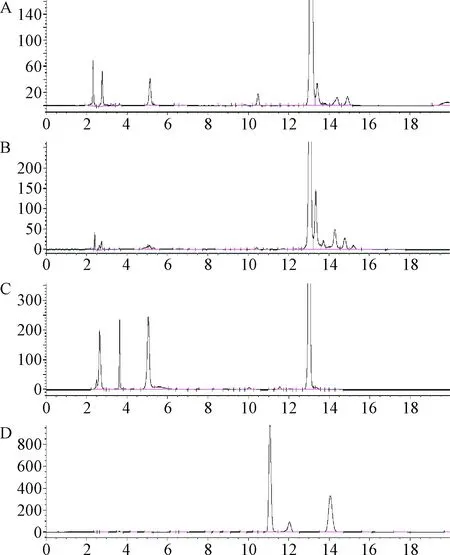
图5 腺苷钴胺酸、碱、高温和氧化降解试验色谱图A.酸降解试验;B.碱降解试验;C.高温降解试验;D.氧化降解试验Fig.5 Chromatogram of acid, alkali, high temperature and oxidative degradation test of cobamamideA.Acid degradation test;B.Alkaline degradation test;C.Heat degradation test;D.Oxidative degradation test
2.6 质谱鉴定 紫外光谱图和总离子流图见图6。腺苷钴胺光降解杂质所得的质谱图见图7。杂质峰1准分子离子峰为284.10,比腺苷分子量增加16,将此碎片进行LC-MS-MS测定,可得准分子离子峰136.13,与腺嘌呤[M+H]+的分子量相同。初步推测杂质峰1的结构可能为在腺苷的分子结构中核糖的上面加合了一个氧原子,但具体的位置还需要更多的试验证明;杂质峰2样品溶液中随杂质2浓度不同时,会测得不同的准分子离子峰284.10或250.22,推测为该杂质在离子源内发生反应,最常见的源内反应为加氧或脱水的反应,由于腺苷的分子量为267.24,所以不同的准分子离子峰可能为腺苷的[M+O+H]+峰或[M-H2O+H]+峰,由此推测出杂质峰2可能为腺苷;杂质峰3所得的准分子离子峰为664.78,由羟钴胺的分子量1346.32得出该准分子离子峰可能为羟钴胺的[M-H2O+2H]/2+峰,杂质峰3推测为羟钴胺。

图6 腺苷钴胺光降解杂质LC-MS测定图A.紫外光谱图;B.总离子流图Fig.6 LC-MS chromatogram of light degradation purities of cobamamideA.UV chromatogram;B.TIC chromatogram
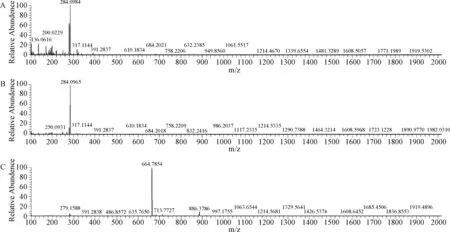
图7 腺苷钴胺光降解杂质所得的质谱图A.杂质峰1;B.杂质峰2;C.杂质峰3Fig.7 MS spectra for light degradation purities of cobamamideA.Impurity peak 1;B.Impurity peak 2;C.Impurity peak 3
2.7 杂质腺苷及羟钴胺的进一步确证 腺苷与杂质2的出峰时间一致,并使用DAD检测器得到峰的紫外吸收光谱,2者也是重合的,而羟钴胺与杂质3的出峰时间一致并且峰的紫外吸收光谱重合,见图8。由此进一步确证了腺苷钴胺的光降解产物中含有腺苷及羟钴胺。

图8 对照品与样品紫外吸收光谱比较图A.腺苷;B.羟钴胺Fig.8 UV absorption spectra of the reference standard and sampleA.Adenosine;B.Hydroxycobalamin
2.8 已知杂质响应因子的测定 腺苷钴胺、腺苷和羟钴胺线性方程(n=7)分别为:A=11.40C (r=0.997);A=28.66C+5.590 (r=0.999);A=7.505C+2.969(r=0.999)。经计算,相对于主成分腺苷钴胺,腺苷的响应因子为2.5;羟钴胺的响应因子为0.7。
3 讨论
根据查阅的腺苷钴胺有关物质分析的文献[7-10],本文首次采用梯度洗脱的方法进行分析。改进后的方法重复性、专属性及耐用性均良好,可以更加准确的对其杂质进行定量,从而达到更严格的药品质量控制。此外将腺苷钴胺的光降解杂质在色谱中分开,也为进一步杂质研究提供了基础。
通过对腺苷钴胺固体和水溶液光不稳定性的比较可得,水溶液对光极为敏感,而固体相对稳定。所以对腺苷钴胺固体进行称量时可以在普通天平室操作,但进行溶液配制时需要在暗室内操作,尤其对配制有关物质测定的供试品溶液时,此点尤为重要。
腺苷钴胺光降解杂质方面的研究较少。曾有文献报道5’-脱氧腺苷和羟钴胺可能是腺苷钴胺的光降解杂质[11],但通过高效液相色谱出峰时间的比较得出5’-脱氧腺苷并不是本文通过实验证明了腺苷和羟钴胺是腺苷钴胺的主要光降解产物,而已知杂质相对响应因子的测定可以进一步提高有关物质定量的准确性。
[1] 刘新通.腺苷钴胺的临床应用[J].中国处方药,2004,26(5):20-21.
[2] 王志良,冷健,崔红燕.腺苷钴胺的临床应用进展[J].中国药事,2006,20(2):122-125.
[3] 尚学军,胡卫国,姚福鑫,等.腺苷钴胺的药理及临床作用[J]临床合理用药,6(8):80.
[4] 中国药典2010年版,ISBN 978-7-5067-4483-6[S].北京:中国医药科技出版社,2010:1.
[5] 刘毅,岳志华.HPLC测定维生素B12注射液的含量和有关物质[J].中国药学杂志,2010,25(4):304-306.
[6] 刘毅,岳志华.维生素B12有关物质检查方法的探讨[J].药物分析杂志,2010,30(3):550-552.
[7] 殷莉莉,廉英,郭妍,等.高效液相色谱法测定腺苷钴胺片中的羟钴胺素含量[J].中南药学,2014,12(7):677-679.
[8] 晏敏红,麻军法.注射用腺苷钴胺有关物质测定方法改进[J].海峡药学,2013,25(8):62-65.
[9] 王志良,王芳,尹书芳,等.HPLC法测定注射用腺苷钴胺有关物质[J].中国药事,2006,20(8):492-493.
[10] 陈桥.HPLC测定腺苷钴胺有关物质[J].河北化工,2009,32(6):62-63.
[11] 封淑华,李力更,王丽萍.腺苷钴胺的光解研究[J].中国药科大学学报,1997,28(1):183-186.
(编校:王冬梅)
Improved analysis of related substances of cobamamide and the impurities research
YANG Hong-miao, LIAO Hai-ming, REN Xue, FAN Hui-hongΔ
(National Institutes for Food and Drug Control, Beijing 100050,China)
ObjectiveTo improve the related substances analysis method of cobamamide.And to further research light degradation characteristics of cobamamide.MethodsDetermined the related substances of solid and aqueous solution of cobamamide after light degradation by high performance liquid chromatography(HPLC) conditions,which is Merck Hibar C18column (4.6 mm× 250 mm, 5 μm), 0.05 mol/L KH2PO4solution:acetonitrile (90:10)-80% acetonitrile as mobile by gradient elution and detection wavelength 260 nm.And compared their light stability.The main three kinds of light degradation impurities were determinate from LC-MS.ResultsGradient elution made the light degradation impurities separate better.The results of precision and reproducibility tests increased to RSD=0.2% (n=6) and RSD=8% (n=5) from RSD=3.8% (n=6) and RSD=38%(n=5).Cobamamide solution was very sensitive to light, the preparation should be strict dark operation.Two of the light degradation impurities were adenosine and hydroxycobalamin, with the relative response factor 2.5 and 0.7.ConclusionNew method is specific, durable and reproducible, which can be used for quality control of cobamamide.
cobamamide; HPLC; related substances; LC-MS
杨洪淼,女,硕士,助理研究员,研究方向:生化药品的质量分析和质量标准的研究,E-mail:yanghongmiao@163.com;范慧红,通讯作者,女,博士,研究员,研究方向:生化药品的质量控制和质量标准的研究,E-mail:shenghuayaoshi@126.com。
R917
A
1005-1678(2015)06-0157-05

