1-MCP结合ClO2固体缓释剂处理对番茄贮藏的保鲜效果*
余定浪,任柯霖,欧州,谭书明
1(贵州大学酿酒与食品工程学院,贵州贵阳,550025)(贵州省农畜产品贮藏与加工重点实验室,贵州贵阳,550025)
番茄(tomato,Lycopersicum esculentum Mill)属茄科番茄亚属草本植物,营养丰富,味美可口,食用方法多样,深受广大消费者喜爱。番茄属于呼吸跃变型浆果,采后果实对乙烯极为敏感,在贮藏期间易受疫病、软腐病、溃疡病等多种病害的影响或侵染,极易导软化腐败而失去商品价值,造成较大的损失[1-2],因此,番茄的贮藏与保鲜极为重要。
1-甲基环丙烯(1-MCP)是一种新型乙烯受体抑制剂,能与乙烯受体发生不可逆性的结合,阻断乙烯与受体的结合,抑制其所诱导的与果实后熟有关的生理生化反应,从而延缓果蔬的成熟与衰老进程[3-4]。二氧化氯(ClO2)是一种新型高效广谱、安全无毒的消毒剂,它杀菌能力强、无气味残留,能阻止阻止蛋氨酸生成乙烯,从而延缓果蔬衰老与腐烂[5-6]。1-MCP和ClO2已广泛使用于果蔬贮藏保鲜领域,但两者结合处理的研究还比较少。研究报道蟠桃[7]、葡萄[8]采用1-MCP结合ClO2处理表现出很好的保鲜效果。本实验以番茄为材料,研究了在室温和低温贮藏条件下,1-MCP和ClO2固体缓释剂不同处理方式对番茄贮藏效果的影响。
1 材料与方法
1.1 材料与试剂
番茄:品种“金刚”,采摘自遵义县现代农业示范园区,采收成熟度绿熟期的果实,采收当天运抵实验室,通风预冷后挑选色泽均匀、大小均一(单果重为100 g左右)、无机械损伤、无病虫害的果实作为试验材料。
1-甲基环丙烯(1-MCP):兰州嘉诚生物技术有限公司出品,有效成分为4.5%。ClO2固载缓释剂:由本课题组自制,主要成分为NaClO2、酒石酸、CaCl2及活性炭。咔唑、半乳糖醛酸、浓H2SO4、冰醋酸、乙酸钠、多聚半乳糖醛酸、3,5-二硝基水杨酸、葡萄糖、乙醇等,均为分析纯,实验用水均为蒸馏水。
1.2 主要仪器
FHM-1硬度计,日本;M5IR复合式气体检测仪,BW科技公司,美国;RHB80手持折光仪,泰斯特仪器有限公司;TES-135色差计,台湾泰仕;T6紫外分光光度计,北京普析通用仪器有限责任公司;TGL20M台式高速冷冻离心机,长沙迈佳森仪器设备有限公司。
1.3 实验方法
1.3.1 处理方法
将样品随机分为4组,分别进行以下4种处理:
第1组(对照CK):直接用纸箱包装,每箱50个番茄果实。
第2组(1-MCP处理)参照陈印金等的方法[9]:先将其放入体积约为45 L的保鲜泡沫箱中(每箱50个番茄),同时将装有0.001 2g 1-MCP粉剂的50 mL烧杯放入沫箱中,然后往烧杯内加入10 mL蒸馏水,迅速把泡沫箱盖上密封,使箱内气体浓度约为0.5 ul/L,处理20 h后,用纸箱进行包装。
第3组(ClO2处理):用纸箱分装后向箱内放入ClO2固体缓释剂。
第4组(1-MCP+ClO2处理):按照第2组的方法先用1-MCP处理后用纸箱包装,然后向纸箱内放入ClO2固体缓释剂。
ClO2固体缓释剂使用量:室温为1 g/kg,低温为2.5 g/kg。
以上纸箱包装均为每箱50个番茄果实(约重5 kg),将以上处理过的番茄分为2批分别置于室温[(20~25)℃]和低温[(10±1)℃]条件下贮藏,每种处理重复3次。每5 d观察统计番茄的转色及腐烂发病情况,取样做各生理生化指标分析。
1.3.2 测定项目与方法
果实硬度采用日本FHM-l型硬度计测定;可溶性固形物用手持式折光仪测定;果胶酶活性的测定采用比色法[10];果胶含量的测定采用咔唑比色法[11],呼吸强度采用CO2分析仪测定法[12]。腐烂率测定:
腐烂率/%=(无商业价值果数/抽检果数)×100
转色指数的测定参照荣瑞分等的方法[13]。
1.2.3 数据统计与分析
本实验所有指标均在鲜重状态下测定,试验结果采用 Microsoft Excel软件进行数据整理,经 SPSS 18.0统计软件进行分析。文中图表用Origin8.5软件绘制。
2 结果与分析
2.1 不同处理对番茄转色率的影响
番茄果实的成熟与衰老主要表现为果实的转色及硬度的降低,随着果实成熟,番茄果实逐渐失绿转红,并开始软化[14]。由表1中可知,在室温条件下,对照组和ClO2缓释剂单独处理组在贮藏5 d时,转色指数分别达47%和45%,贮藏15 d时转色指数均高于90%,果实基本完全转红;经过1-MCP处理的果实在贮藏前15 d转色指数均显著低于对照组和ClO2缓释剂单独处理组(P<0.01),20 d后,各组果的转色指数无显著差异。在低温条件下,番茄转色明显受到抑制,前30 d各处理组显著显著低于对照组(P≤0.01);35 d时,对照组果实全部转红,各处理组转色指数也达90%以上。
从表1中还可以看出,无论在常温或低温条件下,1-MCP处理能显著性的延缓番茄在贮藏时色泽的变化,ClO2缓释剂单独处理对延缓番茄转色在常温下没有明显的作用。
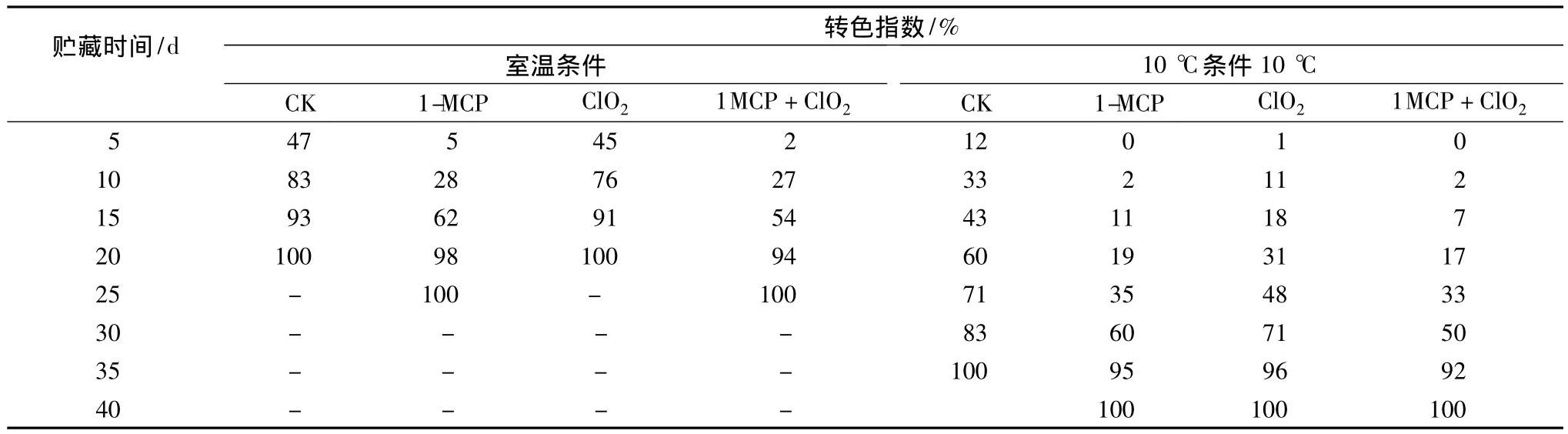
表1 不同贮藏条件下各处理对番茄转色指数的影响Table 1 Effects of different inhibitors treatments on degreening index of tomato under two storage conditions
2.2 不同处理对番茄腐烂率的影响
贮藏过程中,番茄的腐烂主要是因为病原微生物的浸染,导致组织软化腐败。由表2可看出,温度对番茄腐烂率有很大的影响,在室温下,对照组在贮藏10 d后开始出现腐烂,1-MCP+ClO2处理在第20天时才出现腐烂现象,并且腐烂率低于1-MCP、ClO2缓释剂单独处理组,贮藏30 d其腐烂率仅为20%。在低温下,对照组番茄20 d开始出现腐烂果,各处理组均在第25天时开始出现腐烂果,1-MCP+ClO2处理组在第45天时腐烂率为22%,仅占对照组的45.8%。在2个温度条件下,整个贮藏过程中对照组的腐烂率显著高于处理组(P<0.01);1-MCP+ClO2处理腐烂最少,其次是ClO2缓释剂单独处理,这可能是由于1-MCP能延缓番茄果实的衰老,增强果实的抗病性,再加上ClO2具有杀菌的作用,可防止病原菌对番茄果实的浸染,从而降低番茄的腐败。

表2 不同贮藏条件下各处理对番茄腐烂率的影响Table 2 Effects of different inhibitors treatments on incidence of decay of tomato under two storage conditions
2.3 不同处理对番茄呼吸强度的影响
如图1所示,在整个贮藏过程中,低温条件下各组番茄果实的呼吸强度明显低于室温条件。不同处理之间存在明显差异,3种处理均延缓番茄呼吸高峰的到来,并在一定程度上抑制了果实的呼吸。在室温下,ClO2缓释剂处理的果实在前5 d呼吸迅速加快,但第5天后开始下降,直到第15天时出现明显的呼吸峰,这可能是由于ClO2缓释剂在开始反应比较慢,产生的ClO2气体量少,对番茄的呼吸抑制不明显,但在5 d后缓释剂体系反应迅速,产生大量ClO2气体,抑制番茄呼吸。1-MCP对番茄的呼吸有着明显的抑制作用,尤其是在贮藏前期。冷藏条件下,番茄果实的呼吸强度受到抑制,前期都呈降低的趋势,对照组在第15天出现呼吸高峰,1-MCP、ClO2缓释剂单独处理组均在第20天出现高峰,1-MCP结合ClO2缓释剂处理组在整个贮藏期内无明显的呼吸高峰。
2.4 不同处理对番茄硬度的影响
由图2可看出,2个温度条件下贮藏的番茄果实硬度随贮藏期的延长不断下降,这是由于果实的后熟,其内部产生果胶酶,原果胶被水解生成可溶性果胶和果胶酸,细胞壁的纤维变得松散,果肉细胞分离,使果实逐渐变软、硬度下降[15]。常温贮藏对照组的硬度下降最快,贮藏20 d时仅为0.45 kg/cm2左右;经1-MCP+ClO2处理的番茄硬度下降最缓慢,贮藏30 d时大于0.49 kg/cm2。在低温下贮藏前期,番茄果实硬度下降缓慢,且无明显差异,直到第20天时,对照组果实硬度开始迅速降低,3个处理组到30 d时才开始出现明显的下降趋势,其中1-MCP+ClO2处理的番茄硬度下降最缓慢。
2.5 不同处理对番茄果胶酶活性的影响

图1 不同贮藏条件下各处理对番茄呼吸强度的影响Fig.1 Effects of different inhibitors treatments on respiration intensity of tomato under two storage conditions
从图3可以看出,在2个温度贮藏条件下,各组番茄果实的PG酶活性呈先上升后缓慢降低的趋势,对照组PG酶活性的上升速度明显高于处理组。在贮藏前期,3组处理均能明显抑制PG酶活性的升高,其中1-MCP+ClO2处理对番茄PG酶活性的影响最明显;在贮藏后期,各处理对番茄PG酶活性的影响均无明显差异。
2.6 不同处理对番茄可溶性果胶、原果胶含量的影响
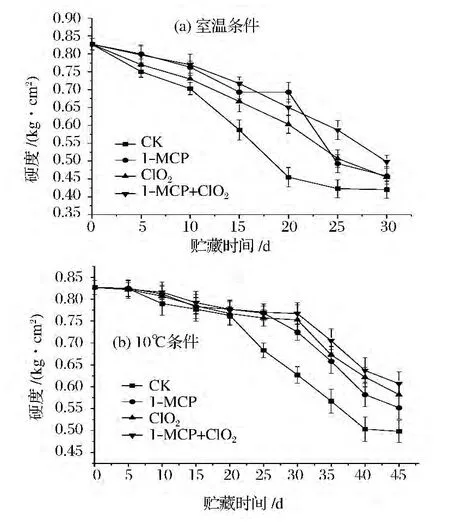
图2 不同贮藏条件下各处理对番茄硬度的影响Fig.2 Effects of different inhibitors treatments on firmness of tomato under two storage conditions

图3 不同贮藏条件下各处理对番茄果胶酶(PG)活性的影响Fig.3 Effects of different inhibitors treatments on pectinase activity of tomato under two storage conditions
如图4所示,在贮藏过程中各组番茄中可溶性果胶含量总体呈上升的趋势,而原果胶逐渐减少。室温下,3组处理番茄中的可溶性果胶含量上升幅度明显低于对照组,且各处理间差异显著(P<0.05),其中1-MCP+ClO2处理上升最慢,其次是1-MCP处理。在低温下,贮藏前期各组果实的可溶性果胶含量上升比较缓慢,各组间无明显差异,直到第20天后对照组开始迅速上升,显著高于其他3个处理组(P<0.01),第25天后1-MCP处理组也开始迅速上升,ClO2、1-MCP+ClO2处理组在30 d后才开始有明显的上升趋势。
由图4可知,在贮藏过程中,原果胶含量随可溶性果胶含量的降低而逐渐下降,这是由于果实在贮藏过程中,细胞壁原有的大量原果胶(不溶性果胶),在果胶酶的作用下分解为水溶性果胶[16-17]。实验结果表明,在贮藏过程中番茄水溶性果胶与原果胶的变化呈显著性负相关(室温:r=0.957,a=0.01;低温:r=0.945,a=0.05),原果胶逐渐转变为水溶性果胶,使果实细胞壁组织受到破坏,导致番茄组织软化,硬度下降。

图4 不同贮藏条件下各处理对番茄果胶含量影响Fig.4 Effects of different inhibitors treatments on content of pectin of tomato under two storage conditions
2.7 不同处理对番茄可溶性固形物的影响
由图5可知,在不同温度贮藏条件下,各组番茄可溶性固形物含量均呈先上升后缓慢下降的趋势,这主要是由于采后番茄在后熟过程中组织内一些大分子物质的水解作用,使其含量在贮藏初期增加;但另一方面,随着呼吸作用的不断进行,并且没有外界物质提供,可溶性固形物的消耗量大于产生量,使其在贮藏后期的含量逐渐降低[18]。贮藏前期对照组果实可溶性固形物含量的上升趋势要比处理组明显,差异达到极显著(P<0.01),贮藏后期处理组的下降程度低于对照组,其中1-MCP+ClO2处理组的下降程度最小。

图5 不同贮藏条件下各处理对番茄可溶性固形物含量的影响Fig.5 Effects of different inhibitors treatments on soluble solids content of tomato under two storage conditions
3 结论与讨论
本试验在室温和低温贮藏下用1-MCP和ClO2对绿熟期的番茄进行不同处理,结果表明无论是单独处理还是结合处理均表现出了一定的保鲜效果,且两者结合处理效果优于单独处理;1-MCP+ClO2处理结合低温贮藏更能有效地保持番茄的品质,延长贮藏期。
1-MCP可以竞争性地与乙烯受体蛋白质结合,阻止内源和外源乙烯与受体结合,阻断乙烯的正常代谢过程,并抑制其诱导的与果实后熟相关的一系列生理生化反应,进而延缓果实衰老进程。但是1-MCP只有在呼吸跃变型果实跃变前进行处理才有效,对跃变期和越变后的果实作用很小或没有作用,当内源乙烯催化果实达到一定的后熟阶段后,1-MCP就失去了抑制乙烯的作用[19]。
然而ClO2固体缓释剂在番茄贮藏过程中,缓慢释放出ClO2气体,它能有效地阻止果蔬组织内部蛋氨酸的分解,阻止乙烯的生产及破坏已产生的乙烯,并且有很强的杀菌能力,同时可以抑制腐败菌的生成[6]。但是ClO2固体缓释剂释放ClO2气体是一个缓慢的过程,初期贮藏环境中ClO2气体积累量较少,因此前期对番茄的生理变化影响效果不明显。
在本实验中,番茄贮藏前先用1-MCP处理,在贮藏过程中放入ClO2固体缓释剂,这样充分利发挥了1-MCP和ClO2固体缓释剂的保鲜作用,同时很好地弥补了两者单独使用时的不足。1-MCP和ClO2固体缓释剂结合处理有效地抑制贮藏过程番茄果实的呼吸强度,推迟呼吸跃变的出现,延缓果实生理生化反应进程,进而延缓组织衰老;同时抑制病原菌的生长,从而减少果实的发病、腐烂,更好的保持果实的品质。因此采用1-MCP结合ClO2处理在果蔬贮运保鲜中,具有潜在的应用价值和广阔的应用前景。
[1] 张子德.果熟贮运学[M].北京:中国轻工业出版社,2002.
[2] 程科,李洁,赵思明.西红柿的贮藏特性研究[J].现代食品科技,2006,22(3):28-31.
[3] Arnold M Opiyo,YING Tie-Jin.Effect of 1-Methylcyclopropene post-harvest treatment on ripening process in cherry tomato fruit(Lycopersicon esculentum var.cerasi forme)[J].Journal of Plant Physiology and Molecular Biology,2005,31(1):27-33.
[4] 付琳,程顺昌,魏宝东.1-MCP及其结构相似物处理对番茄采后贮藏效果的影响[J].食品与发酵工业,2012,38(1):195-198.
[5] 傅茂润,杜金华.二氧化氯在食品保鲜中的应用[J].食品与发酵工业,2004,30(8):113-116.
[6] 傅茂润.二氧化氯(ClO2)对果蔬的贮藏效果及其机理研究[D].青岛:山东农业大学,2005,11.
[7] 肖丽梅;钟梅等.1-甲基环丙烯和二氧化氯对新疆蟠桃保鲜效果的研究[J].食品科学,2009,30(12):276-280.
[8] 冯叙桥;关筱歆等.1-MCP结合ClO2处理对冰温贮藏玫瑰香葡萄生理和品质的影响[J].食品工业科技,2012(17):333-337.
[9] 陈金印;刘康.1-MCP处理对秋番茄果实采后生理及贮藏效果的影响[J].食品科学,2008,29(10),598-603.
[10] 曹建康;赵玉梅等.果蔬采后生理生化实验指导[M],北京:中国轻工业出版社,2007:87-90.
[11] 曹建康;赵玉梅.果蔬采后生理生化实验指导[M],北京:中国轻工业出版社,2007:84-87.
[12] 张桂.果蔬采后呼吸强度的测定方法[J].理化检验-化学分册.2005,41(8):596-597.
[13] 荣瑞分;佟世生;冯双庆.水杨酸对采后芒果核番茄保鲜效果的初步研究[J].食品科学,2001,22(3)79-81.
[14] 斋腾隆.番茄生理基础[M],上海:上海科学技术出版社,1981.
[15] 陈志远,韩志平,张海霞.1-MCP在果蔬贮藏保鲜中的应用[J]. 黑龙江农业科学,2013(10):104-106.[16]Bett C,Waldron K W.Chapman and Hau[M].London:UK,1996:256.
[17] Dessalegne L,Wetter AC,Caligari PDS.Production of transgenic tomato expressing oxalate oxidase[J].AltaHorticurae,1997,447:457-458.
[18] 王海亭.中国番茄[M].黑龙江科学技术出版社,2001:171-178.
[19] 王玥.不同温度、包装及挤压处理对采后番茄品质的影响[D].天津:天津大学,2010:6.

