微血管损伤对大鼠记忆行为能力及脑组织淀粉样蛋白片段的影响
丁玲,肖波,毕方方,李啬夫,吴平,罗星,汤显靖
论著·基础
微血管损伤对大鼠记忆行为能力及脑组织淀粉样蛋白片段的影响
丁玲,肖波,毕方方,李啬夫,吴平,罗星,汤显靖
目的观察SD大鼠脑微血管损伤后行为学及脑组织内淀粉样蛋白片段(Aβ)水平变化。方法SD大鼠60只,随机分为空白对照组、假手术组、造模组各20只。用血栓法制备多发性脑栓塞动物模型,以morris水迷宫检测大鼠空间学习记忆能力,Westen-blot方法检测大鼠脑组织内Aβ蛋白水平。结果定位航行实验中,模型组大鼠找到平台的潜伏期明显长于空白对照组和假手术组(P<0.01),而后2组间差异无统计学意义(P>0.05);空间探索实验中,模型组在原平台所在象限停留的时间明显短于空白对照组和假手术组(P<0.01),而后2组间差异无统计学意义(P>0.05);模型组脑组织Aβ蛋白水平较空白对照组和假手术组明显升高(P<0.01),而后2组间差异无统计学意义(P>0.05)。结论大鼠脑微血管损伤后出现学习和记忆能力下降,脑组织Aβ蛋白水平升高,可能促发了阿尔茨海默病的发生。
阿尔茨海默病;脑微血管损伤;淀粉样蛋白片段,脑组织;大鼠
阿尔茨海默病(Alzheimer’s disease, AD)又名老年性痴呆,是一种以进行性认知障碍和记忆损害为特征的神经退行性疾病。淀粉样蛋白片段(Aβ)被认为是导致AD的直接病理原因,是引起AD脑中其他病理改变的关键环节[1]。目前AD的发病机制不明,尽管AD是一个神经变性疾病,越来越多的研究资料显示,其与血管危险因素和血管发病机制紧密联系[2]。本研究目的是观察大鼠脑微血管损伤后大脑是否有Aβ沉积,现报道如下。
1 材料与方法
1.1 材料 动物:健康成年雄性清洁级SD(Sprangue-Dawley)大鼠60只,5~6月龄,体质量(300±50)g,由中南大学湘雅医学院实验动物中心提供;随机分为空白对照组、假手术组、手术造模组,每组20只。主要试剂及仪器:兔抗Aβ 多克隆抗体(Cell Signaling公司,美国),GAPDH(甘油醛-3-磷酸脱氢酶)内参抗体(Roche公司,德国),morris水迷宫视频分析系统(上海欣软信息科技有限公司),Ethovision 图像自动采集和软件分析系统(Noldus公司,荷兰),HPIAS-1000高清晰彩色病理图像分析系统(武汉大学影像工程公司)。
1.2 动物模型制作
1.2.1 栓子制备:同种异体大鼠左心室内采血1 ml,于37℃温箱内自然干燥制作成全血凝块,将其研碎后用200μm筛孔过筛,应用时取血栓栓子1 mg加生理盐水0.5ml,摇匀成混悬液。
1.2.2 建立脑微血管损伤动物模型:模型组SD大鼠20只:参考文献[3]方法制作多发栓塞性动物模型,暴露颈总动脉、颈外动脉与颈内动脉,暂时夹闭颈总动脉,于颈外动脉逆行插管,缓慢注入栓子溶液0.3 ml,推注同时开放颈总动脉,使栓子通过颈内动脉进入颅内至大脑各动脉造成多发性脑梗死,然后结扎颈外动脉,缝合皮肤。假手术组20只:手术方法同模型组,只在穿刺时以生理盐水0.3 ml代替栓子溶液。空白对照组20只:正常喂养,不给任何药物。
1.3 观测项目
1.3.1 morris水迷宫观察大鼠行为:水迷宫池壁上标有东南西北4个入水点,将水池等分为4个象限。训练期间迷宫外参照物保持不变。
1.3.2 定位航行实验:存活大鼠饲养1个月后,先将大鼠放入morris水迷宫的水池中(不放平台)自由游泳2 min使其熟悉迷宫环境。实验方法历时5d,每天于固定时间段,每个时间段训练4次。记录大鼠在2 min内寻找平台的时间(逃避潜伏期)。如果大鼠在2 min内未找到平台,潜伏期记录为120s。由实验者将其拿上平台,在平台上休息15s再进行下一次实验。每天以大鼠4次训练潜伏期的平均值作为大鼠当日的学习成绩。
1.3.3 空间探索实验:定位航行实验全部结束后,次日进行空间探索实验。撤去平台,从任一入水点将大鼠面向池壁放入水中,记录2 min内大鼠在平台各象限停留的时间。
1.3.4 Aβ蛋白检测:实验结束后处死大鼠使用Westen-blot方法检测大鼠脑组织内Aβ蛋白水平。因甘油醛-3-磷酸脱氢酶(GAPDH)在大鼠组织中相对恒定表达,可用GAPDH的光密度作为内参照,目的蛋白光密度与GAPDH光密度比值即为目的蛋白的相对值。将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的光密度,得出Aβ的相对值,进行统计学处理。
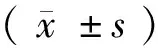
2 结 果
2.1 行为变化 在定位航行实验中,模型组大鼠找到平台的潜伏期均明显长于空白对照组和假手术组(P<0.01);空白对照组和假手术组大鼠的潜伏期基本相同(P>0.05),说明2组大鼠的适应能力和体能情况基本相同。随学习时间的延长各组的潜伏期均呈递减趋势,见图1。在空间探索实验中,所有大鼠在原平台所在象限(第1象限)停留的时间都明显高于其他象限(P<0.01),但模型组大鼠在原平台所在的目标象限停留的时间明显低于空白对照组和假手术组(P<0.01),空白对照组和假手术组停留时间基本相同(P>0.05),见图2。

图1 大鼠找到平台的潜伏期

图2 大鼠在各象限停留时间
2.2 Aβ蛋白变化 空白对照组与假手术组大鼠脑组织内可见少量Aβ蛋白(0.24±0.06 vs. 0.27±0.12),2组比较差异无统计学意义(P>0.05),模型组Aβ蛋白量(0.65±0.28)较空白对照组和假手术组明显升高(P<0.01),见图3。

注:M.Marker;1.空白对照组;2.假手术组;3.模型组
3 讨 论
脑微血管一般指脑微小动脉和微小静脉之间的毛细血管及微血管网,形成了三维立体的网络结构,是脑微循环的通路,其为直径<100μm的血管系统,如穿通支动脉、软脑膜血管等。在生理状态下,微循环系统为脑组织提供营养,当动脉血流中断时,会使下游的微循环相继发生病理性改变,如微小血栓形成、内皮细胞通透性增加、基底膜破裂及炎性反应等,这一系列的缺血“瀑布”反应,导致微循环结构和功能发生损伤,大脑营养、代谢都会出现障碍,最终导致神经元损害[4]。
腔隙性脑梗死为发生于微血管的脑血管疾病。大鼠脑内注射栓子是栓塞性脑缺血模型的常用制备方法,可用来模拟临床腔隙性脑梗死,从而观察脑微血管损伤的病理生理变化。本实验将外源性栓子注入动物体内,造成多发性脑梗死,既往研究表明,本方法造模后栓子在脑内分布广泛,大脑中动脉分布区域肯定累及,100%大鼠手术同侧脑部有栓子存在[5]。本实验中大鼠造模后进行的行为学检查结果显示,模型组大鼠与空白对照组及假手术组相比,找到平台的潜伏期明显延长,在原平台所在象限停留的时间明显减低,说明模型组大鼠空间学习能力及空间记忆能力均受影响。
AD最常见的病理改变是:老年斑、神经纤维缠结、脑血管的淀粉样改变、神经细胞的丢失[6]。Aβ是淀粉样沉淀的产物,被认为是导致AD的直接病理原因。Aβ包括分别含有40个和42个氨基酸残基的多肽Aβ40和Aβ42,虽然Aβ42的量较Aβ40少得多,但Aβ42以更稳定的形式存在于老年斑和神经元纤维缠结中[7]。大量形态学研究表明,AD患者脑组织中普遍存在微血管病变,如脑淀粉样血管病、微血管变性、血脑屏障的改变、白质损害及微血管梗死、脑出血等。在AD和正常老年人脑中存在很多微血管改变,包括血管襻形成、血管扭曲,以及小动脉硬化、纤维素样坏死、脂质变性、血管外膜钙化、白质和灰质微血管密度下降[2,8]。有些微血管变化与AD患者的神经元脱失平行。许多研究者发现了AD发作的血管位点,以及Aβ损伤的目标是中枢神经系统的小动脉、细动脉和毛细血管[9]。脑血管损害在AD患者发病机制中的作用还不十分清楚,缺血在前还是Aβ沉积于脑血管加重了脑缺血,加重了AD的认知功能减退,多数观点认为,Aβ是导致AD的直接病理原因,是引起AD脑中其他病理改变的关键环节。本实验反其道而行之,观察到大鼠脑微血管损伤后脑组织内Aβ表达,推测脑微血管损伤可能影响了Aβ清除而促发淀粉蛋白沉着,是AD的促发因素,一方面可以解释脑卒中动物模型的学习记忆功能障碍,可能存在Aβ沉积,进一步可解释胆碱酯酶抑制剂对血管性痴呆的症状治疗有效[10];另一方面为构建AD模型提供了思路,同时也解释了临床运用扩张血管、改善脑血液供应、神经营养等治疗单独用于可能的AD或症状轻微的AD[6,11]。
1 Panchal M, Rholam M, Brakch N. Abnormalities of peptide metabolism in Alzheimer’s disease[J].Curr Neurovase Res,2004,1(4):317-323.
2 Franzblau M, Gonzales-Portillo C, Gonzales-Portillo GS, et al. Vascular damage: A persisting pathology common to Alzheimers`disease and traumatic brain injury[J].Med Hypotheses,2013,9(13):450-457.
3 梅建勋,张伯礼,张云岭.多发梗塞性痴呆动物模型的改进与应用[J].天津中医学院学报,1997,16(2):38-40.
4 Bink DI, Ritz K, Aronica E, et al. Mouse models to study the effect of cardiovascular risk factors on brain structure and cognition[J]. J Cereb Blood Flow Metab,2013,8(10):1038.
5 Ren M, Lin ZJ, Qian H, et al. Embolic middle-cerebral artery occlusion model using thrombin and fibrinogen composed clots in rat[J].J Neurosci Methods,2012,9(2):296-304.
6 温蒲圆,周军.阿尔茨海默病治疗的研究进展[J].中国老年学杂志,2013,33(7):3524-3527.
7 张志慧,曹冉,周龙岗,等.通心络对Aβ损伤脑微血管内皮细胞中炎性因子及信号通路NF-κB表达的影响[J].疑难病杂志,2010,9(9):645-646
8 Jelliner KA.Alzeimer disease and cerebrovascular pathology an update[J]. J Neural Transm,2002,109(5-6):813-836.
9 Knopman D, Boland LL, Mosley T, et al. Cardiovascular risk factors and conitive decline in middle-aged adults[J]. Neuroloy,2001,56(1):42-48.
10 魏翠柏,周爱红,王芬,等.胆碱酯酶抑制剂在痴呆治疗中的现状[J].疑难病杂志,2010,9(12):948-949.
11 Langbaum JB, Fleisher AS, Chen K, et al. Ushering in the study and treatment of preclinical Alzheimer’s disease [J].Nat Rev Neurol,2013,9(7):371-381.
数值的修约
按照GB 8170-1987《数值修约规则》进行,其简明口诀为“4舍6入5看齐,5后有数进上去,尾数为0向左看,左数奇进偶舍弃”。例如:修约到一位小数,12.149修约为12.1;12.169修约为12.2;12.150修约为12.2,12.250修约为12.2。
Theethologyandtheexpressionofamyloidβpeptideaftercerebralmicrovascularembolisminrats
DINGLing*,XIAOBo,BIFangfang,LILinfu,WUPing,LUOXing,TANGXianjing.
*DepartmentofNeurology,theThirdHospitalofChangsha,Changsha410075,China
ObjectiveTo observe the ethology and the expression of amyloid β peptide after cerebral microvascular embolism in adult rats.MethodsSixty SD rats were randomly divided into control group, sham operation group, mode group with 20rats in each group. Prepared animal model of multiple cerebral embolism with thrombus legal system to detect morris water maze spatial learning and memory in rats, Westen-blot was used to detect the protein in rat brain Aβ levels.ResultsNavigation test showed that, time of the model rats found the latency was significantly longer than the control group and the sham group (P<0.01), between the latter two groups, there was no statistically significant (P>0.05); in the space exploration experiments, the stay time on the the former platform of model group was significantly shorter than the control group and the sham group (P<0.01), between the latter two groups, there was no statistically significant(P>0.05); brain tissue Aβ protein levels in mode group higher than the control group and the sham group (P<0.01), between the latter two groups, there was no statistically significant (P>0.05).ConclusionAfter brain microvascular injury occurs, learning and memory of rat decline, increased brain Aβ protein levels may trigger the occurrence of Alzheimer's disease.
Alzheimer's disease; Cerebral microvascular embolic model; Amyloid β peptide; Brain tissue; Rats
长沙市2013年度指导性科技计划项目(No.K13ZD060-33),长沙市第三医院院内课题
410075 长沙市第三医院神经内科(丁玲、李啬夫、吴平、罗星、汤显靖); 410008 长沙,中南大学湘雅医院神经 内科(肖波、毕方方)
10.3969/ j.issn.1671-6450.2014.02.027
2013-10-09)

