江苏某规模化猪场回肠炎感染状态监测与防控建议
曲向阳
(1.美国礼来亚洲公司上海代表处,上海 200021;2.南京农业大学动物医学院,江苏 南京 210095)
猪回肠炎又名增生性肠炎、增生性出血性肠炎,是由胞内劳森氏菌(Lawsonia intracellularis)感染所致的以回肠、盲肠、结肠黏膜呈腺瘤样增生为主要特征的一种重要猪肠道疾病。该病易感染生长育肥猪、后备母猪,严重影响猪只饲料效率与生长速度,对养猪业的经济效益影响严重[1]。据Jensen报道,在美国每头回肠炎感染猪的经济损失至少1.531美元[2]。
依据临床症状差异,本病可分为急性型、慢性型与亚临床型。急性型多发于后备母猪及17周龄以上的育肥猪,健康猪群似乎更易感染急性型回肠炎[3]。常表现为出血性下痢(图1),甚至突然死亡。慢性型与亚临床型回肠、盲肠与结肠增厚(图3),粪便无成型(图4),但无典型临床症状,2周龄~20周龄的猪只均易感染[4],无法依据临床症状进行诊断。
本试验采用LawsoniaFIRSTtestTM回肠炎诊断试剂盒对该猪场粪便样品中的胞内劳森氏菌进行了检测,以期了解回肠炎的感染状态与感染时间点,为该病的精准化策略性用药预防或疫苗免疫提供实验依据。
1 材料与方法
1.1 样品采集
2011年12月,在江苏省某规模化猪场随机采集特定周龄的新鲜松软或水泥样的粪便样品,各3 g。样品主要来自于4、6、8、10、12、14周龄的保育猪、后备母猪与经产母猪,每阶段作2~3份重复,采样后立即检测。
1.2 检测试剂
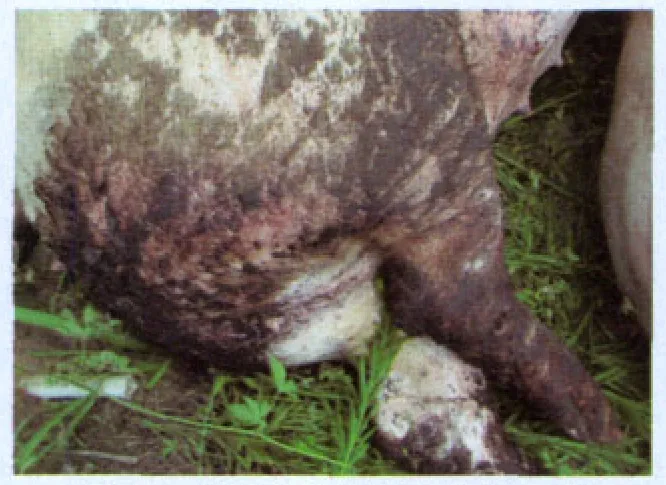
图1 后备母猪急性出血性下痢

图2 回肠、盲肠等部位出血

图3 慢性回肠炎,肠黏膜增厚,呈脑回状

图4 慢性回肠炎导致粪便松软
本检测采用德国Microcoat公司开发的LawsoniaFIRSTtestTM回肠炎现场诊断试剂盒(免疫磁珠法,美国礼来公司拥有专利权)。其原理与双抗体夹心ELISA类似。以包被在磁珠上的多克隆抗体捕捉粪便中的胞内劳森氏菌,然后通过连接在多克隆抗体上的过氧化物酶(POD)催化TMB显色,通过颜色变化,对胞内劳森氏菌的感染状态进行定性检测。通过对比颜色变化,对胞内劳森氏菌的感染状态进行半定量检测。(图5)。
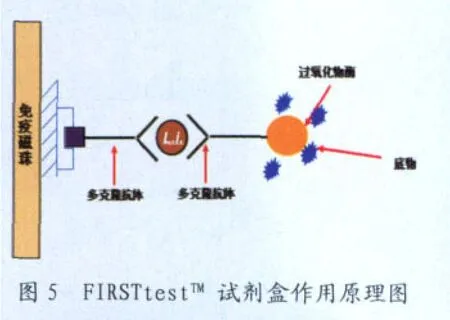
图5 FIRSTtestTM 试剂盒作用原理图
1.3 检测方法
依照FIRSTtestTM试剂盒说明书进行检测。①样品稀释与 沉淀:将1 g粪便样品与5 mL样品稀释缓冲液在样品收集管中混合,摇匀后,放在试管架上静置5 min;②样品转移:分别使用不同的移液管吸取0.5 mL的上清液至分析管(管内含有劳森氏菌多克隆抗体包被的免疫磁珠)中,设立阳性对照组(阳性对照为0.5 mL劳森氏菌菌液),摇匀后,将分析管放在试管架上孵育30 min;③磁珠分离与洗涤:将分析管转移至磁体架上进行磁头分离,然后洗涤2次;④加入抗体-过氧化物酶共轭物:分别向分析管中加入0.5 mL的抗体-过氧化物酶共轭物,摇匀后,将分析管放置在试管架上孵育20 min;⑤磁珠分离与洗涤:同步骤③;⑥加入TMB显色:分别向分析管中加入0.5 mL的TMB底物显色液,并设立阴性对照(阴性对照管内含有劳森氏菌多克隆抗体包被的免疫磁珠),摇匀后,孵育7 min;⑦结果判读:将分析管放置在磁铁架上,记录颜色变化,阳性呈蓝色,阴性液体透明。
2 检测结果
FIRSTtestTM是一种定性检测劳森氏菌的方法,通过待检样品与阳性对照、阴性对照间的颜色对比(图6),将回肠炎在该场的感染状况汇总于表1。从检测结果可发现:4周龄与6周龄各有1份样品(33%)呈阳性,8周龄的样品胞内劳森氏菌检测呈阴性,而自10周龄保育仔猪起至14周龄的生长猪及母猪的胞内劳森氏菌检测均呈阳性,特别是14周龄与母猪样品呈强阳性。
3 分析与讨论
目前回肠炎的主要诊断方法包括利用PCR、免疫过氧化酶法检测粪便样品中的劳森氏菌或采用ELISA、IFA等检测胞内劳森菌抗体[5]。本检测采用的FIRSTtestTM检测可在猪场现场快速检测粪便中是否含有感染剂量的劳森氏菌,适用于规模化猪场回肠炎感染状态与防控效果的自我评估。
回肠炎多发生于生长育肥阶段,但各场间感染时间存在差异[6],所检样品来自于4周龄~14周龄的保育猪、生长猪、后备母猪及经产母猪。本次检测时未刻意挑选有顽固性腹泻的粪便进行检测。但猪群从第10周开始感染,说明该场回肠炎处于亚临床感染状态。
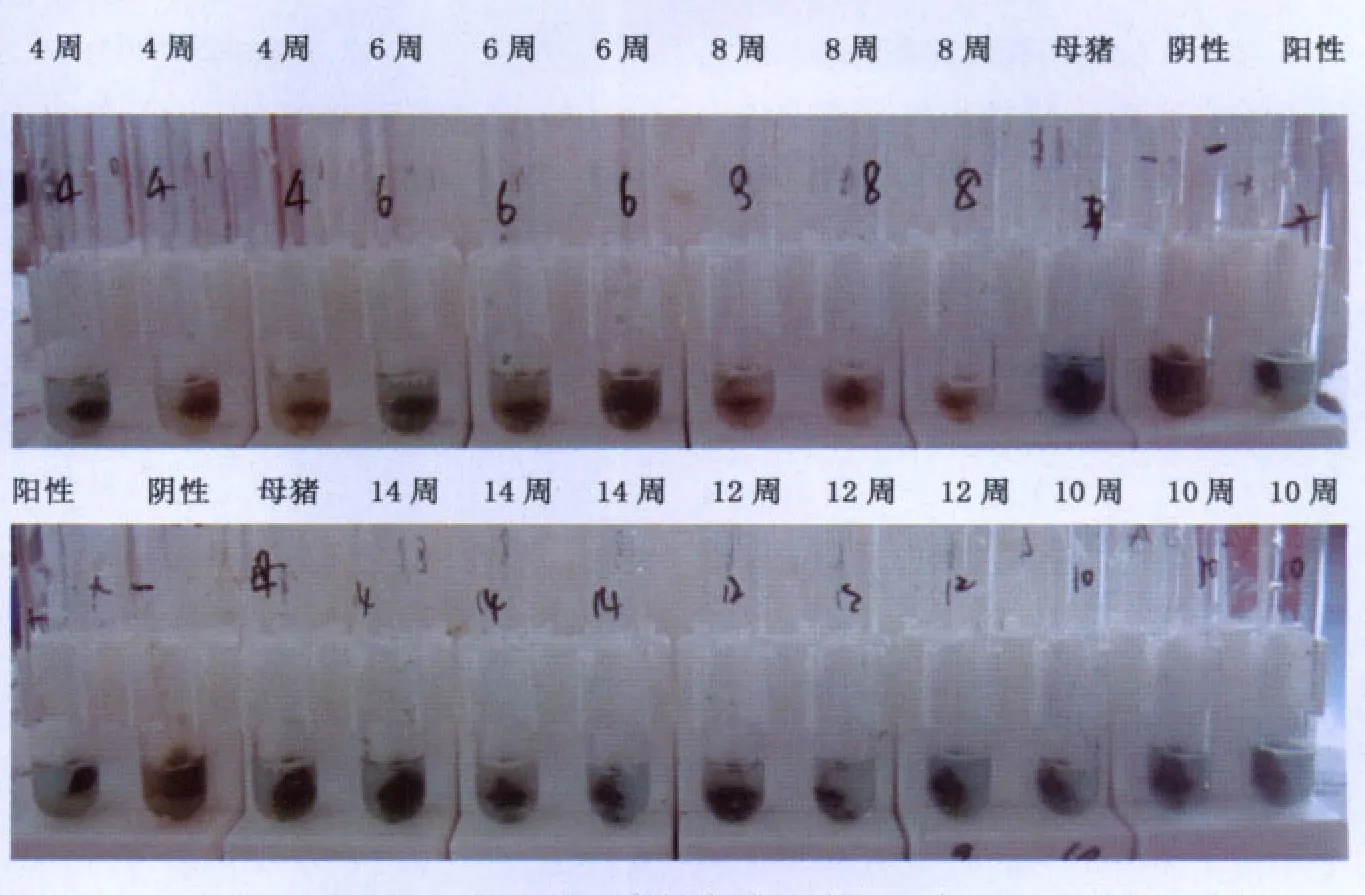
图6 该猪场不同周龄猪粪样中胞内劳森氏菌的检测结果
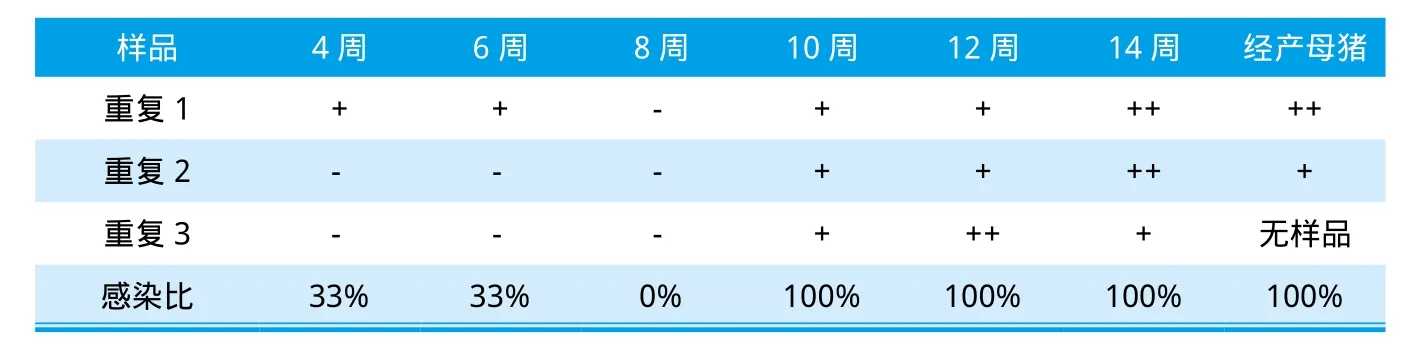
表1 胞内劳森氏菌感染分布状况
由于该场母猪已感染胞内劳森氏菌(强阳性),母猪通过主动免疫自身可产生抗劳森氏菌的抗体,并通过母乳传递给仔猪,使仔猪特别是哺乳仔猪获得被动免疫,抑制了胞内劳森氏菌在哺乳仔猪肠上皮细胞内的大量增殖。哺乳仔猪于3周龄断奶,4周龄的粪便样品胞内劳森氏菌66.7%呈阴性。但断奶后(3周龄后),失去了母源抗体的保护。据Guedes等人[7]发现抗体阳性的母猪所产仔猪的母源抗体可持续至5周龄,可保护哺乳仔猪与保育前期猪免受劳森氏菌感染。随着母源抗体的消退,加之保育转群应激、环境温度变化与卫生消毒等生物安全措施不到位等,猪只自身抗病能力下降,促进了胞内劳森氏菌的繁殖,并通过粪便相互传染,特别是卫生消毒工作不彻底时,往往造成全群带菌。故该场自4周龄与6周龄开始部分猪只(33%)被感染并排菌。10周以后的猪及母猪劳森氏菌的感染率高达100%。14周龄保育猪与母猪的粪便样品颜色最深(超过阳性对照的颜色),即说明14周龄以后的粪便中的胞内劳森氏菌浓度最高,猪只感染压力大。母猪群回肠炎感染压力大,是回肠炎重要的传染源。
该场保育阶段使用过强力霉素,使得8周龄的仔猪样品完全呈阴性,此时体内没有足够量的抗原使机体形成主动免疫,故不能彻底地阻断胞内劳森氏菌在该场的传播。10周龄时,胞内劳森氏菌再次感染,并在14周龄时达到高峰,将严重影响饲料的转化率、猪只生长速度与经济效益。
4 防控建议
4.1 强化科学良好的饲养管理与卫生消毒工作
1)尽量降低转群并栏时的应激,减少不良环境因素的影响,如:加强通风,避免猪舍内温度的波动,合理的饲养密度以提供足够的饲喂空间与饮水供给。
2)在饲养管理上,实行全进全出,批次管理,加强清洁与消毒工作,特别是转群后批次间的栋舍的清扫,消毒与干燥等工作。
3)加强生物安全防范。特别应避免因鸟类、工作人员及鼠类传播病原菌。在引进新的后备母猪或公猪时,应做好隔离适应工作,在确认没有回肠炎感染时或完成适宜的药物干预后,尚可混群。
4.2 选择适宜的药物与策略性给药方案
胞内劳森氏菌属于专一性的细胞内病原菌,在药物防控方面应注意以下3点:第一,敏感药物及其药动学。所选药物应在肠道上皮细胞内有较高药物浓度[8],如泰乐菌素、替米考星、泰妙菌素等。第二,用药周期。用药周期应在14 d以上,最好可达到21 d;第三,用药时间。在胞内劳森氏菌感染高峰期到达之前给药可取得良好效果。若给药时间“太早”,猪群就无法产生针对胞内劳森氏菌的主动免疫,潜在暴发急性出血性回肠炎的风险。
泰乐菌素在控制回肠炎感染时,既抑制了胞内劳森氏菌在肠壁的大量繁殖,又不影响动物机体针对胞内劳森氏菌形成主动免疫,停药后能依赖机体的主动免疫进行自我保护,因此泰乐菌素目前是全球控制回肠炎的首选药物。结合本次检测结果,对回肠炎的策略性投药作如下推荐:
方案一,生长育肥期:为了降低生长猪回肠炎的感染压力,建议在10周龄~12周龄使用磷酸泰乐菌素110 mg/kg拌料,连续3周,以后每月用一周,110 mg/kg拌料,直到上市前5 d。
方案二,分娩母猪群:为了降低环境中的劳森氏菌的感染压力及阻断劳森氏菌由母猪传递给仔猪,建议在产前1周至产后2周使用磷酸泰乐菌素(110 mg/kg拌料)。
方案三,后备母猪:为防止后备母猪引种时引入胞内劳森氏菌,后备母猪混群后造成母猪群呈持续性高感染压力状态,建议在后备母猪群转入到基础母猪群前,利用磷酸泰乐菌素(110 mg/kg拌料)连续3周。使母猪群更健康,在降低回肠炎感染的同时,也可防控支原体,萎缩性鼻炎等呼吸系统疾病。
[1] Smith S H, McOrist S. Development of persistent intestinal infection and excretion of Lawsonia intracellularis by piglets [J]. Res Vet Sci,1997,62:6-10.
[2] Jensen M.Health management with reduced antibiotic use-experiences of a Danish pig vet[J]. Anim Biotechnol,2006,17:189-194.
[3] Winkelman N L, Dee S.Ileitis:an update[C].Comp Contin Educ,1996,18:S19-S25.
[4] Jensen T K, et al. Naturally acquired Lawsonia intracellularis infection in pigs studied from weaning to slaughter by indirect immunofluorescence antibody test and polymerase chain reaction on faeces[J]. Res Vet Sci, 2005,79:93-98.
[5] 杨小燕,郑新添,陈杰,等.闽西地区猪增生性肠炎的调查[J].动物医学进展,2010,31(10):126-128.
[6] Stege H, Jensen T K, M!ller K, et al. Infection dynamics of Lawsonia intracellularis in pig herds[J]. Vet Microbiol, 2004, 104: 197-206.
[7] Guedes R M C, Gebhart C J,Armbruster G A, et al. Serologic follow-up of a repopulated swine herd after an outbreak of proliferative hemorrhagic enteropathy[J].J Vet Res,2002,66 (4):258-263.
[8] Paradis M A, Pauling G E,Brennan M J. Evaluation of tylosin tartrate in drinking water for treatment of porcine proliferative enteropathy(ileitis)[J]. J Swine Health Prod,2004,12(4):176-181.

