海藻酸盐支架-骨髓间充质干细胞复合物在急性肝衰竭大鼠体内的应用
林继宗, 胡昆鹏, 陈署贤, 汤照峰, 林 楠, 许瑞云
(中山大学附属第三医院肝胆外科,广东 广州 510630)
海藻酸盐支架-骨髓间充质干细胞复合物在急性肝衰竭大鼠体内的应用
林继宗, 胡昆鹏, 陈署贤, 汤照峰, 林 楠, 许瑞云△
(中山大学附属第三医院肝胆外科,广东 广州 510630)
目的: 探讨海藻酸盐支架-骨髓间充质干细胞(BMSCs)复合物在急性肝衰竭大鼠体内应用的可能性,为人工肝组织的体内应用提供基础。方法BMSCs用氯甲基苯甲酰氨荧光染料(CM-DiI)标记后种植于海藻酸盐支架形成支架细胞复合物。动物分实验组和对照组,构建70%肝切除大鼠模型,实验组大鼠给予支架细胞复合物平铺于肝脏创面上,对照组给予单纯支架。4周后取出支架细胞复合物行荧光显微镜追踪观察;切片行白蛋白及糖原染色追踪支架上细胞的分化;同时比较两组大鼠生存率及肝功能变化情况。结果CM-DiI能很好地标记细胞。体内应用后BMSCs能够在海藻酸盐支架上分泌白蛋白,合成糖原。实验组大鼠的生存率及肝功能改善情况优于对照组。结论海藻酸盐支架-BMSCs复合物在急性肝衰竭大鼠体内能够起到部分肝功能支持的作用。
海藻酸盐支架; 骨髓间充质干细胞; 急性肝功能衰竭; 人工肝
目前,对于各种终末期肝脏疾病来说,肝移植是唯一的治疗手段,但是由于供肝紧缺和终身的免疫抑制药物治疗大大限制了肝脏移植的应用。在这种情况下,为这些患者寻找另一种治疗方法来替代肝脏移植便成为了新的焦点。近年来,肝组织工程的发展为各种终末期肝病的治疗带来了新的思路和希望[1]。肝组织工程即把合适的种子细胞与生物支架材料相结合,在一定的微环境下,经过诱导培养,形成一定量的肝实质细胞和组织,再移植到患者体内以修复或替代肝脏的功能;其最终目标是构建一个完整的、有功能的、可移植的肝脏。寻找合适的种子细胞和生物支架材料是肝组织工程的两个首要任务。目前组织工程最有希望的种子细胞即骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs),它来源丰富,取材方便,具有多向分化潜能及低免疫源性等特点,而且目前众多实验研究表明BMSCs在体内外均能被诱导分化为肝细胞[2-3];而海藻酸盐支架具有良好的亲水特性、疏松多孔的立体结构和优越的组织相容性已经被作为细胞载体在组织工程上广泛应用。本研究团队在之前的研究中构建了BMSCs和海藻酸盐三维支架复合物,并利用此复合物在体外进行人工肝组织的构建研究,研究发现二者有望成为肝组织工程新的种子细胞和细胞载体[4]。
目前,以生物反应器技术为基础的生物人工肝更多的被应用于体外支持,但是由于技术的限制、高额的花费和护理上的特殊要求使得这项技术难以得到长期应用。因此,利用三维、多孔的生物材料和细胞移植技术为内容的肝脏组织工程在体内实现肝脏功能支持成为一个新的研究焦点[1]。为探讨海藻酸盐支架-BMSCs复合物是否适合体内应用,我们拟通过制作70%肝切除大鼠模型,将此复合物移植到大鼠体内,研究BMSCs的分化及此复合物对大鼠肝脏功能的支持作用,为生物人工肝的体内应用提供实验基础和依据。
材 料 和 方 法
1材料
Wistar大鼠购自中山大学动物实验中心;海藻酸盐购自Sigma;DMEM/F12 培养液购自Gibco;氯甲基苯甲酰氨荧光染料(chloro- methylbenzamido dialkyl-carbocyanine, CM-DiI)和Hoechst 33258购自Invitrogen;羊抗鼠白蛋白(albumin, ALB)抗体购自Sigma。
2方法
2.1BMSCs的分离、培养 按照文献[5]介绍的方法分离培养BMSCs。
2.2海藻酸三维支架的制备 用0.1%PBS配制6%的海藻酸水溶液,搅拌均匀,高温高压(120 ℃、0.15 MPa)灭菌,4 ℃备用;种入细胞前用α-2MEM稀释,终浓度为3%。吸取3%的海藻酸钠水溶液700 μL滴入24孔塑料培养板的孔中,在孔内形成约1 mm厚度的圆盘,再滴入0.1% CaCl22 mL于圆盘上,静置40 min。待凝胶形成后弃去CaCl2,改用2 mL α-2MEM浸泡,放入4 ℃冰箱,每24 h更换α-2MEM 1次,72 h后用于细胞培养。
2.3用CM-DiI标记BMSCs并种植于海藻酸盐支架内 将CM-DiI用二甲基亚砜(dimethyl sulfoxide,DMSO)配成1 g/L溶液;选生长良好的3~6代BMSCs约5×106用DPBS(Dulbecco’s phosphate-buffered saline)制成细胞悬液约500 μL,加入CM-DiI液约5 μL,37 ℃孵育10 min,4 ℃冰箱放置20 min,PBS洗3遍后再重悬为50 μL的细胞悬液接种于海藻酸盐支架内,剩余少量悬液接种于24孔板内观察标记的情况。
2.4荧光纤维镜下观察CM-DiI标记的BMSCs的生长情况 将种植在24孔板内的支架细胞复合物放置于荧光显微镜下分别用普通光和波长在540~650 nm范围内的光观察。
2.5实验分组 成年SD大鼠20只,雌雄各半,分为实验组(A组)和对照组(B组),每组10只。
2.6部分肝切除大鼠模型的建立及海藻酸盐支架-BMSCs复合物的植入 大鼠用5%水合氯醛以6 mL/kg腹腔内注射,麻醉成功后取腹部正中切口逐层开腹,分离剪断肝周韧带,采用丝线近肝门处结扎法依次切除肝左叶、中叶,用丝线切割法切除部分肝右上及右下叶,形成肝脏创面,约切除70%肝脏,创面压迫止血,建立70%肝切除大鼠模型。将标记了CM-DiI的支架细胞复合物从24孔板内取出,平铺在实验组大鼠右肝创面上后关腹;对照组大鼠只单纯平铺海藻酸盐支架后关腹。术后大鼠注意保温,室温维持在25~28 ℃。
3观察指标
3.1大鼠术后生存率 术后每天观察大鼠的生存情况并记录大鼠的死亡时间至术后第4周。
3.2术后肝功能指标的变化 各组大鼠分别于术前、术后第1 d、第14 d从尾静脉采血,在全自动生化分析仪上检测大鼠天门冬氨酸氨基转移酶(aspartate transaminase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和白蛋白(albumin,ALB)。
3.3冰冻切片观察支架细胞复合物情况 术后的第4周处死实验组和对照组大鼠并取出支架-细胞复合物,在冰冻切片机内制成厚度约4微米的冰冻切片,置于荧光显微镜下观察,Hoechst 33258染核观察细胞形态及分布情况。
3.4免疫组化法检测复合物内BMSCs的分化 4%多聚甲醛固定冰冻切片30 min后,用含0.01% Triton的PBS溶液漂洗3次,滴加3% H2O2溶液作用30 min,PBS溶液漂洗,滴加羊抗鼠ALB溶液,4 ℃孵化过夜,再用DAB显色,苏木素复染5 min,自来水冲洗,脱水、透明、常规中性树胶封片,在普通显微镜下观察。
3.5糖原染色观察复合物内细胞糖原储存的功能 另取部分切片,AAF液(5%冰醋酸+15%甲醛+85%无水乙醇)固定15 min,PBS洗3次,每次3 min;5 g/L高碘酸氧化10 min,蒸馏水稍洗,雪夫(Schiff)试剂避光染色20 min,5 g/L焦亚硫酸钠滴洗3 min× 3次,蒸馏水稍洗,苏木素复染5 min,流水浸洗,脱水、透明、常规中性树胶封片,在普通显微镜下观察。
4统计学处理
结 果
1荧光显微镜下观察CM-DiI标记的BMSCs及支架-细胞复合物情况
在波长为540~650 nm范围内可观察到平面上的BMSCs呈长梭形,细胞膜全部红染,荧光分布均匀,细胞核无红染,核完整;支架上的BMSCs呈红色的球形结构,团块性聚集生长,见图1。

Figure 1. The morphology of BMSCs labeled by CM-DiI (fluorescent microscopy, ×200). A: monolayer cells;B: cells in the alginate scaffold.
2荧光显微镜下观察复合物冰冻切片
手术后第4周于A组大鼠腹腔中取出支架与细胞的复合物,冰冻切片可以看到强烈的红色荧光沿着支架纤维分布,Hoechst 33258染核后,可以看到细胞黏附于支架纤维上沿着纤维生长,所有的细胞核周围均有红色荧光分布,见图2;而B组切片内未见红色荧光,Hoechst 33258染色后切片上可见少量蓝色荧光。
3免疫组化法检测复合物内BMSCs的分化
白蛋白免疫组化结果显示,A组支架上的部分细胞周围可见棕色颗粒,见图3A;而B组大鼠支架上可见部分炎性细胞附着,但未见棕色颗粒,见图3B。

Figure 2. The morphology of alginate scaffolds with BMSCs 4 weeks after transplanted into the rats (fluorescent microscopy, ×200). A: labeled by CM-DiI (red);B: labeled by CM-DiI (red) and Hoechst 33258 (blue).

Figure 3. The synthesis of albumin by the cells in alginate scaffolds (immunohistochemical staining, ×200). A: the liver of an acute hepatic failure rat transplanted with alginate scaffold and BMSCs; B: the liver of an acute hepatic failure rat transplanted with alginate scaffold alone.
4糖原染色检测复合物内细胞储存糖原的功能
糖原染色结果显示,A组支架上的部分细胞胞浆红染,见图4A,已具备储存糖原功能;而B组大鼠支架上可见部分炎性细胞附着,但未见胞浆红染的细胞,见图4B。

Figure 4. The synthesis of glycogen by the cells in alginate scaffolds (periodic acid-Schiff staining, ×400).A: the liver of an acute hepatic failure rat transplanted with alginate scaffold and BMSCs; B: the liver of an acute hepatic failure rat transplanted with alginate scaffold alone.

Figure 5. The cumulative survival rate of the two groups of rats. The rate of group A was higher than that of group B (n=10,Plt;0.05). A: the acute hepatic failure rats transplanted with alginate scaffold and BMSCs; B: the acute hepatic failure rats transplanted with alginate scaffold alone.
5大鼠生存率比较
实验结束后A组大鼠共死亡2只,存活率为80%;B组死亡5只,存活率为50%。经log-rank检验发现,A组存活率高于B组(Plt;0.05)。
6大鼠肝功能指标比较
术前A和B组大鼠各项肝功能指标检查均无显著差异(Pgt;0.05), 表明实验前两组大鼠肝功能状态基本一致。术后第1 d,两组大鼠各项肝功能指标检查也无显著差异(Pgt;0.05)。术后第14 d,A组大鼠和B组大鼠ALT之间的差异有统计学意义(Plt;0.05),见表1。
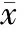
表1 各组大鼠肝功能指标的比较
讨 论
急性肝衰竭、肝硬化、肝癌等肝脏疾病目前仍是医学工作者面临的难题,死亡率非常高。随着20世纪90年代组织工程学概念的提出和不断发展,肝组织工程成为终末期肝病治疗的研究热点并取得显著进展。研发可供体内应用的人工肝脏是肝脏组织工程研究的焦点[6]。
肝组织工程研究的首要任务就是选择可靠的细胞来源,并能提供足够的细胞数量。BMSCs由于本身所具有的可塑性,在体外经特定诱导条件下可分化肝细胞,在肝脏组织的修复过程中,BMSCs又是肝细胞的重要肝外来源,可分化成肝干细胞及肝细胞,从而参与肝功能的修复和重构,使得BMSCs成为肝脏组织工程最有希望的种子细胞。至于材料的选择方面,天然基质材料具有良好的细胞相容性和亲和性,被广泛应用于组织工程的细胞载体[7]。海藻酸是从褐藻中提取的一种酸性多糖, 由古洛糖醛酸与甘露糖醛酸组成的嵌段聚合物, 可与二价金属离子络合形成网状开放晶格的水凝胶,其酶解产物对人体无毒害作用,而且该水凝胶具有很好的亲水性, 营养物质易于渗透扩散[8]。在我们前期的研究工作中发现海藻酸支架有非常适合BMSCs生长的特性,BMSCs在海藻酸支架上能够很好地黏附和扩增,在HGF和其它生长因子的作用下,BMSCs能够被诱导向肝细胞方向分化,表现出肝细胞的特性,研究结果表明BMSCs有望成为肝组织工程新的种子细胞和细胞载体。
目前,利用BMSCs的特性来治疗肝功能不全的研究大多都只局限于单纯利用细胞移植技术,如门静脉注射、脾脏注射、腹腔内或肝内注射等[9],将BMSCs移植到肝功能不全的动物模型体内后能改善动物的肝功能。但是,当注射较大细胞量时,单纯的细胞移植也存在如门静脉血栓形成、肺动脉或肝内血管栓塞、脾破裂等诸多不足[9]。本研究则结合三维多孔支架和细胞移植技术为核心技术,在体内实现肝脏功能支持。与单纯的细胞移植相比,三维支架能够为大剂量细胞提供足够的空间;同时通过对支架成分和形态的优化能够提高细胞移植效率。
70%肝切除的大鼠肝脏会分泌大量的肝源性细胞因子,如转化生长因子α(TGF-α)、表皮生长因子(EGF)、肝细胞生长因子(HGF)等,这些因子在肝细胞再生过程中起着重要的作用[10]。这些因子在肝内的富集同时也为BMSCs向肝细胞分化提供了优越的体内环境。一旦BMSCs来到受损的肝脏内,局部微环境就可以激活使BMSCs表型改变的基因,转化为有功能的肝细胞,参与肝脏再生,促进损伤肝脏修复[11]。肝功能不全大鼠体内的微环境能够诱导BMSCs在支架材料上向肝细胞分化并在体内实现肝脏功能的支持,这是BMSCs源性人工肝组织体内应用的依据。我们的实验结果显示,支架上的BMSCs在肝功能不全大鼠体内同样能够分泌白蛋白并合成糖原,初步具有肝细胞的功能;同时实验组大鼠的生存率和肝功能改善均优于对照组。此部分结果同样证明BMSCs在体内可以分化为肝细胞,BMSCs源性的人工组织在体内能够改善肝功能不全大鼠的肝功能。构建适合体内应用的人工肝组织是肝组织工程的研究热点,我们的研究为BMSCs源性人工肝组织在体内的进一步应用提供了基础和依据。
通过对移植到体内的支架细胞复合物的免疫组化检测,我们发现手术后4周实验组海藻酸支架上部分细胞有白蛋白抗体的表达,糖原染色也发现部分细胞具有合成糖原的能力;而对照组海藻酸支架上虽然有部分细胞附着,但所有细胞均无白蛋白表达和糖原的合成。合成白蛋白和糖原储存这两项功能正是肝细胞所特有的,这说明在这2种大鼠模型内,种植在海藻酸支架上的BMSCs可以向肝细胞方向分化。我们通过对实验组和对照组大鼠存活率和术后肝功能指标的比较发现,实验组大鼠在存活率上高于对照组(Plt;0.05)。在肝功能指标上可以看到,在术后的第14 d,70%的肝切除实验组大鼠血清ALT的恢复情况也优于对照组。这说明,海藻酸支架-BMSCs复合物移植于肝衰竭大鼠体内后,支架上的BMSCs不仅能够分化为肝细胞,而且此复合物在体内还能够改善肝功能不全大鼠的肝功能。但在术后第14 d,两组大鼠的血清AST和ALB没有明显差异,这可能与几个因素有关。第一,我们移植的细胞数或者在第14 d已经转化为有部分肝细胞功能的BMSCs不够,而不能对肝衰竭大鼠的肝脏功能起更大的支持作用。第二,本实验中采用的细胞支架未进行预血管化,我们知道,要尽可能发挥移植物的作用,促进移植物与受体之间的血管联系是非常重要的。本实验中,海藻酸盐支架-BMSCs复合物在肝衰竭大鼠体内还未能够全面改善大鼠的肝脏功能,可能与移植物还未完全与受体形成丰富的血管网,直接影响其功能的发挥。这些不足同时也给我们下一阶段的研究提供思路和方向。
体内研究BMSCs的分化,稳定持久的标记是最基本的要求。本研究以CM-DiI为材料标记BMSCs。CM-DiI是亲脂性荧光染料,易嵌入生物质膜内并在膜内作侧向运动,从而标记整个细胞。CM-DiI无细胞毒性,对标记细胞的存活、生长无影响,在标记细胞内消失慢[12]。本研究也发现在体外CM-DiI标记后的细胞荧光不容易淬灭,标记了CM-DiI的细胞仍能在海藻酸支架上良好地生长和扩增,对细胞无毒性作用;而在体内,4周后我们仍然能够发现支架上有稳定的强烈的荧光,荧光沿着支架纤维分布,这说明CM-DiI可以作为细胞体内示踪的稳定的染料。
我们把已标记了CM-DiI的大鼠BMSCs种植于海藻酸三维支架上,并将此复合物移植到70%肝切除的大鼠体内,证实支架上的BMSCs可以向肝细胞分化。目前,要使这一复合物在体内能更好地起到人工肝的作用还有很多问题要解决,包括如何实现此复合物管道化、如何使这些被诱导分化的细胞更具有肝细胞的功能等。这将为干细胞的体内追踪和构建可供体内移植的肝脏组织工程提供一定的实验基础和依据。
[1]Fiegel HC, Kaufmann PM, Bruns H, et al. Hepatic tissue engineering: from transplantation to customized cell-based liver directed therapies from the laboratory [J]. J Cell Mol Med, 2008, 12(1):56-66.
[2]Ong SY, Dai H, Leong KW. Inducing hepatic differentiation of human mesenchymal stem cells in pellet culture[J]. Biomaterials, 2006, 27(22):4087-4097.
[3]刘 芳,陈少红,刘青波,等.黄嘌呤核苷促进骨髓间质干细胞体外快速扩增的实验研究[J].中国病理生理杂志,2010,26(12):2389-2393.
[4]Lin N, Lin J, Bo L, et al. Differentiation of bone marrow-derived mesenchymal stem cells into hepatocyte-like cells in an alginate scaffold[J]. Cell Prolif, 2010, 43(5):427-434.
[5]林继宗, 汤照峰, 方和平, 等. 以海藻酸三维支架构建骨髓间充质干细胞源性生物人工肝组织的实验研究[J]. 中华普通外科杂志, 2009, 24(3): 234-237.
[6]Kulig KM, Vacanti JP. Hepatic tissue engineering[J]. Transpl Immunol, 2004, 12(3-4):303-310.
[7]李 羽, 徐 哲, 张 岩, 等. 生物人工肝中肝细胞材料的研究及应用现状[J]. 医学研究生学报, 2004, 17(10): 932-935.
[8]Drury JL, Boontheekul T, Mooney DJ. Cellular cross-linking of peptide modified hydrogels[J]. J Biomech Eng, 2005, 127(2):220-228.
[9]王连友, 徐 辉, 董世武, 等. 骨髓间充质干细胞在小鼠肝脏局部分化为肝细胞的实验研究[J]. 胃肠病学和肝病学杂志, 2008, 17(1): 27-29.
[10]Deakin JA, Blaum BS, Gallagher JT, et al. The binding properties of minimal oligosaccharides reveal a common heparan sulfate/dermatan sulfate-binding site in hepatocyte growth factor/scatter factor that can accommodate a wide variety of sulfation patterns[J]. J Biol Chem, 2009, 284(10):6311-6321.
[11]谭浩翔, 高 毅, 陈建锋. 人骨髓间充质干细胞移植在大鼠肝再生衰竭中的作用[J]. 中华肝脏病杂志, 2007, 15(6):473-474.
[12]Weir C, Morel-Kopp MC, Gill A, et al. Mesenchymal stem cells: isolation, characterisation andinvivofluorescent dye tracking[J]. Heart Lung Circ, 2008, 17(5):395-403.
Invivouseofalginatescaffoldwithbonemarrowmesenchymalstemcellsinacutehepaticfailurerats
LIN Ji-zong, HU Kun-peng, CHEN Shu-xian, TANG Zhao-feng, LIN Nan, XU Rui-yun
(DepartmentofHepatobiliarySurgery,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:xuruiyun@yahoo.com.cn)
AIM: To evaluate the use of alginate scaffold with bone marrow mesenchymal stem cells (BMSCs) in a rat acute hepatic failure model.METHODSBMSCs were labeled with chloro- methylbenzamido dialkylcarbocyanine (CM-DiI), cultured in alginate scaffold and transplanted into the liver of acute hepatic failure rats with 70% liver resection. Four weeks later, the scaffold-cell complexes were taken out, and their abilities to secret albumin (ALB) and store glycogen were examined. The survival rate and liver functions of the rats were also examined.RESULTSCM-DiI was an effective cell tracer. The BMSCs in alginate scaffold secreted ALB and stored glycogen in acute hepatic failure rats. The survival rate and liver functions of the rats treated with scaffold-cell complexes were better than those of the rats treated with alginate alone.CONCLUSIONAlginate scaffold with BMSCs can be used as artificial hepatic tissues in acute hepatic failure rats.
Alginate scaffold; Bone marrow mesenchymal stem cells; Acute hepatic failure; Artificial liver
1000-4718(2011)12-2382-05
R318
A
10.3969/j.issn.1000-4718.2011.12.027
2011-08-14
2011-10-20
△通讯作者 Tel: 020-85253178; E-mail: xuruiyun@yahoo.com.cn

