哮喘小鼠气道重塑中α平滑肌肌动蛋白的表达①
朱艳芬 宋泽庆 (广东医学院附属医院呼吸内科,湛江524000)
气道重塑是哮喘的重要特征,与重症哮喘密切相关,特征性改变是上皮下纤维化和气道平滑肌细胞(Airway Smooth Muscle Cells,ASMC)增生肥大[1,2]。气道重塑一旦形成难以可逆,目前临床上尚缺乏简单可行的检测和治疗方法,所以气道重塑成为哮喘防治的难点和重点。α-SMA是肌纤维细胞亚类之一,也是平滑肌的主要标志物,可反映平滑肌数量及其收缩能力,具有收缩潜能和较强的胶原合成能力,可导致管腔收缩狭窄,哮喘发作。α-SMA表达增加可能与哮喘气道重塑,哮喘症状发作有密切关系。本研究旨在探讨人类主要过敏原屋尘螨提取液(House Dust Mite Extract,HDM)诱导的小鼠哮喘模型中肺组织中α-SMA与哮喘气道重塑的关系,为临床支气管哮喘诊治提供理论依据。
1 材料与方法
1.1 动物及主要试剂 6~8周雌性SPF级BALB/c小鼠广东医学院实验动物中心提供,合格证号2008A040。标准化的HDM,购自丹麦ALK公司,产品号ALK(503),主要成分是Derp1和Derp2,含量为1×108U/L。兔抗小鼠α-SMA多克隆抗体、免疫组化超敏SP试剂盒购自北京中杉金桥生物技术有限公司;PCR 引物 、GAPDH 内参、Trizol、RT-PCR Kit、SYBR Green PCRMaster Mix等购自宝生物工程(大连)有限公司。
1.2 动物分组 SPF级雌性BALB/c小鼠90只,体质量(18±2)克,随机分为空白对照组、HDM 低剂量组和HDM 高剂量组,每组再分为 3、6、9周三个亚组,每亚组均为10只动物。
1.3 致敏和激发步骤 参考Ahn的模型构造方法[3],并做适当调整。HDM低剂量组和HDM高剂量组分别用含2%氢氧化铝2×106U/L HDM和2%氢氧化铝4×106U/LHDM 0.05ml,第1天皮下注射致敏小鼠,第8、15天腹腔注射同样浓度和剂量的HDM。第17天开始,用1%戊巴比妥0.15 ml腹腔注射麻醉小鼠后,HDM低剂量组用2×106U/L和HDM高剂量组用4×106U/L的HDM 0.05 ml缓慢滴鼻激发,每周一、三、五共3次。最后3天每天1次激发,剂量和浓度同前,总计致敏和激发时间分别达到3、6和9周。空白对照组致敏和激发步聚同实验组,以0.01 mol/L的PBS替代HDM。最后1次滴鼻激发后24小时,进行以下操作。
1.4 肺组织病理改变 取小鼠肺组织,固定于10%甲醛溶液中过夜,石蜡包埋,切片HE染色,在40倍镜下观察肺组织的大体观,选定病变的视野,在200倍光镜下观察肺组织病理改变并进行炎性计分[3]。200倍光镜下找到5个完整的支气管横断面,且气管最小直径/最大直径≥0.5,参照文献[4]。通过MetaMorph图像分析软件测量支气管内周长(Internal Perimeter,Pi)、气道内径(Internal Diameter,D1)、气道外经(Outer Diameter,D2)、测量结果用内周长进行标准化,气道内外径比值为D1/D2。400倍光镜下采集5处视野,计数支气管周围单位气道面积(2 200μm2)内炎性细胞数目,以评估气道炎症。
1.5 免疫组织化学法检测肺组织中α-SMA表达量 免疫组织化学染色法步骤按SP说明书进行,光学显微镜下观察组织着色情况,α-SMA蛋白阳性反应呈淡黄色至棕褐色,定位于细胞质。无着色为阴性,淡棕黄色为弱阳性,棕黄色为阳性,深棕黄色为强阳性。通过MetaMorph图像分析软件测量,以固定颜色模式界定平滑肌,测定平滑肌面积(Area of Smooth Muscle of Bronchial-Wall,WAm),支气管内周长(Internal Perimeter,Pi)并计数其被染色的平滑肌细胞核数,测量结果用内周长进行标准化,平滑肌厚度表示为WAm/Pi,ASMC细胞核数表示为N/Pi。
1.6 qRT-PCR法检测肺组织中α-SMA基因表达 目的基因qm-α-SMA,F5′-gtggtcaggaatagatgtg-3′,R5′-ctagctgtgaagtcagtgt-3′(193 bp);内参照 18SrRNA,qm-α-SMA,F5′-ggatggcatcaatcacttc-3′,R5′-gcatatccatgcacgtgt-3′(112 bp)。实时定量 PCR样品反应体系采用SYBR Green I,其最终的反应体系为20μl,循环条件为:95℃10分钟、95℃ 15 秒、72℃ 30秒、60℃15秒,40个循环后,绘制18S rRNA、α-SMA的荧光扩增曲线和溶解曲线,并得到各自的荧光域值循环数(Ct值),计算其均值的比值。
1.7 统计学处理 炎性病理计分采用中位数(全距)表示,其余数据以±s表示,实验数据资料采用统计学软件SPSS13.0进行统计分析。P<0.05表示差异有统计学差异。
2 结果
2.1 哮喘模型的构建成功 通过对小鼠反应性观察,HDM高剂量和HDM低剂量组小鼠不同程度上表现出毛色欠光泽,食欲下降、大小便失禁、烦躁不安、喘息、呼吸困难甚至死亡等哮喘症状;测定肺泡灌洗液中IL-4和血清总IgE,HDM高剂量和HDM低剂量组也有相应升高,表明哮喘模型构建成功[5]。
2.2 肺的病理组织学检测 HDM高剂量组3周时支气管粘膜水肿、支气管粘膜下和周围肺组织有明显的炎细胞浸润,随时间增加,气道重构和肺气肿现象显著,炎性病理计分明显升高;HDM低剂量组炎性病理计分升高,但炎细胞浸润,气道重构等改变较HDM高剂量组轻微;空白组均未见明显炎细胞浸润及气道重构改变(见表1)。与空白组对比,HDM高、低剂量组在3、6、9周时气道D1/D2明显减小,炎性细胞数目增加。与HDM低剂量组对比,HDM高剂量组3周时炎性细胞改变有统计学差异;随时间增加D1/D2有下降趋势,炎性细胞有增加趋势,但改变无统计学意义(见表2)。
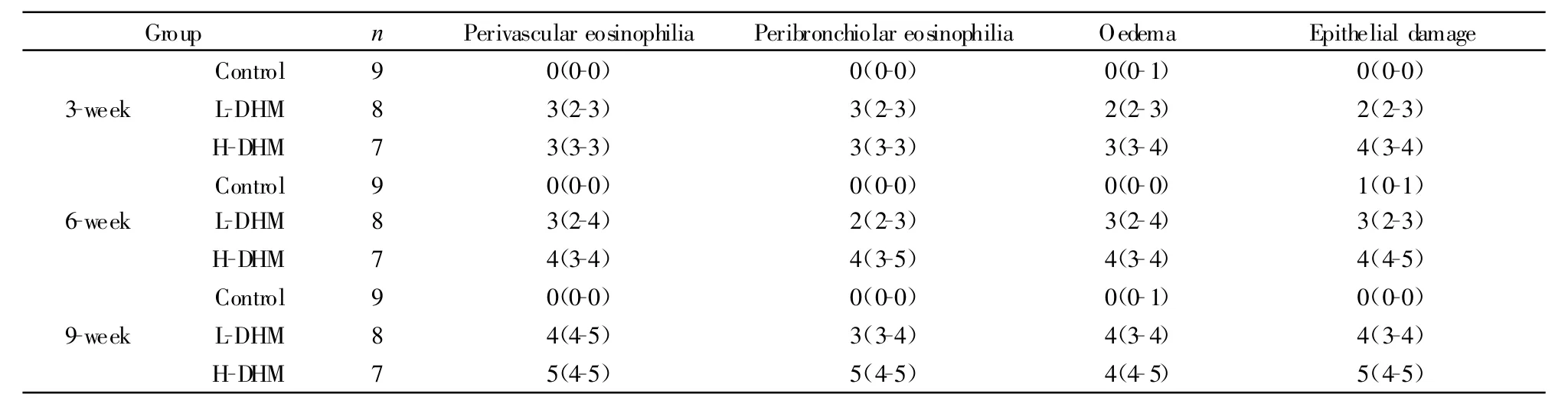
表1 尘螨致敏小鼠肺组织病理炎症计分中位数(全距)Tab.1 Histopathological scores mean of murine pulmonary inflammation sensitized by HDM with range in parenthesis(Range)
2.3 肺组织中α-SMA表达的变化 α-SMA表达阳性细胞为胞浆呈现棕褐色或棕黄色颗粒。HDM高剂量组中可见支气管壁上ASMC和血管平滑肌存在大量被染成褐色α-SMA强阳性反应细胞,同时可见大量的炎症细胞浸润;HDM低剂量组可见α-SMA免疫反应呈阳性反应,少量炎细胞浸润;空白组呈弱阳性反应,未见到明显炎细胞浸润现象(如图1~3)。通过定量分析,与空白组对比,HDM高剂量组在3周时开始Wam/Pi、N/Pi显著增加;而HDM 低剂量组在6周时开始增加显著,随时间的延长,改变越来越显著。HDM高剂量组比低剂量组增加显著,(如表3)。
表2 尘螨致敏小鼠支气管炎细胞数、内外径比值的变化( ±s)Tab.2 Thecharacteristic of inflammation cells,D1/D2 in mice(±s)
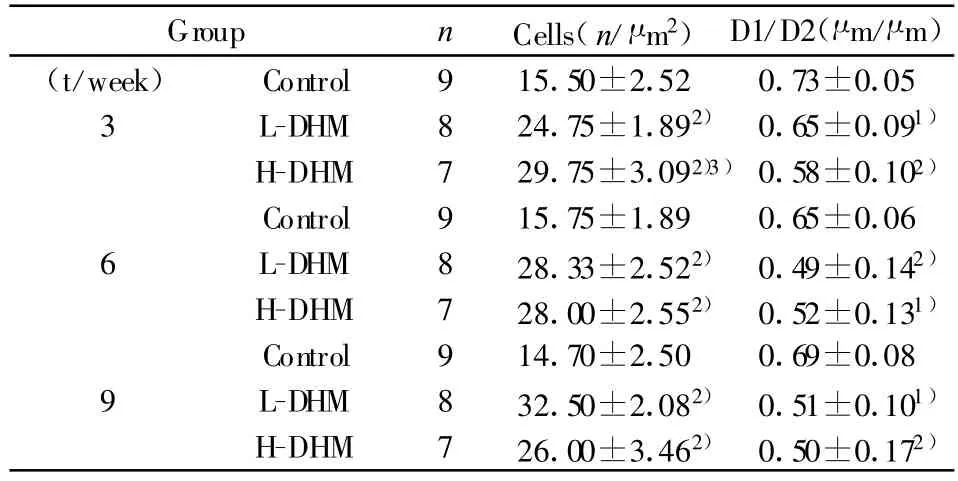
表2 尘螨致敏小鼠支气管炎细胞数、内外径比值的变化( ±s)Tab.2 Thecharacteristic of inflammation cells,D1/D2 in mice(±s)
Note:Compared with control,1)P<0.05,2)P<0.01;compared with low dose,3)P<0.01.
Group n Cells(n/μm2)D1/D2(μm/μm)(t/week) Control 9 15.50±2.52 0.73±0.05 3 L-DHM 8 24.75±1.892) 0.65±0.091)H-DHM 7 29.75±3.092)3)0.58±0.102)Control 9 15.75±1.89 0.65±0.06 6 L-DHM 8 28.33±2.522) 0.49±0.142)H-DHM 7 28.00±2.552) 0.52±0.131)Control 9 14.70±2.50 0.69±0.08 9 L-DHM 8 32.50±2.082) 0.51±0.101)H-DHM 7 26.00±3.462) 0.50±0.172)

图1 3周时α-SMA在各组中的表达(×400)Fig.1 Expression ofα-SMA in various groups in three-week(×400)

图2 6周时α-SMA在各组中的表达(×400)Fig.2 Expression ofα-SMA in various groups in six-week(×400)

图3 9周时α-SMA在各组中的表达(×400)Fig.3 Expression ofα-SMA in various groups at nine-week(×400)
表3 尘螨致敏小鼠气道平滑肌面积(WAm/Pi)和平滑肌细胞(N/Pi)的变化±s)Tab.3 The characteristic of WAm/Pi and N/Pi in mice sensitized by HDM(±s)
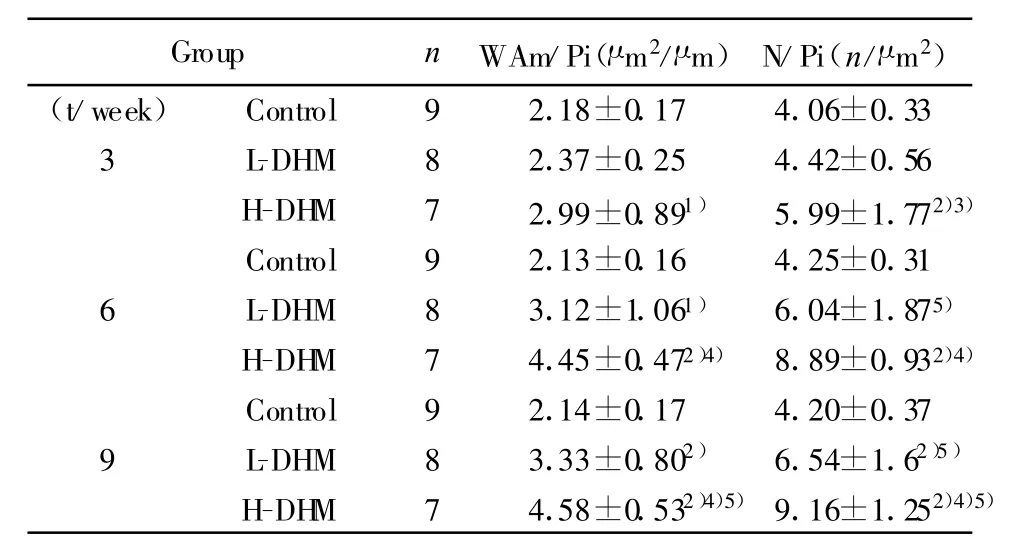
表3 尘螨致敏小鼠气道平滑肌面积(WAm/Pi)和平滑肌细胞(N/Pi)的变化±s)Tab.3 The characteristic of WAm/Pi and N/Pi in mice sensitized by HDM(±s)
Note:Compared with control,1)P<0.05,2)P<0.01;Compared with low dose,3)P<0.05,4)P<0.01;Compared with 3-week,5)P<0.05.
Group n WAm/Pi(μm2/μm)N/Pi(n/μm2)(t/week) Control 9 2.18±0.17 4.06±0.33 3 L-DHM 8 2.37±0.25 4.42±0.56 H-DHM 7 2.99±0.891) 5.99±1.772)3)Control 9 2.13±0.16 4.25±0.31 6 L-DHM 8 3.12±1.061) 6.04±1.875)H-DHM 7 4.45±0.472)4) 8.89±0.932)4)Control 9 2.14±0.17 4.20±0.37 9 L-DHM 8 3.33±0.802) 6.54±1.62)5)H-DHM 7 4.58±0.532)4)5)9.16±1.252)4)5)
表4 尘螨致敏小鼠后肺组织α-SMA mRNA表达的变化(±s)Tab.4 The expression ofα-SMA mRNA in mice sensitized by HDM(±s)

表4 尘螨致敏小鼠后肺组织α-SMA mRNA表达的变化(±s)Tab.4 The expression ofα-SMA mRNA in mice sensitized by HDM(±s)
Note:Compared with control,1)P<0.01;Compared with low dose,2)P<0.05,3)P<0.01;Compared with 3-week,4)P<0.05.
Group n α-SMA mRNA(2-△△CT)(t/week)3 6 9 Control 9 2.11±0.86 2.16±0.87 2.39±0.61 L-DHM 8 2.97±0.40 4.50±0.31)4) 4.76±0.621)4)H-DHM 7 4.15±0.391)2) 5.97±0.511)3)4) 6.32±0.761)2)4)
2.4 肺组织中α-SMA mRNA含量的变化 RNA电泳可见三条清晰条带表明提取RNA完整。与空白组对比,HDM高、低剂量组肺组织中α-SMA mRNA表达显著增加,随时间延长增加越来越显著;HDM高剂量组比HDM低剂量组增加显著(见表4)。
3 讨论
气道重塑是严重哮喘和难治性哮喘的主要病理基础,也是哮喘防治的难点及热点。通过图像测量和病理炎性计分表明:3周时炎细胞浸润显著,6周时气道重塑显著,9周时气道破坏严重。该结果可由哮喘发展过程解释,小鼠受过敏原反复刺激3周时出现典型的哮喘气道变应性炎症,并出现轻微气道重塑现象。随时间增加反复过敏原刺激导致气道炎症转变为慢性炎症持续,平滑肌肌层肥厚,上皮细胞下纤维化、基底膜增厚等气道重塑改变越来越显著;9周时在严重气道重塑基础上出现肺泡间隔断裂形成肺大泡肺气肿征,表现为外周肺气肿严重,中心大气道壁增厚堵塞。Johnson等[6]和Kristina等[7]研究表明:屋尘螨诱导的哮喘小鼠滴鼻接触7周后能导致胶原沉积,上皮下纤维化,平滑肌细胞增殖,血管增生等病理改变,与本研究结果一致。HDM低剂量组3周时仅部分测量指标有显著意义,6、9周相对改变较明显。表明HDM高剂量组成功诱导稳定的气道重构模型,HDM低剂量模型相对不稳定。
支气管平滑肌增生肥大是慢性哮喘气道重塑的特征性改变,α-SMA是平滑肌的主要标志物,其含量对平滑肌的收缩能力具有较大影响,可反映平滑肌数量及其收缩能力的改变。哮喘气道慢性炎症能刺激成纤维细胞转变为肌成纤维细胞,此类转变表型的肌成纤维细胞能够促进α-SMA表达。本研究中,采用IH和qRT-PCR检测小鼠气道重塑的重要指标α-SMA蛋白和基因的表达。结果显示HDM高、低剂量组中可见支气管壁上被染成棕褐色α-SMA阳性反应细胞 ,Wam/P、N/Pi和 α-SMA mRNA 增加,同时可见炎症细胞浸润,与气道重塑改变一致。该结果说明:(1)哮喘小鼠的支气管壁发生了结构上的改变,出现了具有特征性改变的α-SMA的平滑肌细胞,具有较强的收缩能力,较易发生气道痉挛和气流受限,形成AHR[8];(2)气道壁平滑肌面积和单位面积平滑肌细胞增加,表明气道平滑肌细胞同时产生肥大和增生;(3)α-SMA mRNA显著增加,肌成纤维细胞亦表达α-SMA mRNA。哮喘气道上皮下纤维化时成纤维细胞增生亦可能使α-SMA表达增加;同时,成纤维细胞迁徙并转化为具有收缩能力的肌成纤维细胞,亦可能增加α-SMA mRNA表达[9]。
综上所述,HDM能成功诱导小鼠哮喘气道重塑模型,气道重塑在哮喘早期已经出现,并随着与过敏原接触时间延长越来越严重。α-SMA随气道重塑出现表达增强,可能与气道平滑肌细胞增生肥大以及肌成纤维细胞转化及其相互作用有关。α-SMA表达的增加可导致气道痉挛、狭窄及粘液分泌增多,进而导致AHR,加剧哮喘症状和疾病的发展。因此从肺组织中α-SMA表达来诊断和干预哮喘气道重塑的发生发展将为哮喘的诊治提供新的理论依据。
1 Holgate ST.The airway epithelium is central to the pathogenesis of asthma[J].Allergol Int,2008;57(1):1-10.
2 Hassan M,Jo T,Risse PA,Tolloczko B et al.Airway smooth muscle remodeling is a dynamic process in severe long-standing asthma[J].JAllergy Clin Immunol,2010;125(5):1037-1045.
3 Ahn JH,Kim CH,Kim YH et al.Inflammatory and remodeling eventsin asthmawith chronic exposure to house dust mites:a murine model[J].J Korean Med Sci,2007;22(6):1026-1033.
4 Bai A,Eidelman DH,Hogg JC et al.Proposed nomenclaturefor quantifying subdivisions of the bronchial wall[J].J Appl Physiol,1994;77(2):1011-1014.
5 朱艳芬,宋泽庆.支气管哮喘气道重构模型的构建及评价[J].吉林大学学报(医学版),2010;36(1):99-103.
6 Johnson J R,Wiley R E,Fattouh R et al.Continuous exposure to house dust mite elicits chronic airway inflammation and structural remodeling[J].Am JResp Crit Care Med,2004;169(3):378-385.
7 Kristina RT,Johnson JR,Fattouh R et al.Induction of vascular remeloding in the lung by chronic house dust mite exposure[J].Am JRespir Cell Mol Biol,2008;39(1):61-67.
8 Bush A.How early do airway in flanimation and remodelingoccur[J].Alle rgol Int,2008;57(1):11-19.
9 Michalik M,Pierzchalska M,Legutko A et al.Asthmatic bronchial fibrobla sts demonstrate enhanced potential to differentiate into myofibroblasts in culture[J].Med Sci Monit,2009;15(7):194-201.

